Патофизиология вегетативно-сосудистых пароксизмов (приливы) в период менопаузы у женщин и механизмы воздействия b-аланина. Новая клинико-фармакологическая концепция
СтатьиОпубликовано в журнале:
«ГИНЕКОЛОГИЯ»; ТОМ 12; № 2; стр. 1-12.
О.А.Громова1,2, И.Ю.Торшин1,2, О.А.Лиманова1,2, А.А.Никонов1,3
1Российский сотрудничающий центр «Нейробиология» Международного института микроэлементов ЮНЕСКО, 2ГОУ ВПО Ивановская государственная медицинская академия РФ (ректор - акад. РАЕН Р.Р.Шиляев), 3ГОУ ВПО Российский государственный медицинский университет РФ (ректор - акад. РАМН Н.Н.Володин)
Введение
Специфические вегетативно-сосудистые пароксизмы - так называемые «приливы» - наиболее частый вазомоторный симптомокомплекс перименопаузы. Субъективно «прилив» можно описать как внезапную волну интенсивного тепла и даже жара по телу, сопровождающуюся профузным потоотделением, тахикардией и, у многих пациенток, подъемом артериального давления. Пароксизмы приливов могут длиться от нескольких минут до получаса. Ощущение жара, как правило, начинается с лица, груди, затылка, задней части шеи, распространяясь далее по верхней части туловища, и у некоторых женщин доходит до периферии. Помимо субъективного ощущения тепла или жара поверхность кожи, особенно на лице и верхней части груди, кратковременно становится более горячей на ощупь. Прилив может происходить от нескольких раз в месяц до нескольких раз в сутки. Приливы ухудшают настроение, препятствуют концентрации внимания и снижают работоспособность. Особо частые и интенсивные приливы в ночное время могут вызвать бессонницу.
Обзор более 60 публикаций по эпидемиологии приливов в перименопаузе показал повсеместную их распространенность. Распространенность приливов среди населения варьирует в значительных пределах: в Европе и США приливы отмечаются у 70% женщин в менопаузе, а в Юго-Восточной Азии - у 5-18%. Распространенность в различных популяциях может быть обусловлена целым рядом факторов, включая диету, образ жизни и обусловленное культурой психологическое отношение к концу репродуктивного периода жизни [1].
Патофизиология приливов до сих пор не уточнена. Возможно, что недостаток эстрогенов в менопаузе так или иначе влияет на центр терморегуляции в головном мозге [2]. В репродуктивном возрасте женщины подавляющее количество эстрогенов синтезируется в яичниках, желтом теле и плаценте. Во время менопаузы уровни так называемых позитивных эстрогенов (например, 17-β-эстрадиола) постоянно падают, поэтому возрастает значение эстрогенов, синтезируемых в печени и надпочечниках. При наступлении менопаузы на фоне хронической надпочечниковой недостаточности появляются различные симптомы дезадаптации, в том числе и приливы. Применение синтетических эстрогенов может поддерживать уровни эстрогенов и в ряде случаев снижать интенсивность симптоматики приливов. В самом деле, метаанализ 24 исследований (более 3300 пациенток) указал на значительное уменьшение числа приливов и их интенсивности при использовании заместительной гормональной терапии (ЗГТ): относительный шанс (ОШ) 0,13; 95% доверительный интервал (ДИ) 0,07-0,23 [3]. Поэтому приливы являются наиболее распространенной причиной приема женщинами ЗГТ.
Хотя ЗГТ синтетическими эстрогенами приводит к уменьшению остроты и частоты приливов у 80-90% женщин, принимающих ЗГТ, некоторые пациентки не решаются на столь радикальное гормональное вмешательство [4]. Всем женщинам, страдающим раком молочной железы [5], яичников [6], матки [7], венозной тромбоэмболией [8] или имеющим семейную историю рака груди [5], следует категорически избегать применения эстрогеновых препаратов. Кроме того, не следует забывать, что эстроген-терапия имеет негативные последствия, такие как головная боль, избыточная задержка жидкости, болезненность молочных желез, маточные кровотечения [9].
Повышенный риск осложнений и серьезные побочные эффекты синтетических эстрогенов делают разработку альтернативных видов терапии приливов насущно необходимой [10]. Многочисленные исследования показывают возрастающую тенденцию не применять ЗГТ при умеренной симптоматике приливов. Все чаще используют эффективную модификацию диеты и образа жизни наряду с альтернативной фармакотерапией [11]. Шире применяют альтернативные фармакологические препараты: избирательные ингибиторы серотонина или норадреналина [12], габа-пентин (аналог ГАМК, используемый для лечения различных неврологических расстройств), вералиприд (антидопаминергик) [13] и клонидин (β-адреноблокатор). Некоторые нутриенты (токоферол [14]; омега-3-жирные кислоты [15], соевые изофлавоны/генистеин [16, 17]) также уменьшают симптоматику приливов. Альтернативные методы фармакотерапии, например селективные ингибиторы серотонина, снижают частоту и тяжесть приливов на 19-60% [18]. Габапентин показал снижение частоты и тяжести приливов на 20-30% по сравнению с плацебо [19].
Лечение приливов препаратом Клималанин производства компании «Бушара Рекордати» на основе β-аланина является альтернативным ЗГТ. Требованием времени остается поиск негормональных, но высокоэффективных фармакологических средств для патогенетического лечения приливов. Представляем систематический анализ [1] патофизиологии приливов [2] и молекулярных ролей препарата Клималанин, имеющих значение для терапии приливов.
Систематический анализ патофизиологии приливов и механизмов воздействия β-аланина
Наиболее разработанными являются три подхода к патофизиологическому объяснению приливов: вегетативный, абстинентный и гормонально-нейротрансмиттерный. Эти подходы отображают многообразие социальных, психологических и эндокринных факторов, вносящих свой вклад в этиологию приливов. Фармакологическое действие Клималанина невозможно напрямую объяснить, используя вегетативный и абстинентный подходы. Однако действие Клималанина на купирование вегетативной и так называемой абстинентной симптоматики все же объяснимо с точки зрения гормонально-нейротрансмиттерного подхода.
Вегетативная дисфункция
Климактерический период связан не только с проявлениями эндокринных расстройств, но и с нарушениями функционирования вегетативной нервной системы. Известно, что психологические факторы, в том числе беспокойство, стресс, страх и т.д., влияют на возникновение приливов [1, 20] и приводят к так называемым сердечно-сосудистым неврозам по Г.Ф.Лангу [21]. Сердечно-сосудистые неврозы встречаются у женщин гораздо чаще, особенно в менопаузе. Приливы характеризуются дисфункцией вегетативной нервной системы. Поэтому исключение факторов, провоцирующих вегетативную дисфункцию, наряду со специфически направленной тренировкой нервной системы может быть использовано в терапии приливов. Изменение образа жизни помогает смягчению симптоматики проявления приливов. Пациенткам следует отказаться от курения, алкоголя, избегать кофеина, острой пищи, горячих напитков. Гиподинамия - важный стрессовый фактор, также приводящий к дезадаптации и формированию хронической надпочечниковой недостаточности. Хорошо известно, что гиподинамия не только фактор риска так называемых болезней цивилизации (ожирение, сердечно-сосудистые и цереброваскулярные заболевания и т.д.). Малоподвижный образ жизни значительно повышает риск развития и вазомоторных пароксизмов в климактерии. Регулярные физические упражнения и аутотренинг уменьшают интенсивность проявления симптоматики приливов, способствуют установлению более адекватной реакции организма на стресс [22].
Приливы как разновидность абстинентного синдрома
Приливы могут быть рассмотрены как проявление своеобразной «абстиненции» эстроген-чувствительных нейрональных систем, находившихся долгое время в условиях высокого содержания эстрогенов [23]. В самом деле, существует определенная схожесть в симптоматике менопаузы и симптоматике, связанной с абстинентным синдромом в случае болезней зависимости (курение, алкоголизм, наркомания). Например, симптомами абстиненции в случае каннабиноидов являются беспокойство, раздражительность, депрессия, приливы, ночной пот, инсомния и тремор [24, 25]. Многие из этих симптомов также соответствуют и вегето-сосудистой дистонии, и менопаузальной симптоматике.
Не менее чем у 20% пациенток с приливами использование ЗГТ не эффективно и не приводит к уменьшению симптоматики приливов. В контексте абстинентного подхода к объяснению этиологии приливов ЗГТ не будет эффективна, если в составе используемого эстрогенового препарата отсутствует именно та форма эстрогена, которая и вызвала химическую зависимость [25]. Фактом, подтверждающим применимость абстинентного подхода, является провокация приливов при использовании ЗГТ у пациенток с первичной аменореей. Несмотря на крайне низкое содержание эстрогенов у пациенток с различными формами первичной аменореи, у них никогда не бывает приливов. Они появляются только после назначения и отмены гормональной терапии. Удаление яичника у пременопаузальных женщин вызывает быстрое наступление приливов, в то время как женщины с первичной аменореей (гонадальный дисгенез), имеющие низкий уровень эндогенных эстрогенов, не испытывают приливов. Если, однако, женщина с гонадальным дисгенезом пройдет курс ЗГТ в течение нескольких месяцев, а затем прием эстрогенов будет резко прекращен, то приливы появятся [26].
Рассмотрение приливов как разновидности абстинентного синдрома имеет ряд важных последствий для терапии. Во-первых, регулярное и длительное использование пероральных контрацептивов в репродуктивном периоде повышает уровни эстрогеновых производных в крови значительно выше биологически приемлемых норм. В последующем, при наступлении менопаузы, у этой категории женщин может развиваться крайне тяжелая абстиненция, выраженная приливами с симптоматикой, типичной для абстинентного синдрома у больных наркоманией (жар, профузный пот, тремор, чувство полного бессилия после приступа). Во-вторых, инициацию и окончание курса ЗГТ не следует проводить резко. Возможно использование общих принципов лечения химической зависимости, таких как постепенное сокращение дозировки и увеличение интервалов между приемами препаратов. Это также касается и применения других пероральных эстрогеновых препаратов, таких как синтетические контрацептивы.
Гормонально- нейротрансмиттерные механизмы развития приливов
Дисфункция терморегуляторного центра, вызванная изменениями в уровнях эстрогенов в период менопаузы, считается основой патофизиологии приливов. Когда происходит возрастное падение уровней эстрогенов в организме женщины, концентрация эстрогенов, достигающих гипоталамуса, также снижается. Расположенный в гипоталамусе центр регулирования температуры [27] лишается привычной эстрогеновой стимуляции. В результате дестабилизируется функционирование терморегуляторного центра и возникают приливы как следствие избыточной активации теплоотдачи за счет вазодилатации и потоотделения. Гипоталамус - вершина фундаментальной гормональной оси гипоталамус-гипофиз-кора надпочечников. Гипоталамус обеспечивает функционирование сложнейшего интерфейса между нервной и эндокринной системами. Эта область мозга реагирует на нейрональные сигналы от других систем организма (длительность светового дня, обонятельные рецепторы, стресс, температура), а также на многочисленные гормональные и другие стимулы, переносимые с кровью (стероиды, кортикостероиды, ангиотензин, инсулин, концентрация глюкозы и др.). В медиальной преоптической области гипоталамуса содержится терморегуляторное ядро, активирующее механизмы для поддержания температуры тела в нормальном диапазоне, называемом терморегуляторной зоной [26]. У женщин с приливами может иметь место сужение границ терморегуляторной зоны по сравнению с женщинами, которые не имеют приливов [28]. Сужение терморегуляторной зоны может быть обусловлено избытком норадреналина и недостатком серотонина (рис. 1).
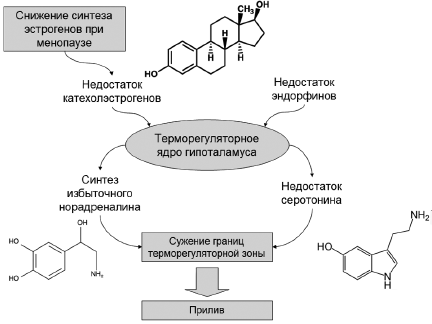
Рис. 1. Предполагаемые гормонально-нейрорегуляторные механизмы, задействованные в этиологии приливов.
Катехоламины и серотонин
Норадреналин считается основным нейротрансмиттером, ответственным за сужение терморегуляторной зоны гипоталамуса [27, 29]. Во время приливов резкий подъем уровней метаболитов норадреналина коррелирует с повышениями температуры тела и теплоотдачи [30]. Считается, что производство и секреция норадреналина в термо-регуляторном ядре гипоталамуса полностью ингибируются эндорфинами и катехол-эстрогенами [31]. Поэтому при недостатке последних будет происходить нарушение терморегуляции. Серотонин - еще один вероятный нейро-трансмиттер, участвующий в механизме приливов. Снижение уровней серотонина происходит параллельно со снижением уровней эстрогенов в менопаузе, а также у пациенток с аменореей и удаленными яичниками [32]. Было высказано предположение, что определенные типы рецепторов серотонина имеют отношение к нарушениям терморегуляции при приливах [33].
Патофизиология приливов и кальцитониноподобный пептид
Предположительные влияния катехоламинов и серотонина на ширину терморегуляторной зоны являются общеизвестными объяснениями влияния эстрогенов на этиологию приливов. В данном разделе мы предлагаем принципиально новую концепцию патогенеза приливов, основанную на систематическом анализе последних данных по молекулярной физиологии кальцитониноподобного пептида (англ. саlcitonin gene related peptide -CGRP).
Кальцитониноподобный пептид широко распространен в центральной и периферической нервной системе, обладает отчетливым вазодилатационным эффектом. Основным источником пептида является место ветвления тройничного нерва, который отвечает за иннервацию кожи и сосудов верхней, средней и нижней части лица. При приливах, как известно, наблюдается внезапное покраснение всего лица за счет расширения сосудов. Прием эстрогенов увеличивает уровни кальцитониноподобного пептида и метионин-энкефалина [34, 35] именно в преоптической зоне гипоталамуса [36, 37]. Преоптическая зона располагается вблизи двух анастомозов сосудистых сплетений гипоталамуса. Нормальной терморегуляции соответствует достаточный кровоток через эти сплетения; при нарушении терморегуляции кровоток снижен. Результаты исследования 13 женщин с приливами и 13 здоровых (контроль) показали, что суточная экскреция кальцитониноподобного пептида с мочой была значительно выше у женщин с приливами. Повышенная экскреция пептида с мочой позволяет предположить, что именно этот пептид может являться специфическим медиатором вазодилатации при приливах [38]. Это предположение напрямую подтверждается исследованием 8 женщин с вазомоторными синдромами, у которых проводили круглосуточное мониторирование биохимических параметров крови. Уровни кальцитониноподобного пептида и нейропептида Y повышаются во время прилива (на 73 и 34% соответственно) [39]. Прием эстрогенов может способствовать нормализации базальных уровней кальцитониноподобного пептида [40]. Особенно важно, что кальцитониноподобный пептид взаимосвязан с энергетическим метаболизмом. На энергетический метаболизм также влияет и Клималанин (см. далее). В исследовании 45 женщин в менопаузе уровни кальцитониноподобного пептида коррелировали с уровнями инсулина [41]. Низкие уровни пептида нарушают вазодилатационный эффект инсулина [42]. Пептид стимулирует базальную секрецию инсулина и глюкагона [43].
Механизмы воздействия препарата Клималанин
Рассматривая механизмы действия Клималанина, а точнее его действующего начала - β-аланина (C3H7NO2), следует начать с того, что это - β-аминокислота, синтезируемая в организме человека. В отличие от распространенного в белках α-аланина в β-аланине амидная группа присоединена не к атому Са, а к атому Сb (рис. 2). Подобная химическая структура β-аланина приводит к тому, что эта аминокислота не включается в состав белков. Тем не менее β-аланин весьма важен для метаболизма тканей и функционирования нервной системы.
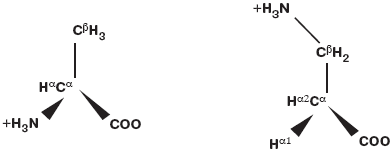
Рис. 2. α-Аланин (слева) и β-аланин (справа).
β-Аланин используется для уменьшения мышечной утомляемости при повышенных физических нагрузках. При типичной разовой дозировке от 400 до 800 мг (или от 0,4-0,8 г) β-аланин в спортивной медицине принимают с интервалами до 8 ч в течение нескольких недель [44]. После 10-недельного приема β-аланина содержание дипептида карнозина увеличивается в среднем на 80% [45].
В организме β-аланин образуется в результате деградации дигидроурацила (метаболизм нуклеотидов) и карнозина. β-Аланин необходим для синтеза карнозина и пантотеновой кислоты. β-Аланин также является агонистом глициновых рецепторов головного мозга. Принятый непосредственно в момент приливов β-аланин противодействует резкому высвобождению гистамина и брадикинина из тучных клеток, способствующих быстрому расширению сосудов кожи и покраснению. При этом β-аланин не блокирует Н1-рецепторы к гистамину и не обладает эффектами, присущими Н1-гистаминоблокаторам, в том числе и побочными (сухость во рту, сонливость и т.д.). Противодействие высвобождению гистаминолибераторов происходит по пути прямого стабилизирующего действия β-аланина на мембраны тучных клеток.
Эти механизмы воздействия β-аланина рассматриваются более подробно ниже.
Карнозин - дипептид, состоящий из β-аланина и гистидина. Карнозин максимально концентрируется в головном мозге и мышечной ткани, регулирует уровень внутриклеточного кальция и силу мышечного сокращения [46]. Карнозин обладает ярко выраженными антиоксидантными свойствами [47, 48], проявляет иммуномодулирующий эффект, поддерживая заживление ран [49]. Прием β-аланина увеличивает уровень карнозина в мышцах, уменьшает утомляемость и увеличивает работоспособность мышц [45]. Возможно, что достаточная обеспеченность карнозином нормализует работу мышечного слоя сосудов и тем самым способствует нормализации терморегуляции организма.
β-Аланин необходим для синтеза пантотеновой кислоты (витамин В5). Пантотеновая кислота в свою очередь необходима для синтеза ацилкоэнзима А - центрального кофермента биохимических путей, вовлеченных в метаболизм жиров, белков и углеводов. Ацилкоэнзим А необходим для ферментов цикла карбоновых кислот (цикл Кребса) и, таким образом, жизненно необходим для синтеза основного субстрата энергетического метаболизма - АТФ [50]. Так как В5 стимулирует процесс переработки жиров, прием препаратов пантотеновой кислоты обладает гиполипидемическим эффектом [51]. Симптомы дефицита витамина В5 схожи с симптоматикой дефицитов других витаминов группы В и включают астению, раздражительность, утомляемость и апатию, дерматиты, сухость кожи. Так как дефицит пантотеновой кислоты приводит к снижению синтеза ацетилхолина, неврологическая симптоматика гиповитаминоза В5 также включает парестезии и спазмы мышц. β-Аланин увеличивает уровни пантотеновой кислоты и способствует стабилизации энергетического метаболизма, что важно для нормализации терморегуляции.
Стабилизация энергетического метаболизма способствует уменьшению симптоматики приливов. Подобно тому, как интенсивный приток газа и кислорода стабилизирует пламя горелки, так и стабильный энергетический метаболизм позволяет избежать «всполохов», проявляющихся как приливы. В частности, поддержка энергетического метаболизма янтарной кислотой (основным метаболитом цикла трикарбоновых кислот) способствует ослаблению симптоматики приливов [52]. Частота приливов заметно уменьшается после еды и увеличивается в перерывах между приемом пищи, когда падает уровень глюкозы в крови [53]. Диетологи отмечают, что дробное питание (6-8 раз в день, небольшими порциями), особенно у пациенток с ожирением, часто способствует устранению приливов. Такая практика питания традиционна для стран Полинезии и Тайланда, где не только существенно реже встречаются ожирение и сахарный диабет, но и приливы у женщин в климактерии. Одним из эффектов такого рода дробного питания несомненно является стабилизация уровня глюкозы в крови. Уровни глюкозы коррелируют со встречаемостью приливов. У женщин с уровнем глюкозы более 130 мг/дл приливы отмечены значительно реже (p=0,04) по сравнению с пациентками, имевшими низкий уровень глюкозы (менее 110 мг/дл). Внутривенное введение раствора глюкозы приводило к значительному уменьшению числа приливов [54]. Важно также отметить, что одним из эффектов более опасных (по сравнению с глюкозой) эстрогеновых препаратов является именно уменьшение дефицита глюкозы в головном мозге [55]. Клималанин, влияя на уровни карнозина, синтез пантотеновой кислоты и уровни коэнзима А, стабилизирует энергетический метаболизм у женщины и стабилизирует отчасти и уровни глюкозы. С точки зрения влияния β-аланина на терапию приливов следует отметить прямое воздействие β-аланина на глициновые рецепторы центральной нервной системы (ЦНС). Хотя воздействие β-аланина на глициновые рецепторы несколько слабее, чем воздействие самого глицина, из всех известных агонистов глициновых рецепторов именно β-аланин занимает 2-е место [56]. То, что β-аланин является агонистом глициновых рецепторов, позволяет сделать обоснованное предположение о воздействии β-аланина на них. Поэтому далее рассматриваются эффекты глициновых рецепторов и самого глицина, а также проводится их сравнение с воздействием β-аланина. С одной стороны, глицин - тормозный нейротрансмиттер. Глициновые рецепторы (гены GLRA1, GLRA2, GLRA3 и GLRB) представляют собой лигандоуправляемые ионные каналы (рис. 3), имеющие ГАМК-подобную активность и расположенные, как правило, на постсинаптических мембранах. С другой стороны, глицин связывается со специфическими сайтами NMDA-рецепторов и, таким образом, способствует передаче сигнала от возбуждающих нейротрансмиттеров глутамата и аспартата. В отличие от глицина β-аланин связывается только с глициновыми рецепторами типа управляемых ионных каналов; данных о взаимодействии β-аланина с NMDA-рецепторами не имеется.
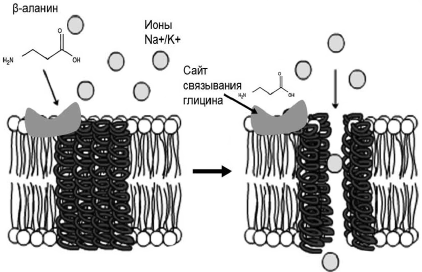
Рис. 3. Глициновые рецепторы действуют как лигандуправляемые ионные каналы. Связывание глицина (или β-аланина) рецептором увеличивает поток хлоридионов через плазматическую мембрану нейрона.
Большая плотность глициновых рецепторов обнаружена не только в структурах ствола, но и в коре больших полушарий, мозжечке, стриатуме, ядрах гипоталамуса. Основная масса глицина сосредоточена в спинном мозге, где аминокислота опосредует постсинаптическое торможение моторных нейронов. Поэтому глицин как препарат используется в неврологической практике для устранения повышенного мышечного тонуса и тремора. Генетически обусловленные дефекты глициновых рецепторов связаны с повышенным мышечным тонусом, акинезией и крайне обостренной реакцией на стимулы. С другой стороны, активация глициновых рецепторов оказывает седативное, транквилизирующее и антидепрессивное действие, усиливает действие противосудорожных препаратов, антидепрессантов, улучшает память и ассоциативные процессы. Особенно важно назначение глицина для смягчения абстинентного синдрома у алкоголиков, снятия симптоматики тремора. Представляет интерес тот факт, что глициновые рецепторы также взаимодействуют с генистеином, одним из активных компонентов соевых экстрактов. Как было отмечено ранее, соевые экстракты значительно способствуют ослаблению симптоматики приливов [16, 17].
Таким образом, следует отметить двойственную роль глицина в ЦНС -воздействие и на глициновые, и на глутаматные рецепторы. В то же время β-аланин воздействует, по всей видимости, только на глициновые рецепторы. Кроме того, глицин быстро метаболизируется, так как глицин как общераспространенная протеиногенная аминокислота включается в состав белков. Следовательно, для достижения заметных клинических эффектов необходимы высокие дозы глицина (граммы). β-Аланин, также являясь агонистом глициновых рецепторов, не включается в состав белков и метаболизируется в организме гораздо медленнее [57]. Как результат, значительно меньшие дозы β-аланина будут необходимы для достижения клинически наблюдаемых эффектов терапии. Следовательно, препарат Клималанин реализует свои клинические эффекты при приливах через участие в синтезе: 1) карнозина, 2) пантотеновой кислоты; 3) модуляции активности глициновых рецепторов. Предлагаемые механизмы терапевтического воздействия Клималанина при приливах отражены на рис. 4.
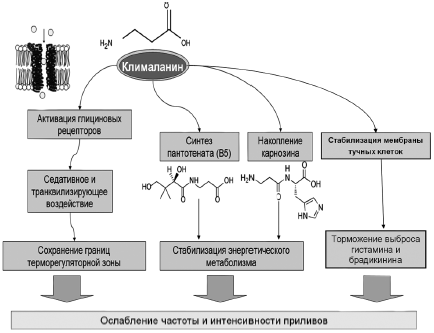
Рис. 4. Предлагаемые механизмы терапевтического воздействия препарата Клималанин при приливах.
"Препарат Клималанин выпускают в таблетках по 400 мг, применяют внутрь по 1-2 таблетки в сутки. Доза может быть увеличена до 3 таблеток в сутки (1200 мг β-аланина). Длительность лечения составляет 5-10 дней, до исчезновения «приливов». При возобновлении симптомов следует провести повторный курс лечения. Клималанин может реализовывать быстрый и медленный ответы на прием препарата у пациентов. Начало реализации быстрого ответа исчисляется от нескольких до 15-30 мин. Быстрый ответ Клималанина опосредован прямым взаимодействием β-аланина на глициновые рецепторы преоптической области гипоталамуса, что приведет к торможению избыточной активности терморегуляторного центра. За счет накопления карнозина и пантотеновой кислоты в клетках, постепенной стабилизации энергетического метаболизма при длительном приеме β-аланина не исключено развитие накопительного защитного эффекта, предотвращающего приливы. Этот аспект может быть очень перспективным в плане дальнейшего изучения действия препарата. Энергетическая стабильность способствует увеличению резервов адаптации организма женщины к пониженному уровню эстрогенов. Именно поэтому препарат Клималанин может быть рекомендован женщинам с приливами в период менопаузы в качестве монотерапии, а также в составе комплексной терапии с эстрогенами для уменьшения дозы последних. Особенно следует подчеркнуть, что применение Клималанина у пациенток с генетической предрасположенностью к приливам (нуклеотидные полиморфизмы генов CYP1B1, CYP19, ERbeta и Eralpha) является высокоэффективным средством из разряда так называемой персонализированной медицины [58].
Заключение
Приливы - одна из наиболее часто встречающихся жалоб при менопаузе. Вазомоторные пароксизмы - не что иное как проявления дезадаптационного синдрома на фоне снижения активности яичников в период менопаузы. Снижение уровня эстрогенов с наступлением менопаузы является нормой и отражает нормальный ход биологических часов. Поэтому борьба с вазомоторной симптоматикой при менопаузе посредством эстроген-терапии далеко не всегда оправданна. Более того, у 10-20% пациенток ЗГТ эстрогенами не имеет никакого эффекта, а у 20-30% пероральные эстрогены противопоказаны из-за резкого увеличения риска онкологических, сердечно-сосудистых и цереброваскулярных заболеваний. Недостатки эстрогеновой терапии (которые, к сожалению, зачастую замалчиваются) стимулируют поиск новых, альтернативных подходов к терапии приливов. Клималанин способствует стабилизации энергетического метаболизма через накопление карнозина, пантотеновой кислоты и оказывает седативное воздействие на вазомоторные пароксизмы посредством активации глициновых рецепторов. Представленный в настоящей работе новый взгляд на патофизиологию приливов и механизмы молекулярного воздействия β-аланина позволяет проанализировать фармакодинамические свойства препарата Клималанина в качестве достойной альтернативы терапии приливов. Особенно важно, что β-аланин способен проявлять быстрое действие на приливы, т.е. «гасить» возникновение приступов вегетососудистых пароксизмов и клинические проявления приливов в считанные минуты после применения.
Литература
1. Freeman EW, Sherif K. Prevalence of hot flushes and night sweats around the world: a systematic review. Climacteric 2007; 10 (3): 197-214.
2. Shanafelt TD, Barton DL, Adjei AA, Loprinzi CL Pathophysiology and treatment of hot flashes. Mayo Clin Proc 2002; 77 (11): 1207-18.
3. Maclennan AH, Broadbent JL, Lester S, Moore V. Oral oestrogen and combined oestrogen/progestogen therapy versus placebo for hot flushes. Cochrane Database Syst Rev 2004; 1052 (4): CD002978.
4. Rabin DS, Cipparrone N, Linn ES, Moen M. Why menopausal women do not want to take hormone replacement therapy. Menopause 1999; 6 (1): 61-7.
5. RossouwJE, Anderson GL, Prentice RL, LaCroix AZ, WHI Investigators. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: Women's Health Initiative randomized controlled trial. JAMA 2002; 288 (3): 321-33
6. Lacey JV, Mink PJ, Lubin JH et al. Menopausal hormone replacement therapy and risk of ovarian cancer. JAMA 2002; 288 (3): 334-41.
7. Coughlin SS, Giustozzi A, Smith SJ, Lee NC. A metaanalysis of estrogen replacement therapy and risk of epithelial ovarian cancer. J Clin Epidemiol 2000; 53 (4): 367-75.
8. Tanis BC, van den Bosch MA, Kemmeren JM et al. Oral contraceptives and the risk of myocardial infarction. N Engl J Med 2001; 345 (25): 1787-93
9. Reynolds RF, Obermeyer CM, Walker AM et al. Side effects and sociobehavioral factors associated with the discontinuation of hormone therapy in a Massachusetts health maintenance organization. Menopause 2001; 8 (3): 189-99.
10. Nelson HD, Vesco KK, Haney E et al. Nonhormonal therapies for menopausal hot flashes: systematic review and meta-analysis. JAMA 2006; 295 (17): 2057-71.
11. Nachtigall LE, Baber RJ, Barentsen R et al. Complementary and hormonal therapy for vasomotor symptom relief: a conservative clinical approach. J Obstet Gyn Can 2006; 28 (4): 279-89.
12. Shen W, Stearns V. Treatment strategies for hot flushes. Expert Opin Pharmacother 2009; 10 (7): 1133-44.
13. Melis GB, Gambacciani M, Cagnacci A et al. Effects of the dopamine antagonist veralipride on hot flushes and luteinizing hormone secretion in postmenopausal women. Obstet Gyn 1988; 72 (5): 688-92.
14. Barton DL, Loprinzi CL, Quella SK et al. Prospective evaluation of vitamin Efor hot flashes in breast cancer survivors. J Clin Oncol 1998; 16 (2): 495-500.
15. Bourre JM. Dietary omega-3 fatty acids for women. Biomed Pharmacother 2007; 61 (2-3): 105-12.
16. Kurzer MS. Soy consumption for reduction of menopausal symptoms. Inflammopharmacology 2008; 16 (5): 227-9.
17. Williamson-Hughes PS, Flickinger BD, Messina MJ, Empie MW. Isoflavone supplements containing predominantly genistein reduce hotflash symptoms: a critical review of published studies. Menopause 2006; 13 (5): 831-9.
18. Carroll D.G. Nonhormonal therapies for hot flashes in menopause. Am Fam Physician 2006; 73 (3): 457-64.
19. Toulis KA, Tzellos T, Kouvelas D, Goulis DG. Gabapentin for the treatment of hotflashes in women with natural or tamoxifen-induced menopause: atematic review and meta-analysis. Clin Ther 2009; 31 (2): 221-35.
20. Hunter M, Rendall M. Bio-psycho-socio-cultural perspectives on menopause. Best Pract Res Clin Obstet Gyn 2007; 21 (22): 261-74.
21. Ланг Г.Ф. Учебник внутренних болезней. Т. I, ч. 1. Л.: Медгиз, 1938.
22. Chattha R, Nagarathna R, Padmalatha V, Nagendra HR. Effect of yoga on cognitive functions in climacteric syndrome: a randomised control study. B]OG 2008; 115 (8):991-1000.
23. Сметник В.П. Приливы: загадка климактерия. Климактерий. 2009; 1.
24. Arendt M, Rosenberg R, Foldager L et al. Withdrawal symptoms do not predict relapse among subjects treated for cannabis dependence. Am J Addict 2007; 16 (6): 461-7.
25. Crawford SJ. Hot flushes and cold turkey. Br Med J 1977; 1 (6076): 1599.
26. Casper RF, Yen SS. Neuroendocrinology of menopausal flushes: an hypothesis offlush mechanism. Clin Endocrinol (Oxf) 1985; 22 (3): 293-312.
27.Andrikoula M, Prelevic G. Menopausal hot flushes revisited. Climacteric 2009; 12 (1): 3-15.
28. Freedman RR, Krell W. Reduced thermoregulatory null zone in postmenopausal women with hot flashes. Am J Obstet Gyn 1999; 181 (1): 66-70.
29. RosenbergJ, Larsen SH. Hypothesis: pathogenesis of postmenopausal hot flush. Med Hypotheses 1991; 35 (4): 349-50.
30. Freedman RR, Norton D, Woodward S, Cornelissen G. Core body temperature and circadian rhythm of hot flashes in menopausal women. Clin Endocrinol Metab 1995; 80 (8): 2354-8.
31. Schurz B, Wimmer-Greinecker G, Metka M et al. Beta-endorphin levels during the climacteric period. Maturitas 1988; 10 (1): 45-50.
32. Gonzales GF, Carrillo C. Blood serotonin levels in postmenopausal women: effects of age and serum oestradiol levels. Maturitas 1993; 17 (1): 23-9.
33. Berendsen HH. The role of serotonin in hotflushes. Maturitas 2000; 36 (3): 155-64.
34. Yuri K., Kawata M. Estrogen receptor-immunoreactive neuron contain calcitonin gene-related peptide, methionine-enkephalin or tyrosine hydroxylase in the female rat preoptic area. Neurosci Res 1994; 21 (2): 135-41.
35. Yuri K, Kawata M. Estrogen affects calcitonin gene-related peptide- and methionine-enkephalin-immunoreactive neuron in thefemale rat preoptic area. Neurosci Lett 1994; 169 (1-2): 5-8.
36. Yuri K, Kawata M. Time-course analysis of changes in calcitonin gene-related peptide-and methionine-enkephalin-immunoreactivity in thefemale rat preoptic area after estrogen treatment. Neuroscience 1993; 55 (4): 1067-74.
37. Yuri K, Kawata M. Semi-quantitative analysis of the effects of estrogen on CGRP-immunoreactivity in the periventricular preoptic nucleus and the medial preoptic area of female rats. Brain Res 1992; 578 (1-2): 282-8.
38. Wyon Y, Frisk J, Lundeberg T et al. Postmenopausal women with vasomotor symptoms have increased urinary excretion of calcitonin gene-related peptide. Maturitas 1998; 30 (3): 289-94.
39. Wyon YA, Spetz AC, Theodorsson GE, Hammar ML. Concentration of calcitonin gene-related peptide and neuropeptide Y in plasma increase during fluhes in postmenopausal women. Menopause 2000; 7 (1): 25-30.
40. Valentini A, Petraglia F, De Vita D et al. Changes of plasma calcitonin gene-related peptide levels in postmenopausal women. Am] Obstet Gyn 1996; 175 (3 Pt 1): 638-42.
41. Gupta P, Harte A, Sturdee DW et al. Effects of menopausal status on circulating calcitonin gene-related peptide and adipokines: implications for insulin resistance and cardiovascular risks. Climacteric 2008; 11 (5): 364-72.
42. Salem N, Dunbar JC. The insulin-mediated vascular and blood pressure responses are suppressed in CGRP-deficient normal and diabetic rats. Diabetes Metab Res Rev 2002; 18 (3): 238-44.
43. Pettersson M, Ahren B. Insulin and glucagon secretion in rats: effects of calcitonin gene-related peptide. Regul Pept 1988; 23 (1): 37-50.
44. Derave W, Ozdemir MS, Harris RC, PottierA. beta-Alanine supplementation augments muscle carnosine content and attenuates fatigue during repeated isoki-netic contraction bouts in trained sprinters. J Appl Physiol 2007; 103 (5): 1736-43.
45. Hill CA, Harris RC, Kim HJ et al. Influence of beta-alanine supplementation on skeletal muscle carnosine concentrations and high intensity cycling capacity. Amino Acids 2007; 32 (2): 225-33.
46. Zaloga GP, Roberts PR, Nelson TE. Carnosine: a novel peptide regulator of intracellular calcium and contractility in cardiac muscle. New Horiz 1996; 4 (1): 26-35.
47. Klebanov GI, Teselkin YuO, Babenkova IV et al. Effect of carnosine and its components on free-radical reactions. Membr Cell Biol 1998; 12 (1): 89-99.
48. Babizhayev MA, Seguin MC, Gueyne J et al. L-carno-sine act as natural antioxidants. Biochem J 1994; 304 (Pt 2) (8): 509-16.
49. Nagai K, Suda T. Realization of spontaneous healing function by carnosine. Methods Find Exp Clin Pharmacol 1988; 10 (8):497-507.
50. Voet D, VoetJG, Pratt CW. Fundamentals of Biochemistry: Life at the Molecular Level, 2nd ed. Hoboken, 2006 NJ:John Wiley & Sons, Inc.
51. Naruta E, Buko V. Hypolipidemic effect of pantothenic acid derivatives in mice with hypothalamic obesity induced by aurothioglucose. Exp Toxicol Pathol 2001; 53 (5): 393-8.
52. Peskov AB, Maevskii EI, Uchitel' ML et al. Succinate-based preparation alleviates manifestations of the climacteric syndrome in women. Bull Exp Biol Med; 2005 Sep; 140(3):312-4.
53. Dormire S, Howharn C. The effect of dietary intake on hotflashes in menopausal women. J Obstet Gynecol Neonatal Nurs 2007;36 (3): 255-62.
54. Dormire SL, Reame NK. Menopausal hot flash frequency changes in response to experimental manipulation of blood glucose. Nurs Res 2003; 52 (5): 338-43.
55. Ratka A. Menopausal hot flashes and development of cognitive impairment. Ann N Y Acad Sci 2005; 1052 (3): 11-26.
56. HenleyJM. Encyclopedia of Life Sciences Amino Acid Neurotransmitters. 2001]ohn Wiley & Sons, Ltd.
57. Harris RC, Tallon MJ, Dunnett M et al. The absorption of orally supplied beta-alanine and its effect on muscle carnosine synthesis in human vastus lateralis. Ammo Acids 2006; 30 (3): 279-89.
58. Malacara JM, Perez-Luque EL, Martinez-Garza S, Sanchez-Marin FJ. The relationship of estrogen receptor-alpha polymorphism with symptoms and other characteristics in post-menopausal women. Maturitas 2004; 49 (2): 163-9.
