Анемия и метаболические расстройства у онкологических больных
СтатьиОпубликовано в:
«ПРАКТИЧЕСКАЯ ОНКОЛОГИЯ» »» Т. 10, № 3 – 2009
А.В. Новик
ФГУ НИИ онкологии им. Н.Н.Петрова, г.Санкт-Петербург
К синдромам эндогенной интоксикации у онкологических больных относятся анемия, синдром анорексии - кахексии, синдром распада опухоли, гиперурикемия, гемолитико-уремический синдром, гиперкальциемия, гипонатриемия, лактацидоз, синдром повышенной вязкости крови и паранеопластические синдромы
В онкологической практике встречается несколько синдромов, патогенез которых тесно связан с развитием эндогенной интоксикации. К ним относятся анемия, синдром анорексии - кахексии, синдром распада опухоли, гиперурикемия, гемолитико-уремический синдром, гиперкальциемия, гипонатриемия, лактацидоз, синдром повышенной вязкости крови и паранеопластические синдромы. Все указанные состояния являются следствием одного заболевания - злокачественного опухолевого процесса. Соответственно, каждое из них может быть успешно контролируемо при использовании эффективного противоопухолевого лечения. Для указанных синдромов это лечение будет этиотропным. Однако, как известно, выраженный эффект терапии не только является пока достаточно редким явлением, но и сам по себе способен усугубить течение некоторых из них, таких как синдром распада опухоли. Поэтому патогенетическая терапия данных заболеваний является абсолютно необходимой.
В предыдущих лекциях в рамках Российской школы онкологов уже достаточно подробно разбирались некоторые из указанных синдромов [7, 9, 10]. В этой лекции мы остановимся на синдроме анемии и гипонатриемии.
Синдром анемии
Под анемией понимают снижение уровня гемоглобина ниже 120 г/л [13]. Такое состояние встречается у половины онкологических больных, особенно при распространенном процессе [14]. Злокачественные опухоли легкого и гинекологические раки чаще всего сопровождаются анемией (71 и 63% соответственно).
На основание преобладающего механизма развития синдрома возможно выделение следующих групп анемий [12]: железодефицитные, сидероахрестические (железонасыщенные), железоперераспределительные, В12-дефицитные и фолиеводефицитные, гемолитические, анемии при костно-мозговой недостаточности, анемии при уменьшении объема циркулирующей крови и анемии со смешанным механизмом развития.
Потенциальные механизмы развития анемии у онкологического больного [6] включают в себя значительное увеличение потерь эритроцитов вследствие острой или хронической кровопотери. Абсорбция на мембране различных веществ (продукты метаболизма, цитостатики, опухолевые антигены), играющих в данном случае роль токсинов, приводит к снижению устойчивости мембраны эритроцитов и более быстрой утилизации. Это, в свою очередь, значительно увеличивает потребность в их образовании. Процесс эритропоэза также подвергается значительным изменениям у онкологического больного. Это прежде всего касается синтеза эритропоэтина и снижению реакции на него гемопоэтических клеток, а также нарушения высвобождения железа из ретикулоэндотелиальной системы и перераспределение его в иммунокомпетентные клетки. По данным В.Н. Блиндарь с соавторами [1], железодефицитная анемия наблюдалась у 48%, а дефицит продукции эритропоэтинов - у 71% онкологических больных. Таким нарушениям во многом способствуют провоспалительные цитокины, такие как фактор некроза опухолей, интерфероны и интерлейкин-1. Исследования показали, что, например, фактор некроза опухолей способен не только сокращать срок жизни эритроцитов, но и опосредованно влиять на продукцию эритропоэтинов и метаболизм железа и витаминов. Немаловажным аспектом воздействия злокачественного процесса на костный мозг является его метастатическое поражение или опухоль-индуцированный фиброз и некроз. Это ведет к вытеснению костномозговых предшественников и к развитию апластической анемии. Нарушение поступления питательных веществ, обусловленные синдромом анорексии - кахексии, также вносят вклад в развитие описываемого патологического процесса. Кроме этого, важную роль играют нежелательные явления, связанные с проведением химиотерапии, которые способствуют повреждению эритроидных предшественников и снижению их реакции на эритропоэтины. Использование цитостатических агентов в терапии злокачественных опухолей может не только приводить к угнетению гемопоэза, но и вызывать гемолитические анемии (например, аналоги нуклеотидов) [22].
Последствия развития анемии для организма заключаются в развитии гемической гипоксии органов и тканей. Описание механизмов её развития и цепи патологических процессов, с ними связанных, выходит за рамки данного обзора. Хотелось бы, однако, кратко отметить роль гипоксии в развитии опухоли. Снижение содержания кислорода менее 1% стимулирует выработку факторов транскирипции, таких как HIF1-α, NFk-b и АР-1[29]. Индуцируемые ими изменения активности генома приводят к адаптации клеток к этому состоянию, стимулируют ангиогенез, блокируют апоптоз и тем самым способствуют стимуляции опухолевого роста, инвазии и метастазированию. Ещё более низкие концентрации кислорода способны оказывать мутагенное действие, усиливать нестабильность генома и, соответственно, вариабельность опухолевых клеток, что является основой для дальнейшей клональной селекции наиболее устойчивых линий. Низкое содержание кислорода в клетке является фактором химио- и радиорезистентности опухоли. Гипоксическое состояние способствует развитию агрессивного фенотипа и является универсальным фактором неблагоприятного прогноза. Таким образом, анемия является независимым прогностическим фактором для целого ряда опухолей, что было подтверждено соответствующими исследованиями [17]. В связи с этим, лечение анемии должно приводить к повышению оксигенации опухоли и таким образом повышать эффект противоопухолевой терапии.
Клиническая картина
Клиническая картина анемии складывается из нескольких синдромов. У всех больных отмечаются проявления гипоксии: нарастающая слабость, быстрая утомляемость, шум в ушах, потемнение перед глазами при изменении положения тела, головные боли, головокружение, обморочные состояния и сердцебиение при незначительных физических нагрузках, психические явления, бледность кожи и слизистых оболочек, одутловатость лица, трофические нарушения, выпадение волос, усиленное разрушение зубов, сухость кожи, сглаженность сосочков языка; в отдельных случаях — затруднения при глотании (симптом Россолимо — Бехтерева) сухой и твердой пищи; малиновая окраска языка, атрофические изменения слизистой оболочки глотки и пищевода, спастическое сужение верхней части пищевода, ломкость, образование продольной или поперечной исчерченности ногтей, койлонихия. При дефиците железа к указанной выше картине присоединяются симптомы тканевого дефицита данного элемента: извращение вкуса — pica clorotica, свидетельствующее о нарушении периферической вкусовой чувствительности. Нередко больные жалуются на мышечную слабость, отмечают ложные позывы на мочеиспускание, неспособность удержать мочу (у детей бывает ночное недержание). Гипоксия и тканевый дефицит железа приводит к расстройствам сердечно-сосудистой и нервной системы, желудочно-кишечного тракта, печени. Для дефицита витамина B12 характерны желтоватый цвет кожных покровов, диффузная пятнистая коричневая пигментация, анорексия, при выраженном дефиците возможно повышение температуры тела. У половины больных отмечаются явления глоссита - «лакированный язык» - язык лишается сосочков, становится гладким, блестящим. Иногда поражаются слизистые оболочки щек. Возможно развитие диареи. Характерно развитие фуникулярного миелоза -поражения проводящих путей задних канатиков спинного мозга. Возможно также развитие церебральных нарушений, симптомов полинейропатии.
Диагностика анемий
Диагностический алгоритм для гипохромных анемий представлен на рис.1 (по Л.И. Дворецкому, с изменениями) [4].
При выявлении гиперхромных анемий следует прежде всего думать о В12-фолиеводефицитной анемии. Их диагностическими критериями являются высокий цветовой показатель, макроцитоз, мегалоцитоз, эритроциты с остатками ядер (тельца Жолли, кольца Кэбота), ретикулоцитопения, гиперсегментация нейтрофилов, лейкопения (нейтропения), тромбоцитопения, повышение содержания железа в сыворотке, мегалобластическое кроветворение в костном мозге, пониженный уровень данных витаминов в крови. Возможны неврологические нарушения и психические расстройства.
Нормохромные анемии - наиболее частые у онкологических больных - представлены двумя основными типами: гемолитической анемией и анемией при костномозговой недостаточности. Первая характеризуется прежде всего признаками гемолиза: повышением содержания непрямого билирубина в сыворотке с наличием желтухи или без таковой, повышением содержания железа в сыворотке, наличием в моче гемосидерина и свободного гемоглобина в плазме (при некоторых формах с внутрисосудистым гемолизом). Также отмечаются ретикулоцитоз, наличие в крови ядросодержащих эритроидных клеток (эритрокариоцитов), увеличение числа эритрокариоцитов в костном мозге (свыше 23%), увеличение селезенки (при некоторых формах). Анемии при костномозговой недостаточности характеризуются нормохромией (реже гиперхромией), ретикулоцитопенией, депрессией других ростков кроветворения (лейкоцитарного, мегакариоцитарного) с соответствующими клиническими проявлениями (инфекции, кровотечения, поражения слизистых) и характерными изменениями состояния костного мозга. Последние могут быть представлены дисплазией или умеренным увеличением бластов (миелодиспластический синдром), фиброзом, замещением жировой тканью, элементами опухоли при метастатическом поражении или при поражении лейкозом.
| Рис. 1. Алгоритм диагностики гипохромных анемий. ЦП – цветовой показатель; ЖС – железо сыворотки; ЖСС – железосвязывающая способность сыворотки, YUY – нижняя граница нормы, ВГН – верхняя граница нормы, МСН – среднее содержание гемоглобина в эритроците, МСНС – средняя концентрация гемоглобина в эритроците. |
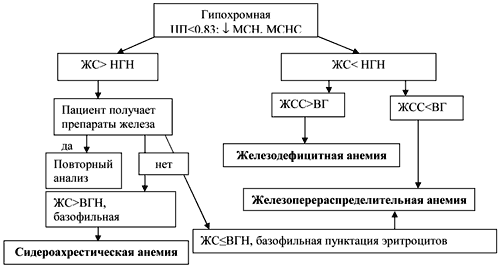 |
Лечение анемий
Основой лечения любой анемии, связанной с опухолевым процессом, является лечение самой опухоли. При значительном снижении гемоглобина (менее 80 г/л) пациентам показано проведение гемотрансфузий. Последние позволяют быстро поднять уровень гемоглобина, однако обладают кратковременным эффектом. Переливание эритроцитарной массы сопровождается риском развития целого ряда нежелательных явлений [11]. Выделяют следующие посттрансфузионные реакции и осложнения: острые иммунные (гемолитические, фебрильные негемолитические, аллергические и гемотрансфузионное острое поражение легких); острые неиммунные (бактериальные и вирусные инфекции, циркуляторная перегрузка, физический и/или химический гемолиз, эмболия, цитратная интоксикация, гиперкальциемия); отсроченные иммунные (гемолитические, болезнь «трансплантат против хозяина», посттрансфузионная пурпура) и неимунные (гемосидероз). Уже сам список возможных нежелательных явлений свидетельствует о необходимости ограничения гемотрансфузий и использования их лишь в крайней необходимости. Кроме того, исследования E.C.Vamvakas и H.F. Taswell, в которых изучалось влияние переливания крови на продолжительность жизни больных, выявили увеличение риска смерти в течение 10 лет на 4,1% после переливания 1 дозы эритроцитарной массы [28]. Альтернативные средства лечения анемий зависят от их патогенетического типа. Для анемий, связанных с дефицитом витаминов или железа патогенетической терапией является восполнение такого дефицита. Для В12-дефицитной анемии достаточной терапией в нетяжелых случаях является введение препаратов этого витамина в дозе 100-200 мкг ежедневно в течение 1 недели с последующим переходом на введение через день до достижения полной гематологической ремиссии (нормализация кроветворения и купирование анемии). В тяжелых случаях (снижение эритроцитов менее 1*1012/л, неврологическая симптоматика) используется от 300 до 1000 мкг цианкобаламина в течение 2 недель с дальнейшим переходом на поддерживающий режим до достижения стойкой ремиссии. При дефиците фолиевой кислоты последнюю назначают по 3 мг ежедневно на 1 мес.
При развитии железодефицитной анемии необходимо применение препаратов железа. Коррекция диеты с учетом повышенного содержания в продуктах железа необходима, но недостаточна для лечения развившейся анемии. Для коррекции данного синдрома достаточно поступления в организм от 30 до 100 мг двухвалентного железа в сутки [2]. На сегодняшний день существует масса препаратов железа. По их составу выделяют препараты солей железа (сульфат, глюконатом, хлорид, фумарат, глицин сульфат), которые содержат двухвалентное железо, и комплексные соединения (полимальтозные и белково-сукцинатные комплексы), содержащие трехвалентное железо. Некоторые из этих препаратов выпускаются в сочетании с витаминами (С, В12, фолиевой кислотой), что усиливает всасывание из ЖКТ. В целом, при пероральном приеме, с учетом усиления всасывания железа в кишечнике при его дефиците, лишь 23-30% препарата попадает в системный кровоток. На всасывание солей железа влияют пищевые продукты и некоторые препараты. Так, фитины (рис, соя), фосфаты (рыба, морепродукты), танин (чай, кофе) способны значительно уменьшить биодоступность указанных препаратов и соответственно эффективность лечения. Применение тетрациклина, альмагеля, солей магния одновременно с препаратами железа способно уменьшить всасывание последнего. Все это необходимо учитывать при назначении лечения и разделять прием солей железа с продуктами, способными повлиять на всасывание. Препараты комплексных соединений железа таких недостатков лишены. Суточная доза препаратов железа при приеме через рот должна составлять 100-300 мг. Парентеральное введение (возможно только для комплексных препаратов) не обладает преимуществами по эффективности или скорости достижения эффекта по сравнению с энтеральным приемом [2]. В связи с этим показания к применению парентеральных препаратов ограничиваются ситуациями нарушения всасывания в кишечнике или невозможностью приема пищи и непереносимостью различных энтеральных форм [2]. Длительность лечения препаратами железа должна составлять не менее 1-1,3 мес. для восстановления тканевых запасов этого микроэлемента. Из побочных эффектов терапии стоит отметить тошноту, анорексию, металлический привкус во рту, запоры, реже - поносы [4].
При развитии сидероахрестической или железоперераспределительной анемии применение препаратов железа противопоказано. Кроме лечения основного патологического процесса, в случаях перегрузки железом рекомендуется назначение дефероксамина - препарата, образующего стабильный комплекс с трёхвалентным железом.
Для гемолитических анемий, с учетом иммунного механизма их развития, показано применение глюкокортикоидов. При неэффективности такого подхода используют иммунодепрессанты или спленэктомию. Для лечения данного состояния также используют антигормоны (даназол), моноклональные антитела к лимфоцитам (ритуксимаб, алемптузумаб), иммуноглобулины [22]. Описано также применение методов эфферентной терапии [3].
Более подробно хотелось бы остановиться на лечении анемий, связанных с костномозговой недостаточностью. Для лечения этого типа анемий были созданы рекомбинантные эритропоэтины - аналоги человеческого цитокина, обеспечивающего созревание клеток эритроидного ряда от этапа бурст-образующей единицы до эритроцита [6]. Применение названных препаратов, как показали многочисленные исследования, приводит к достоверному повышению качества жизни больных [14] и уменьшает вероятность гемотрансфузий (относительный риск 0,64, 93%ДИ 0,36-0,73) [27]. Вместе с тем, за последнее десятилетие применение эритропоэтинов сопровождается значительными побочными эффектами. Большой метаанализ, проведенный группой канадских ученых и опубликованный в 2009 г. [27] обобщил результаты 32 исследований, включавших в себя 12 006 больных. Наряду с очевидным эффектом терапии эритропоэтинами на качество жизни и частоту гемотрансфузий, о чем говорилось выше, были подтверждены риски нежелательных явлений и смерти больных от прогрессирования опухолей. Относительный риск развития тромбоэмболий во время лечения эритропоэтинами (как альфа, так и бета) по сравнению с контролем (без лечения или гемотрансфузии), составил в данном исследовании 1,69 (93% ДИ 1,27-2,24). Увеличен был также и общий риск серьезных нежелательных явлений - 1,16 (93% ДИ 1,08-1,23). Еще в 2003 году M.Henke с соавторами впервые продемонстрировали снижение выживаемости больных плоскоклеточными раком головы и шеи при использовании эритропоэтинов в сочетании с лучевой терапией [21]. Различные исследования, впоследствии проводимые как по показаниям (анемия у больных, получающих химиотерапию), так и вне их, показали сходные результаты. По данным уже упоминавшегося выше метаанализа, применение эритропоэтинов повышает риск смерти до 1,13 (93% ДИ 1,03-1,29) [27]. Исследования, проводимые вне показаний, характеризовались ещё более выраженным повышением риска смерти [20]. Выдвигаются как минимум 2 причины, объясняющие такой, казалось бы, парадоксальный эффект. Теоретически можно предположить, что, поскольку анемия вызывает гипоксию, а последняя в свою очередь способствует повышенной химио- и радиорезистентности опухолей, то повышение уровня гемоглобина должно увеличивать оксигенацию и, соответственно, чувствительность опухоли к лечению. На практике, однако, оказалось, что при повышении уровня гемоглобина более 120 г/л оксигенация опухолевой ткани падает [29]. Этим можно отчасти объяснить причину значительно большего риска прогрессирования заболевания и смерти в исследованиях, проведенных вне показаний. Ведь в этих исследованиях целевой уровень гемоглобина составлял 140 г/л или производились попытки профилактического их назначения. С другой стороны, в ряде исследований была продемонстрирована экспрессия рецепторов эритропоэтинов на опухолевых клетках. В исследовании M. Hank с соавторами, о котором уже говорилось выше, выживаемость больных, чьи опухоли экспрессировали рецепторы к эритропоэтину, была значительно ниже при использовании эритропоэтинов, тогда как применение этих препаратов при отсутствии указанных рецепторов на опухолевых клетках приводило к статистически значимому повышению выживаемости больных (рис.2).
Вместе с тем, проведенные доклинические исследования и изучение роли рецепторов эритропоэтинов на цитоплазматический характер. При культивировании 23 клеточных линий, экспрессирующих на поверхности рецепторы эритропоэтина, стимуляции опухолевого роста выявлено не было. В 23 исследованиях на животных было выявлено 3 вида воздействия эритропоэтинов: 1) торможение опухолевого роста, 2) усиление воздействия стандартной терапии и 3) отсутствие влияния на стандартную терапию. Стимуляции опухолевого роста не было выявлено ни в одном исследовании [19]. Интересно отметить, что при окраске тканей мышей, нокаутных по рецепторам эритропоэтина коммерчески доступными антителами было выявлено позитивное окрашивание. Изучение этого феномена выявило перекрестную реакцию у этих антител с белком теплового шока 70.
| Рис. 2. Выживаемость больных, получавших терапию рекомбинантным эритропоэтином, в зависимости от экспрессии рецепторов эритропоэтина [19]. |
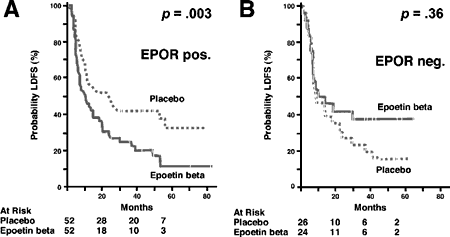 |
Таким образом, роль рецепторов эритропоэтинов на негемопоэтических клетках, в том числе на опухолевых, требует дальнейшего выяснения. Тем не менее, клинические данные свидетельствуют о наличии отдельных групп больных, использование эритропоэтинов у которых может существенно ухудшить результаты лечения. В связи с этим, согласно рекомендациям ESMO [26], эритропоэтины могут применяться только у больных с анемией, являющейся осложнением химиотерапии. Начало терапии возможно при гемоглобине ниже 100 г/л (анемия >1 ст.) или при анемии 1 ст., сопровождающейся выраженной клинической симптоматикой. Алгоритм назначения препаратов в соответствии с данными рекомендациями представлен в табл. 1. Необходимо отметить, что у пациентов с потенциально излечимыми опухолями употребления эритропоэтинов следует избегать.
Гипонатриемия
Под гипонатриемией понимают снижение уровня натрия в крови ниже 133 ммоль/л. Это состояние встречается у 3,7-3% онкологических больных и иногда предшествует выявлению опухолевого процесса [23]. Снижение уровня натрия в крови ниже 130 ммоль/л является неотложным состоянием, а уровень ниже 123 ммоль/л опасен для жизни. В нескольких исследованиях этот синдром связывался с повышенной летальностью, при этом частота таких исходов достигала 70% [16]. В связи с этим выявление данного состояния требует выявления его причины и незамедлительного начала коррекции.
Классификация гипонатриемий и основные причины их развития приведены в табл. 2 [13, 23]. Наиболее частой причиной развития синдрома неадекватной продукции антидиуретичекгого гормона (СНПАДГ) - 1а группы нарушений - являются опухоли гипофиза, гипопитуитаризм, хирургическое лечение краниофарингиом, хирургические вмешательства с трансфеноидальным доступом. Из лекарственных средств поражение супраоптических и паравентрикулярных ядер с последующим развитием гипонатриемии описано для циклофосфана и винкоалкалоидов.
Таблица 1. Рекомендации по проведению терапии эритропоэтинами Европейского общества клинической онкологии
| Препарат | Эпоэтин α | Эпоэтин ß | Дарбэпоэтин α |
| Начало терапии | 130 МЕ/кг TIW или 430 МЕ/кг QW |
30 000 МЕ QW | 2,23 мкг/кг QW или 300 мкг (6,73 мкг/кг) Q3W |
| Повышение дозы (увеличение гемоглобина менее 10 г/л за 4 недели) |
300 МЕ/кг TIW | 60000 МЕ QW | Не рекомендуется |
| Снижение дозы* | 23-30% | 23-30% | 23-30% |
| Приостановка терапии | При уровне гемоглобина >130 г/л до достижения уровня 120 г/л | ||
Таблица 2. Классификация гипонатриемий и основные причины их развития
| Группа | Механизм развития | Причины |
| 1 | Нормальный баланс натрия | |
| 1а | Избыток АДГ | Избыток АДГ Паранеопластические синдромы Цитостатики (винка алкалоиды, циклофосфамид, ифосфамид и др. алкилирующие агенты) Недостаточность глюкокортикоидов Гипотиреоз |
| 1б | Избыток потребления воды (псевдогипонатриемия) |
Опухолевые белки Иммуноглобулины Парапротеины Избыточное введение гипотонических растворов |
| 2 | Нарушение баланса натрия | |
| 2а | Реабсорбция натрия в почках | Снижение ОЦК Нарушения со стороны ЖКТ: Сниженное потребление жидкости Тошнота, рвота Перераспределение жидкости в третьи пространств (асцит, плеврит) Уменьшение эффективного ОЦК Сердечная недостаточность Цирроз печени |
| 2б | Выведение натрия почками | Недостаточность надпочечников Избыток предсердного или мозгового натрийуретического пептида Противоопухолевые препараты (производные платины) |
Кроме того, эту группу нарушений вызывает эктопическая продукция АДГ и аргинин-вазопрессина, наблюдающаяся как компонент паранеопластического синдрома при плоскоклеточных раках головы и шеи, нейроэндокринных опухолях, мезотелиомах, опухолях мочеточников, мочевого пузыря, предстательной железы, эндометрия, цистаденокарциномах, саркоме Юинга [18].
Наиболее частой причиной 1б группы изменений являются избыточное поступление свободной воды в организм, что вызывает псевдогипонатриемию. Типичным для таких состояний является нормальная осмолярность плазмы при сниженной концентрации натрия и расхождение более чем на 10 мосмоль/л между расчетной и фактической осмолярностью плазмы. Источником свободной воды может быть полидипсия, вызываемая лекарственными средствами (например, производными фенотиазина - нейролептиками, используемыми как компонент антиэметической терапии). К таким ситуациям могут приводить использование глюкокортикоидов, парапротеинемии и прием алкоголя (как белки, так и липиды являются осмотически активными субстанциями). Другой причиной может быть использование гипотонических растворов для ирригации полостей, например, при трансуретральной резекции предстательной железы или трансцервикальной абляции эндометрия. Необходимо отметить, что внутривенное введение 1 литра 3% глюкозы приводит к снижению осмолярности плазмы на 2,3%, повышению объема плазмы на 83 мл, увеличению содержания внутриклеточной жидкости на 667 мл и внеклеточной на 333 мл. Введение же 0,9% раствора хлорида натрия в том же объеме не влияет на содержание внутриклеточной жидкости и осмолярность, но увеличивает объем плазмы на 230 мл [24].
Нарушения баланса натрия, объединенные в группу 2а, связаны, прежде всего, с уменьшением общего или эффективного объема циркулирующей крови (ОЦК). Назначение нефротоксичных препаратов, таких как производные платины, рвота и диарея, при назначении высокоэметогенных препаратов может осложняться развитием гипонатриемии. Существуют отдельные сообщения о роли цитокинов (ИЛ-2) и моноклональных антител в возникновении гипонатриемии, хотя механизм развития синдрома в таких случаях недостаточно понятен [13]. Другой причиной развития может быть соль-теряющий синдром (Cerebral salt wasting syndrome - CSW). Механизмы развития последнего связаны с поражением головного мозга опухолевым процессом или травмой при операции, приводящим к повышению уровня натрийуретических пептидов, нарушению нервной регуляции почек и надпочечниковой недостаточности [8, 23].
Уменьшение эффективного ОЦК как причина гипонатриемии редко встречается у онкологических больных. Чаще всего, к таким последствиям приводят сердечная недостаточность от использования антрациклинов или развитие нефротического синдрома. Патогенетические механизмы связаны с парадоксальным сокращением ОЦК на фоне гипергидрата и организма, что проявляется отеками, повышенной жаждой, повышенной продукцией АДГ и сниженной клубочковой фильтрацией [23].
К состояниям, для которых характерно развитие гипонатриемии по механизмам, отнесенным к группе 2б, относятся надпочечниковая недостаточность и паранеопластическая продукция натрийуретических пептидов. Первая может быть заподозрена при развитии у больного с метастатическим поражением надпочечников, необъяснимой другими причинами тошноты, рвоты, особенно, если последние сочетаются с гипонатриемией и гиперкалиемией. Второе состояние обусловлено эктопической продукцией натрийуретического пептида. Клинически оно напоминает СНПАДГ, однако при нем уровень натрия в ответ на ограничение потребления жидкости понижается (в отличие от СНПАДГ), а в крови обнаруживают необычно низкие уровни кортизола (d"230 нмоль/ л), а в моче - повышенную концентрацию натрия. Одновременно могут проявляться признаки полиорганной недостаточности, неконтролируемой артериальной гипотензии, рефрактерной к применению симпатомиметиков и инфузионной терапии, признаки системной воспалительной реакции [8].
| Рис.3. Алгоритм диагностического поиска при гипонатриемии. ОВЖ – объем внеклеточной жидкости, СНПАДГ – синдром неадекватной продукции антидиуретического гормона, ОЦК – объем циркулирующей крови. |
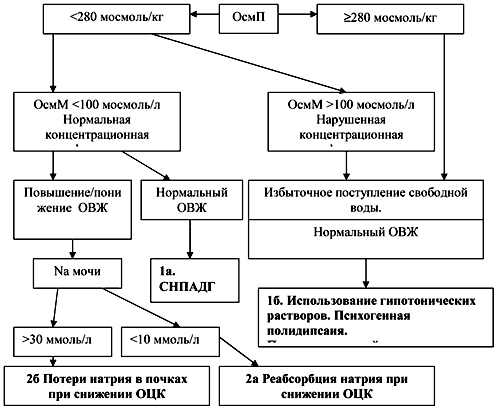 |
Диагностика гипонатриемии
Натрий играет важную роль в поддержании осмолярности плазмы крови. В связи с этим на концентрацию натрия влияют 2 основных фактора: распределение жидкости между компартментами (внеклеточным и внутриклеточным) и баланс воды в организме, с одной стороны, и выведение натрия и воды почками, с другой. Сбор анамнеза и определение проводимой лекарственной терапии для выявления потенциальных причин этого нарушения, оценка функции надпочечников, щитовидной железы и сердечно-сосудистой системы чрезвычайно важны для понимания причин гипонатриемии. Из лабораторных показателей особую важность представляют осмолярность (ОсмП) плазмы крови и мочи (ОсмМ) клиренс свободной воды (КСВ). Первые два показателя могут быть определены фактически с помощью приборов осмомометров или рассчитаны по формуле [5]
ОСмП, мосмоль/кг = глюкоза/18 + мочевина/2,8 + 1,86Na
ОсмМ, мосмоль/кг =33,3 х две последние цифры плотности мочи.
Диагностический алгоритм при гипонатриемии включает в себя несколько шагов.
1. Определение острой (до 48 часов) и хронической гипонатриемии. При первой состояние развивается остро, чаще связано с хирургическими манипуляциями. В связи с быстротой развития органы и системы (прежде всего, головной мозг) не успевают достаточно адаптироваться к низкому уровню натрия, что приводит к проявлению клинической симптоматики. Последняя проявляется анорексией, тошнотой, рвотой, запорами, мышечной слабостью, миалгиями, судорогами. Возможно развитие нарушений сознания вплоть до комы, дыхательных нарушений и, вследствие этого, смерти больного [23]. Острая гипонатриемия является неотложным состоянием и требует быстрой коррекции. Хроническая гипонатриемия гораздо реже сопровождается развитием клинической симптоматики. Постепенное нарастание процесса позволяет компенсаторным механизмам приспособиться к пониженному уровню натрия. Такое состояние требует длительной и медленной коррекции, в противном случае возможна быстрая дестабилизация основных жизненных функций.
2. Исключение возможных причин гипонатриемии. Этот этап требует анализа сопутствующей терапии. Важным является определение уровня глюкозы как первичной причины гипонатриемии, поскольку повышение глюкозы на 3 ммоль/л приводит к уменьшению концентрации натрия на 1,6 ммоль/л. Также необходима оценка функции надпочечников, щитовидной железы.
Для выявления патогенетического механизма гипонатриемии предложен следующий алгоритм [23] - рис. 3.
Терапия гипонатриемии включает в себя, помимо попытки устранения её причины, инфузионную терапию с использованием нормотонических и гипертонических растворов, применение диуретиков. Наиболее эффективным считается использование комбинированного подхода, учитывающего скорость развития симптомов и патогенетический вариант процесса [23]. При острой гипонатриймии терапию начинают с введения гипертонического раствора хлорида натрия в/в в течение 13 мин. в дозе 4 мл/кг в сочетании с лазиксом 1 мл/кг [8].
Темп коррекции - не более 24 ммоль/сут. Лечение может быть продолжено до купирования симптомов или достижения концентрации 133 ммоль/л [23]. Для определения темпа коррекции возможно использование следующих расчетов
Темп инфузии, мл/час = (0ЦК-с)*300/(Nа]*с
c= ОсмИ/ОсмМ - 1
ΔNa= [Nа]*с/(ОЦК - с)
ΔV= (ОЦК - с) /[Na]*c
где ОЦК - объем циркулирующей крови, [Na] - концентрация натрия в сыворотке крови, ΔNa - изменение концентрации натрия в сыворотке после инфузии 1 литра раствора, ΔV - необходимый объем раствора для повышения натрия на 1 ммоль/л. При хронической гипонатриемии быстрая коррекция уровня натрия возможна лишь для купирования тяжелых неврологических расстройств, при этом по возможности рано следует переходить к медленной коррекции. Последняя более безопасна, поскольку дает головному мозгу время для адаптации к меняющемуся уровню натрия. В случае быстрой коррекции уровня натрия возможно развитие осмотического повреждения мозга - центрального понтийного и экстрапонтийного миелоза и ухудшения состояния больного вплоть до летального исхода. Лечение этого осложнения заключается в немедленной реиндукцией гипонатриемии введением гипотонических растворов. Поэтому темп коррекции хронической гипонатриемии не должен превышать 0,3 ммоль/ч, но не более 10 ммоль/сут. Для лечения СНПАДГ (1а тип) используют ограничение потребления жидкости (2/3 от физиологической потребности), - около 1 л/сут. для взрослых и 1 л/м2 для детей). Для внутривенных инфузий используется только 0,9% раствор хлорида натрия. Возможно использование антагонистов V2 рецептора вазопрессина - кониваптана, ликсивоптана (lixivaptan) или толваптана [8]. Демеклоциклин, который устраняет воздействие вазопрессина на собирательные трубочки, также показан в данной ситуации. Он вводится в дозах от 100 до 300 мг 3 раза в день. При 1б типе гипонатриемии лечение заключается во введении изотонического раствора хлорида натрия в сочетании с форсированием диуреза для удаления избытка свободной воды.
При 2 а типе гипонатриемии при истинном уменьшении ОЦК в первую очередь проводят его возмещение с помощью изотонического раствора хлорида натрия, при этом данный процесс может продолжаться в течение длительного времени (например, при возникновении такого состояния на фоне терапии препаратами платины) [23]. Рекомендуется повышенное потребление соли с пищей. Применение минералкортикоидов (например, флудрокортизон 0,4 мг/сут) также может быть полезно для усиления реабсорбции натрия в почках. Длительная терапия минералкортикоидами, однако, опасна развитием гипокалиемии, гипертонии и отека легких. При уменьшении эффективного ОЦК ввиду сердечной недостаточности целесообразно ограничение потребления жидкости при сохранении нормального потребления соли. Используют петлевые диуретики в сочетании с ингибиторами АПФ. Возможно также применение антагонистов V2 рецептора вазопрессина, о которых говорилось выше. При 2б типе гипонатриемии к описанным выше методам добавляют глюкокортикоиды.
Таким образом, гипонатриемия представляет собой достаточно частое осложнение течения опухолевого процесса и противоопухолевой терапии, требующее немедленной коррекции для улучшения прогноза пациента.
Список использованной литературы
- Блиндарь В.Н., Зубрихина Г.Н., Матвеева И.И. с соавт. Ферритин, растворимые рецепторы трансферрина, эритропоэтин у онкологических больных с анемическим синдромом // Материалы конгресса. XI Российский онкологический конгресс. - 2007. - С.233.
- Вокалюк Р.М, Дворецкий Л.И., Заспа Е.А. Стратегия и тактика ведения больных железодефицитной анемией // Русский медицинский журнал. - 2008. - т. 16. - №7. - С.443-432.
- Войнов В.А. Эфферентная терапия // 2006. - т.4. - С.304.
- Дворецкий Л.И. Алгоритмы диагностики и лечения анемий // Русский медицинский журнал. - 2003. - т. 11. - №8. - С.427-433.
- Дементьева И.И. Клинические аспекты состояния и регуляции кислотно-основного гомеостаза // 2003. - №2. -С.241-313.
- Минс РТмл. Факторы, стимулирующие эритропоэз // 2002. - №8.3. - С.200-211.
- Орлова Р.В., Новик А.В. Современные подходы лекарственного лечения генерализованных форм нейроэндокриных опухолей. Симптоматическая терапия синдромов при нейроэндокринных неоплазиях // Практическая онкология. - 2003. - т.6. - №4. - С.240-246.
- Савин И.А. Водно-электролитные нарушения (ВЭН) при черепно-мозговой травме (ЧМТ)// Сайт оделения реанимации НИИ нейрохирургии им.Н.Н.Бурденко РАМН. - 2009. - http ://nsicu.ru/userfiles/file/vodno-electrolitnie.pdf.
- Семенова А.И. Гиперкальциемия и синдром распада опухоли // Практическая онкология. - 2006. - т.7. - №2. -С.101-107.
- Снеговой А.В, Салтанов А.И., МанзюкЛ.В. с соавт. Нутритивная недостаточность и методы ее лечения у онкологических больных // Практическая онкология. - 2009. - т.10. - №1. - С.49-37.
- Рагимов А.А., Еременко А.А., Никифоров Ю.В. с соавт. Гемотрансфузионные реакции и осложнения // 2003. - №7. - С.333-610.
- Дворецкий Л.И. Алгоритмы диагностики и лечения анемий // Русский медицинский журнал. - 2004. - т.11. -№8. - С.427-433.
- Aapro M.S. Editorial: anemia management with erythropoiesis-stimulating agents: a risk-benefit update// Oncologist. -2008. - Vol.13, Suppl. 3. - P. 1-3.
- Aapro M.S., Link H. September 2007 update on EORTC guidelines and anemia management with erythropoiesis-stimulating agents // Oncologist. - 2008. - Vol.13, Suppl. 3. - P.33-36.
- Berghmans T. Hyponatremia related to medical anticancer treatment// Support.Care Cancer. - 1996. - Vol.4. - №3. -P.341-330.
- Berghmans T, Paesmans M, Body JJ. A prospective study on hyponatraemia in medical cancer patients: epidemiology, aetiology and differential diagnosis // Support. Care Cancer. - 2000. - Vol.8. - №3. - P.192-197.
- Caro JJ, Salas M, Ward A. et al. Anemia as an independent prognostic factor for survival in patients with cancer: a systemic, quantitative review // Cancer. - 2001. - Vol.91. - №12. - P.2214-2221.
- Ellison DH, Berl T. Clinical practice. The syndrome of inappropriate antidiuresis // N.Engl.J. Med. - 2007. - Vol.336. -№20. - P.2064-2072.
- Fandrey J. Erythropoietin receptors on tumor cells: what do they mean?// Oncologist. - 2008. - Vol.13, Suppl. 3. - P. 16-20.
- Gascon P. Safety update on erythropoiesis-stimulating agents: trials within and outside the accepted indications // Oncologist. - 2008. - Vol.13, Suppl. 3. - P.4-10.
- Henke M, LaszigR, Rube C. et al. Erythropoietin to treat head and neck cancer patients with anaemia undergoing radiotherapy: randomised, double-blind, placebo-controlled trial // Lancet. - 2003. - Vol.362. - №9392. - P. 12331260.
- Hoffman P. C. Immune hemolytic anemia—selected topics // Hematology.Am.Soc.Hematol.Educ.Program. - 2006. -P. 13-18.
- Hoorn EJ, Halperin M.L., Zietse R. Diagnostic approach to a patient with hyponatraemia: traditional versus physiology-based options // QJM. - 2003. - Vol.98. - №7. - P.329-340.
- Mange, Kevin, Matsuura, Dean, Cizman, Borut et al. Language Guiding Therapy: The Case of Dehydration versus Volume Depletion // Ann.Intern.Med. - 1997. - Vol.127. - №9. - P.848-833.
- Onitilo AA, Kio E, Doi SA. Tumor-related hyponatremia // Clin. Med.Res. - 2007. - Vol.3. - №4. - P.228-237.
- Scrijvers D, Roila F. On behalf of the ESMo Guidelines Working GroupErythropoiesis-stimulating agents in cancer patients: ESMO Recommendations for use // Ann.Oncol. - 2009. - Vol.20, suppl. 4. - P.iv139-iv161.
- Tonelli M, Hemmelgarn B, Reiman T. et al. Benefits and harms of erythropoiesis-stimulating agents for anemia related to cancer: a meta-analysis // CMAJ. - 2009. - Vol.180. - №11. - P.E62-E71.
- Vamvakas E.C., Taswell H.F. Long-term survival after blood transfusion // Transfusion. - 1994. - Vol.34. - №6. -P.471-477.
- Vaupel P. Hypoxia and aggressive tumor phenotype: implications for therapy and prognosis // Oncologist. - 2008. -Vol.13, Suppl. 3. - P.21-26.
