Мировой опыт применения цитрата магния в медицине
Статьи Опубликовано в журнале:«Трудный пациент»; ТОМ 8; № 8; 2010; стр. 20-27.
О.А.Громова1,2, И.Ю.Торшин И1, Т.Р.Гришина1,2
2ГОУ ВПО «Ивановская Государственная Медицинская Академия МЗ РФ»
Введение
Современный стиль жизни включающий, как правило, высокие уровни стресса, нерациональная диета и наличие в диете большинства людей искусственных продуктов питания и напитков создали проблему хронического дефицита магния. Упрощенное понимание фармакологии субстанций магния привело к широкомасштабным попыткам применения неорганических форм магния для компенсации дефицита этого элемента. Однако как показали фармакокинетические исследования, неорганические формы магния (оксид, сульфат, хлорид и др.) характеризуются низкой биоусвояемостью и побочными эффектами [1]. Поэтому актуальны исследования терапевтических применений органических форм магния.
Цитрат магния - одна из органических солей, используемых для изготовления современных магний-содержащих препаратов. Так как цитрат является органической и хорошо растворимой формой магния, это в значительной степени обуславливает его высокую биоусвояемость. Однако хорошая растворимость в воде -далеко не единственная особенность цитрата магния, который также характеризуется рядом специфических молекулярных эффектов. Эти эффекты включают участие магния как центрального субстрата цикла Кребса (который даже имеет альтернативное название «цитратный цикл»), взаимодействия с белками-транспортерами дикарбоксилатов и физико-химические особенности самой молекулы цитрата. Следует подчеркнуть, что все метаболиты цитрата - эссенциальные эндогенные молекулы. Практически полная утилизация цитрата (превращение в углекислый газ и воду) делает его идеальным переносчиком магния [2]. В некотором роде, цитрат -идеальная, полностью биодеградирующаяся, «экологически чистая тара» для транспорта магния внутрь клеток, которая к тому же еще служит эффективным топливом.
В настоящей работе нами был проведен систематический анализ литературы по фармакологии и клиническим исследованиям цитрата магния. Анализ показал значительные отличия в фармакокинетике цитрата магния (прежде всего, высокая растворимость и усвояемость), которые в значительной степени определяют спектр его терапевтических и профилактических применений (рис. 1).
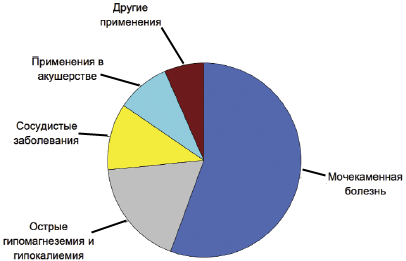
Рис. 1. Клинические исследования по терапевтическому и профилактическому применению цитрата магния
Анализ литературы по медицинским применениям препаратов цитрата магния указал на существование двух принципиально различных областей применения: терапевтическую/профилактическую и клинико-диагностическую. К последним относится применение высоких однократных доз цитрата магния (в количествах более 10 г) в качестве эффективного и безопасного слабительного при подготовке кишечника к колонографии (12 исследований) и при неотложной помощи (1 исследование). Как видно из рис. 1 почти 75% исследований терапевтического применения цитрата магния относились к терапии и профилактике мочекаменной болезни, компенсации гипокалиемии и гипомагнеземии. В целом, цитрат магния применяется в терапии более 50 лет и используется для профилактики образования почечных камней (25 исследований), при лечении и профилактике гипомагнеземии и гипокалиемии (8), при сосудистых заболеваниях (5) и в акушерстве (4 исследования). Другие медицинские применения цитрата магния (3 исследования) включают нормализацию минеральной плотности костей, лечение синдрома беспокойных ног и бронхиальной астмы.
Далее рассматриваются исследования по применению сверхвысоких доз цитрата магния в качестве безопасного слабительного. Затем рассматриваются особенности фармакокинетики цитрата магния. Наконец, представлен подробный обзор результатов упомянутых выше клинических исследований в терапии.
Цитрат магния в высоких дозах -безопасное слабительное
В больших дозах (10-30 г), цитрат магния действует как осмотическое слабительное и используется при подготовке толстой кишки у взрослых, детей и подростков для прохождения диагностических процедур (колоноскопия или рентгеновское обследование кишечника) или для подготовки к хирургическому вмешательству. Следует отметить, что при использовании высоких доз цитрата магния в качестве слабительного желательно компенсировать потери цинка, неизбежные при использовании любого слабительного. Цинк нормализует физиологический статус тонкой кишки и снижает риск повторной диареи [3].
Данные доказательной медицины свидетельствуют, что применение цитрата магния обеспечивает очищающий эффект с минимальными потерями жидкости из организма. В исследовании 232 человек, 118 пациентов получали фосфат натрия, а 115 пациентов с риском фосфорной нефропатии - цитрат магния. И фосфат натрия, и цитрат магния приводили к степени очистки кишечника приемлемой для прохождения компьютерной томографии. При этом в группе цитрата магния наблюдались меньшие потери жидкости организмом, что способствовало более быстрому восстановлению функций кишечника после процедуры [4, 5]. В другом исследовании 69 последовательных пациентов были случайным образом распределены на прием фосфата натрия или цитрата магния. Было выявлено, что пациенты в группе цитрата магния имели меньше жалоб и характеризовались меньшими потерями жидкости [6].
Композиции пикосульфата натрия/цитрата магния часто используются в качестве очищающего средства толстой кишки перед диагностическими процедурами. Малые дозы пикосульфата натрия служат слабительным стимулятором, увеличивая частоту и интенсивность перистальтики, а высокие дозы цитрата магния - осмотическим слабительным (т. е. удерживающим повышенное количество жидкости в толстой кишке, что облегчает очистку кишечника). Такая комбинация хорошо переносится, тошнота и рвота, боль и вздутие живота наблюдаются значительно реже, чем при использовании фосфата натрия или полиэтиленгликоля. Профиль переносимости смеси пикосульфат натрия/цитрат магния у пациентов в возрасте старше 70 лет такой же, как и у пациентов моложе 70 лет [7, 8].
Безопасный и высокоэффективный слабительный эффект высоких доз цитрата магния делает его средством выбора в неотложной терапии для преодоления последствий отравлений. В эксперименте пероральный прием токсиканта параквата дополнялся приемом магния цитрата. Паракват (N,N'-диметил-4,4'-бипиридина дихлорид) используется как сильный гербицид неспецифического действия и токсичен не только для сорных растений, но и для человека и животных. Паракват (200 мг/кг) давался мышам внутрижелудочно, затем через 30 мин давался активированный уголь. Когда активированный уголь вводили одновременно с цитратом магния, выживаемость животных возросла с 30-60% до 94%(Р<0,01) [9].
Лечение 64 детей с различными отравлениями включало применение активированного угля в количестве 1 г/кг в сочетании с 6% раствором цитрата магния в разных количества: 0 мл/кг, 4 мл/кг (стандартная рекомендуемая доза), 6 мл/кг или 8 мл/кг. Исследование показало дозозависимый эффект цитрата магния. Использование цитрата магния значительно сократило время транзита активированного угля по ЖКТ (p=0,004): среднее время появления стула с углем составило 20 ч при отсутствии цитрата магния (0 мл/кг), 13 ч (4 мл/кг), 14 ч (6 мл/кг) и 12 ч (8 мл/кг). Ускорение прохождения активированного угля через ЖКТ способствовало более быстрому удалению токсичных веществ из организма ребенка [10].
Фармакокинетика цитрата магния
С момента того, как цитрат магния стал рассматриваться в качестве лекарственного средства для курсового применения у пациентов с хроническим дефицитом магния, стало необходимым определение достоверных фармакокинетических характеристик этой субстанции. Несмотря на десятки работ по клиническим применениям цитрата магния, нам не удалось обнаружить в опубликованной литературе систематических фармако-кинетических исследований цитрата магния (определение фармакокинетических кривых в плазме, эритроцитах, и других клетках, определение Т1/2, Тмакс, объема распределения, содержание магния в моче и других жидких средах организма в динамике применения и т. д.). Ниже представлены результаты отдельных работ, которые можно рассматривать как предварительные результаты фармакокинетических исследований.
Различные субстанции магния демонстрируют различное фармакологическое воздействие [1]. Анион, соединенный с магнием (окись, хлорид, глюконат, лактат, цитрат и т. д.), влияет на процесс биоусвоения магния и тем самым приводит к различиям в фармакодинамике [11-13]. Цитрат магния способствует активации транспорта магния внутрь клетки. По сравнению с неорганическими соединениями и аминокислотными хелатами, цитрат магния не только приводит к большему увеличению содержания калия, натрия и магния в плазме крови, но и вызывает значительное увеличение активности Na, K-насосов в эритроцитах [12].
Соединения магния различаются по растворимости и, соответственно, по биодоступности. Например, оксид магния, широко используемый в препаратах магния 1-го поколения, практически нерастворим в воде. Даже в соляной кислоте желудка растворяется не более 45% от вводимого количества MgO. Цитрат магния (рис. 2), напротив, обладает очень высокой растворимостью: при температуре 20-25°С массовая доля безводного цитрата магния достигает 55% (т. е. 55 г цитрата магния могут быть полностью растворены в 45 мл воды). Получаемый раствор прозрачен и имеет приятный привкус лимонной кислоты.
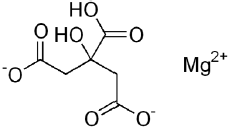
Рис. 2. Химическая формула цитрата магния
Различия в растворимости соединений магния естественно сказываются на биодоступности: биодоступность цитрата магния составляет 35-38%, в то время как биодоступность неорганических солей магния не превышает 5% (гидроксид магния) [11-13].
Высокая биодоступность цитрата магния подтверждается результатами клинико-фармакологических исследований. У здоровых добровольцев, увеличение количества магния после нагрузки в 25 ммоль магния была значительно выше в случае применения цитрата магния, чем оксида магния (р<0,05) [14]. В отличие от неорганических солей, цитрат магния не вызывает поражения слизистой оболочки ЖКТ и характеризуется гораздо лучшей переносимостью [1, 15]. Использование именно цитрата магния также приводит к лучшему усвоению магния при пониженной кислотности желудка по сравнению с лактатом и другими органическими формами магния.
В исследовании 46 здоровых добровольцев была проведена оценка биодоступности аминокислотного хелата магния, цитрата магния и оксида магния. Добровольцы принимали по 300 мг элементного магния/сут однократно и/или в течение 60 дней. Оценивалось количество магния в суточной моче в динамике применения препаратов. Органические формы магния (цитрат и аминокислотный хелат) показали большую степень всасывания, чем оксид магния (р=0,03). При этом, цитрат магния приводил к наибольшей средней концентрации сывороточного магния по сравнению с другими препаратами как после однократного приема (р=0,03), так и многократного приема (р=0,006). Многократный прием цитрата магния также приводил к наибольшему увеличению концентрации магния в слюне по сравнению с другими исследованными формами магния (р=0,03) [16].
Терапия и профилактика образования почечных камней
Почки являются центральным органом регуляции минерального обмена организма. Ионы Mg2+ поддерживают осмотический баланс: введение солей магния действует в качестве осмотического диуретика и дает отчетливый мочегонный эффект. Известно, что дисбаланс магния и кальция ( Ca2+, Mg2+) в моче потенцирует камнеобразование в почках. Почечные камни часто содержат заметные количества нерастворимых солей кальция - оксалата и фосфата.
Мочекаменная болезнь - заболевание с многофакторной этиологией, широко распространенное в сельских, городских, и промышленных, особенно на фоне современного гипомагниевого питания, недостаточного потребление воды и малоподвижного образа жизни. Известные факторы риска включают ожирение, высокое содержание белков и жиров в пище, преимущественно молочное питание, высокое или крайне низкое содержание кальция в диете, недостаточное потребление жидкости (чистой питьевой воды) [17]. Исследования показали несостоятельность устаревшего положения о необходимости диетических ограничений по кальцию. Наоборот, физиологически нормальный уровень кальция в ЖКТ обеспечивает защиту от камнеобразования [18].
При мочекаменной болезни важно ограничение натрия в рационе питания, прежде всего в форме рафинированной поваренной соли. В отличие от природных пищевых солей (морская соль, каменная соль), содержащих магний, калий и многие микроэлементы, рафинированная поваренная соль содержит исключительно NaCl [19].
Развитие мочекаменной болезни является длительным метаболическим процессом, поэтому эффективных и безопасных синтетических фармакологических средств для терапии мочекаменной болезни так и не было найдено и существует настоятельная необходимость в лекарствах для длительного применения, препятствующих образованию почечных кальцификатов и нефрокальциноза. В качестве такого средства в настоящее время апробрировано использование цитрата калия для подщелачивания первичной мочи. При этом совершенно упускается из виду, что пациенты с мочекаменной болезнью характеризуются не только дефицитом калия, но и дефицитом магния.
Известно, что уровни магния выше у здоровых людей, чем у пациентов с оксалатными камнями. Это позволяет предположить, что повышенная квота магния в моче может предотвратить осаждение соединений кальция и, таким образом, профилактировать или замедлять возникновение оксалатных камней. В самом деле, при длительной заместительной терапии магнием (200-250 мг солей в день) доля рецидивов камнеобразования у пациентов с оксалатными камнями снижается на 90% [20]. Терапевтическое применения магния для лечения оксалатных камней целесообразно сочетать с терапией пиридоксином, который независимо от магния понижает уровни оксалатов в организме [2].
Экспериментальные и клинические исследования показывают, что именно совместный прием цитрата магния и цитрата калия - эффективное средство торможения роста почечных камней и предотвращения рецидивов камнеобразования [21]. В эксперименте использование только цитрата калия может даже приводить к обострению образования почечных конкрементов, в то время как совместное применение с цитратом магния полностью исключает камнеобразование [22]. У крыс с высоким содержанием гликолевой кислоты (0,5% гликоля в питьевой воде) в диете отмечалось развитие мочевых камней в течение 4 нед. В то же время животные, которые дополнительно получали дотации цитрата магния, не имели камней в мочевой системе [23]. Следует отметить, что гликоль используется в синтетических напитках в качестве подсластителя.
Длительное пребывание пациентов на постельном режиме увеличивает риск формирования камней в почках. 10 добровольцев с нормальным содержанием кальция и уратов в моче получали смесь цитрата калия и цитрата магния (40 мг K+, 40 мг Mg2+/сут) в течение 5 нед строгого постельного режима, а 10 - получали плацебо. Содержание элементного магния в безводном цитрате магния составляет 162 мг на 1 г соли, так что 40 мг Мg2+/сут соответствует приему 250 мг цитрата магния. Прием композиции цитратов K и Mg продемонстрировал значительное снижение относительного насыщения мочи оксалатом кальция; концентрация недиссоциированной мочевой кислоты снижалась по сравнению с плацебо [24].
Эффекты использования композиции цитратов магния и калия на биохимические параметры мочи изучались у 61 пациента с мочекаменной болезнью. Пациенты были разделены на 4 группы и в течение 1 месяца получали хлористый калий (группа 1), цитраты калия и натрия (группа 2), магния глицинат (группа 3) и цитраты калия и магния (группа 4). Дозы калия и магния в расчете на элементное содержание составили 42 мг К+/сут, 42 мг Mg2+/сут. Хотя содержание калия в моче увеличивалось во всех группах, применение смеси цитратов калия и магния (группа 4) приводило к наилучшим результатам: у пациентов увеличивались уровни калия, магния и цитрата, повышался рН мочи, то есть активировались метаболические ресурсы, которые тормозят камнеобразование [25].
Следует отметить, что на фоне дефицита Mg, К и дисбаланса Са, в последнее десятилетие часто отмечается избыточная нагрузка фосфором, который входит в состав многочисленных разновидностей искусственной пищи. Это фосфорные кислоты и фосфорные соли, используемые для удержания т. н. «товарного вида» колбас, сосисок; ортофосфорная кислота в лимонадах и напитках типа пепси, кока-кола и спрайт, фосфаты в красителях, разрыхлителях, загустителях. Отметим, что в отличие от естественных источников фосфора (рыба, яйцо), фосфор в искусственной пище характеризуется низкой биоусвояемостью и перегружает выделительную систему почек. Избыток фосфора крайне отрицательно сказывается как на магниевом гомеостазе, так и на минеральном балансе.
В частности, некоторые газированные напитки содержат значительное количество фосфорной кислоты. Концентрации в сыворотке крови и в моче кальция, оксалатов, фосфатов, мочевой кислоты изучались до и после употребления газированных напитков типа кока-колы. Четыре участника воздерживались 48 ч от употребления этих напитков, затем выпивали по 2-3 литра кока-колы в день в течение 2 дней. Было установлено увеличение фосфатов в моче; мочевая экскреция оксалата увеличивалась на 8,3 мг. Содержание магния в моче снизилось на 2,6 мг, а содержание цитрата - на 122 мг. Такие изменения создают условия дл образования камней в почках и значительно повышают риск мочекаменной болезни [26].
Магний и цитрат-анион выступают ингибиторами кристаллизации оксалатов в моче. Наблюдения за 50 пациентами с рецидивирующей мочекаменной болезнью показали, что цитрат Mg увеличивает время агломерации кристаллов оксалата кальция в моче [27], тем самым значительно способствуя замедлению камнеобразования.
В двойном слепом исследовании 64 пациента были рандомизированы на 2 группы: принимавших плацебо и принимавших цитраты калия, магния (42 мг К+/сут, 42 мг Mg2+/сут) в течение 3 лет. Результаты показали, что новые камни образовались у 63,6% пациентов в группе плацебо; среди принимавших цитраты магния и калия только 12,9% пациентов имели новые камни в почках. Совместный прием цитратов магния и калия имел статистически значимый эффект в снижении риска камнеобразования даже после поправок на возраст и на нарушения кальций - оксалатного баланса в моче (отношение шансов 0,1; 95% доверительный интервал 0,03-0,36) [28].
Таким образом, разносторонние клинические исследования показали: необходимость возмещения дефицитов магния и цитрата в моче и эффективность долговременного применения цитрата магния в сочетании с цитратом калия. Применение цитрата магния для терапии оксалатных камней целесообразно целевым ингибитором образования оксалатов пиридоксином, который также является эффективным синергистом магния.
Лечение и профилактика острой гипомагнеземии и гипокалиемии
Острые гипомагнеземия и гипокалиемия возникают у пациентов с инфарктом миокарда, во время операции или во время беременности (гестоз). Часто используется в/в введение сульфата магния для быстрой компенсации острого дефицита магния. Использование сернокислой магнезии может приводить к передозировке магния, имеющей многочисленные нежелательные эффекты [29]. Безопасной альтернативой является пероральный прием магния в виде органических солей (цитрат, лактат, пидолат) не только после того как острый дефицит магния уже появился, но и в профилактических целях для избежания дефицита.
Гипомагнеземия и гипокалиемия возникает при использовании таких диуретиков, как тиазиды и фуросемид у пациентов с артериальной гипертонией, отеками и т. д. Эти мочегонные средства вызывают резкие потери Mg, K и других электролитов, которые обязательно должны быть возмещены с целью предотвращения побочных эффектов (слабость, аритмия, судороги и др).
Цитрат магния весьма эффективен при компенсации и профилактике нарушений электролитного баланса. В исследовании 22 добровольцев, получавших гидрохлоротиазид в количестве 50 мг/сут, 10 человек одновременно получали смесь цитратов магния и калия (42 мг К+/сут, 42 мг Mg2+/сут), а 12 человек - только хлорид калия (42 мг К+/сут). Помимо компенсации дефицита калия, композиции цитратов K и Mg способствовали ощелачиванию мочи (т. е. повышению рН мочи), снижению уровней мочевой кислоты и снижению насыщения оксалата кальция. Хлорид калия приводил только к увеличению содержания калия в моче и не влиял на уровни магния [30, 31].
В другом исследовании 61 пациент получали 50 мг/сут гидрохлоротиазида. После 3 нед приема умеренная гипокалиемия развилась практически у каждого пациента. Прием этими пациентами 6-10 таблеток цитрата магния в сутки (42 мг К+/таб, 42 мг Mg2+/таб) значительно увеличивал рН мочи и уровни цитрата. Побочные эффекты тиазидной терапии полностью компенсировались при приеме 10 таб/сут [32].
В другом исследовании содержание магния в сыворотке у 242 здоровых добровольцев, принимавших тиазидные диуретики, показало, что гипомагнеземия (магний <1,8 мг/дл) сформировалась в течение 3 нед приема диуретиков у 19% обследованных. В то же время в группе 131 добровольца, получавших одновременно и тиазиды и цитрат магния, гипомагнеземия развилась менее чем у 5% обследованных. Цитрат магния значительно способствовал нормализации концентраций магния в плазме крови [33].
Сосудистые заболевания
Уровень магния в плазме крови ниже 0,76 ммоль/л рассматривается как значимый фактор риска возникновения инфаркта миокарда и инсульта: европейское эпидемиологическое исследование по кардиоваскулярным заболеваниям определило гипомагнеземию как важный фактор риска смертности от инсульта и сердечно-сосудистых заболеваний [34]. При снижении уровня Mg2+ возрастает тонус коронарных сосудов, что ведет к ишемическому повреждению. Введение необходимого и достаточного количества магния, кальция и калия, ненасыщенных жиров, а также нормы (но не избытка!) антиоксидантов рассматривается как важный резерв для снижения смертности от кардиоваскулярных заболеваний. Низкая концентрация именно внеклеточного магния приводит к спазму сосудов, повышая их чувствительность к вазопрессорным агентам.
Влияние магния на тонус гладкой мускулатуры сосудов обусловлено по меньшей мере тремя факторами. Во-первых, ионы Mg2+, наряду с другими эссенциальными МЭ, участвуют в регулировании осмотического баланса; проявляют четкие мочегонный и противоотечный эффекты. Во-вторых, магний является природным регулятором сосудистого тонуса, снижая реакцию артерий на воздействие эндогенных вазоконстрикторов: адреналина (через фермент катехол-О-метил-трансферазу, деградирующую катехоламины), альдостерона, вазопрессина, ангиотензина-2. В-третьих, магний противодействует образованию атеросклеротических бляшек, способствует нормализации свертываемости крови, что ведет к увеличению просвета сосуда [1]. Поэтому, использование препаратов органического магния (лактат магния в составе Магне В6) имеет положительный эффект на сосудистую динамику [35].
Прием цитрата магния улучшает функцию эндотелия у пациентов с болезнью коронарных артерий. Цитрат магния при применении совместно с цитратом калия -превосходное средство против кальцификации сосудов, приводящее к полному восстановлению нормального внеклеточного гомеостаза минералов и мочевой кислоты [36].
Крайне интересно отметить, что прием цитрата магния способствует улучшению зрения и восстановлению глазного кровотока и у пациентов с нормотензивной формой глаукомы (т. е. глаукомы на фоне нормального глазного давления). 15 пациентов получали 300 мг элементного магния/сут в виде цитрата магния в течение 1 месяца, в то время в контрольной группе пациенты получали плацебо. Допплерография глазных сосудов показала, что терапия цитратом магния приводит к улучшениям в глазном кровотоке и к увеличению периметра полей зрения (р<0,05) [37].
Другое очень важное направление изучения эффективности цитрата магния - терапия мигрени. Профилактическое воздействие перорального приема цитрата магния (600 мг/сут в течение 3 месяцев) изучалось у 40 пациентов с мигренью без ауры. Частота приступов (р=0,005), интенсивность боли (р<0,001) и амплитуда отведения P1 (р<0,05) оказались значительно ниже, чем в группе плацебо. Кортикальный кровоток значительно возрос после приема цитрата магния по сравнению с плацебо (р <0,01) [38].
Перспективным является использование цитрата магния в спортивной медицине. Например, цитрат магния может быть использован для лечения острой горной болезни и частично снимает симптомы этого заболевания [39]. Острая горная болезнь может повлиять на альпинистов, туристов, лыжников, путешественников на большой высоте (2400 метров) и является результатом пониженного давления воздуха и концентрации кислорода. Симптоматика горной болезни затрагивает нервную систему, легкие, мышцы, сердце и может варьировать от легкой формы до угрожающей жизни. Магний является физиологическим антагонистом рецепторов NMDA, которые могут участвовать в патогенезе острой горной болезни. Вазодилатирующий эффект высоко биодоступного цитрата магния способствует быстрому снижению симптоматики.
Цитрат магния в акушерстве и гинекологии
В нескольких исследованиях анализировалась безопасность и эффективность применения лактата магния и цитрата магния у беременных. Как показал мета-анализ 5 плацебо-контролируемых исследований на 352 женщинах (150 мг солей магния 2 раза в день), назначение цитрата магния с 4-5-й недели беременности у беременных с дефицитом магния приводит к достоверному снижению уровня спонтанных выкидышей [40].
Цитрат магния также используется для профилактики судорог в икроножных мышцах у беременных [40, 41]. Высокая безопасность и эффективность сверхвысоких доз цитрата магния как слабительного позволяет использовать его при колоноскопии беременных. По соображениям безопасности только немногие субстанции могут использоваться для подготовки к колоноскопии в период беременности [42].
В отдельных случаях из практики применение цитрата магния даже спасает жизнь беременной и плода. Например, беременной 33 лет с синдромом Гительмана (врожденная тубулопатия, характеризующаяся гипокалиемией, гипомагнеземией, метаболическим алкалозом и гипокальциурией) был назначен цитрат магния в смеси с хлоридом калия. После назначения синдром был скомпенсирован, и беременность разрешилась нормальными родами в срок [43].
Несмотря на то что опубликовано всего несколько исследований по применениям цитрата магния в акушерстве, данная органическая форма магния имеет очень большие перспективы применения в данной области. В первую очередь это связано с явной нефрологической направленностью препаратов на основе цитрата магния (см. выше). Поэтому открывается перспектива использования цитрата магния при гестозах и отечной форме предменструального синдрома. Нарушения функционирования почек характерны для гестоза - одной из наиболее опасной патологий беременности. Клинических исследований по данному вопросу крайне мало [40], и проведение таких исследований -крайне актуальная задача.
Другие медицинские применения цитрата магния
Минеральная плотность костной ткани: прием цитрата магния способствует увеличению минеральной плотности костной ткани. Совместное назначение магния с кальцием, как известно, весьма полезно в профилактике остеопороза [1]. Среди 20 женщин в постменопаузе, 10 получали магния цитрат (1830 мг/сут) в течение 30 дней, 10 - плацебо. Пероральный прием цитрата магния вызвал значительное снижение интактного паратгормона (iPTH) в сыворотке крови (р<0,05), увеличение сывороточного остеокальцина (р<0,001) и уменьшение деоксипиридинолина в моче (р<0,001) - изменения, соответствующие уменьшению интенсивности ресорбции костей [44].
Судороги ног: для лечения синдрома подвижных ног часто используется хинин, имеющий ряд побочных эффектов. В то же время, совершенно забывается, что магний - естественный регулятор нервной проводимости и способствует снижению возбуждения нейронов до физиологически необходимых уровней. Цитрат магния, эквивалентный 300 мг элементарного магния, или плацебо давались добровольцам в течение 6 недель. В группе плацебо (n=29) среднее число судорог составило 9 (95% Д.И. 6-17), в группе принимавших цитрат магния -5 (95% Д.И. 4-8, р=0,07) [45].
Бронхиальная астма: 12-недельный прием цитрата магния позволил уменьшить использование бронходилататорных ингаляций у детей со стабильной бронхиальной астмой. В группе 89 детей 4-16 лет, каждый испытуемый получал либо 1 капсулу цитрата магния (7 лет: 200 мг/сут; >7 лет: 290 мг/сут) или 1 капсулу плацебо. Частота использования бронходилататоров была значительно выше после 12 недель в группе плацебо, чем в группе пациентов принимавших цитрат магния (р<0,05) [46].
Препараты на основе цитрата магния
Несмотря на то что цитрат магния с успехом используется во многих странах мира более 20 лет, в России как фармакологическая субстанция цитрат магния зарегистрирован сравнительно недавно (2010). Цитрат магния получил разрешение к применению у детей, беременных и в терапии. В настоящее время в качестве фармакологического препарата на основе цитрата магния в России имеется всего лишь один - Магне В6 Форте. Препарат состоит из синергидной фармакологической комбинации цитрата магния (618 мг солей цитрата магния, что эквивалентно 100 мг элементного магния) и пиридоксина гидрохлорида (в количестве 10 мг). Такое дозирование позволяет проводить лечение препаратом по простой схеме: 1 таблетка 3 раза в день, а для поддерживающего курса лечения: по 1 таблетке 2 раза в день. Таблетки Магне В6 Форте следует принимать во время еды целиком, не разжевывая, запивая стаканом воды. Длительность курса терапии гипомагнеземии составляет 1 мес; профилактическое назначение или поддерживающая терапия может быть от 2 мес и более. На основании приведенного мирового опыта можно сформулировать следующий алгоритм применения цитрата магния (препарат Магне В6 Форте) ( табл. 1).
Таблица 1.
Магне В6 Форте как препарат выбора в клинической практике
| Анамнез и симптоматика | Дополнительные диагностические критерии | Применение Магне В6 Форте |
| Нервно-артритический диатез, мочекаменная болезнь (оксалаты) | Уровень оксалатов в моче, ↓,Mg (плазма, суточная моча) | 1 таб. 3 раза в сутки, 2 мес, затем по 1 таб. 2 раза в сутки в течение 6-12 мес, терапия может быть. продолжена |
| Мочекаменная болезнь (ураты, фосфаты) | ↑Ураты, ↑фосфаты, ↓Mg (плазма, суточная моча) | 1 таб. 2 раза в сутки в теч 6-12 мес + нормализация питьевого режима |
| Гестоз | ↓Mg (плазма, суточная моча) | 1 таб 2-3 раза в сутки, 2-3 мес |
| Отечная форма ПМС | Гиперэстрогения, задержка жидкости, ↓Mg (плазма, суточная моча) | В составе комплексной терапии 1 таб 2-3 раза в сутки, 3-6 мес |
| Постменопаузальный остеопороз | ↓Mg (плазма, суточная моча), ↑паратгормон, ↓остеокальцин | В составе комплексной терапии 1 таб. 3-4 раза в сутки, 6-12 мес |
| Аритмия (ускорение ритма, экстрасистолия) | ↓Mg (плазма, суточная моча), ↓К (плазма) | 1 таб. Магне В6 Форте 1 раз в сутки, цитрат калия (40 мг К+/сут), 3-12 мес. |
| Курсовое назначение тиазидных диуретиков, фуросемида | ↓Mg (плазма, суточная моча), ↓К (плазма) | 4-5 таб. Магне В6 Форте 1 раз в сутки, цитрат калия (400 мг К+/сут), в течение курса |
| Нормотензивная форма глаукомы | Нормальное глазное давление, сужение полей зрения, ↓глазной кровоток | 1 таб. 2-3 раза в сутки в составе комплексной терапии, до 3 мес |
| Мигрень без ауры | ↓Mg (плазма, суточная моча) | По 2 таб. 3 раза в сутки, 3 мес |
Заключение
В настоящей работе представлены результаты систематического анализа мировой литературы по фармакологии и клиническим исследованиям цитрата магния. В организме цитрат-анион практически полностью превращается в углекислый газ и воду; практически полная утилизация цитрата делает его «экологически чистой тарой» для транспорта магния внутрь клеток. Цитрат магния применяется в терапии и профилактике образования почечных камней, для компенсации гипомагнеземии. Применение цитрата магния способствует компенсации гипокалиемии, т. к. магний обладает калийсберегающим эффектом. Цитрат магния очень перспективен при лечении сосудистых заболеваний (в том числе мигрени, нормотензивной формы глаукомы) и может быть использован для нормализации минеральной плотности костей, лечения синдрома беспокойных ног и бронхиальной астмы (рис. 3).
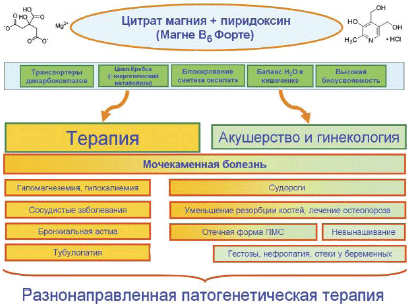
Рис. 3. Перспективы и терапевтическое применение цитрата магния с пиридоксином
Несмотря на то, что опубликовано всего несколько исследований по применениям цитрата магния в акушерстве, данная органическая форма магния имеет большие перспективы применения в данной области. В первую очередь это относится к применению магния для терапии и профилактики гестоза, нефропатии беременных, мочекаменной болезни и других заболеваний почек у беременных. Безопасность цитрата магния и его высокая биоусвояемость делают препарат актуальным его употребления беременными с целью профилактики и лечения нарушений почек для (гестозы).
Литература
1. Torshin I.Yu, Gromova OA. Magnesium and pyridoxine: fundamental studies and clinical practice // Nova Science. 2009; 250.
2. Громова О.А., Торшин И.Ю. Молекулярная фармакология цитрата магния и пиридоксина // Клин фармакол фармакоэконом. 2010.
3. Altaf W., Perveen S., Rehman K.U., Teichberg S., Vancurova I., Harper R.G., Wapnir R.A. Zinc supplementation in oral rehydration solutions: experimental assessment and mechanisms of action // J Am Coll Nutr. 2002; 21 (1): 26-32.
4. Borden Z.S., Pickhardt P.J., Kim D.H., Lubner M.G., Agriantonis D.J., Hinshaw J.L. Bowel preparation for CT colonography: blinded comparison of magnesium citrate and sodium phosphate for catharsis // Radiology. 2010; 254 (1): 138-144.
5. Love J., Bernard E.J., Cockeram A., Cohen L., Fishman M., Gray J., Morgan D. A multicentre, observational study of sodium picosulfate and magnesium citrate as a precolonoscopy bowel preparation // Can J Gastroenterol. 2009; 23 (10): 706-710.
6. Yoon S.H., Kim S.H., Kim S.G., Kim S.J., Lee J.M., Lee J.Y, Han J.K., Choi B.I. Comparison study of different bowel preparation regimens and different fecal-tagging agents on tagging efficacy, patients' compliance, and diagnostic performance of computed tomographic colonography: preliminary study // J Comput Assist Tomogr. 2009; 33 (5): 657-665.
7. Hoy S.M., Scott L.J., Wagstaff A.J. Sodium picosulfate/magnesium citrate: a review of its use as a colorectal cleanser // Drugs. 2009; 69 (1): 123-36.
8. Swarbrick M.J., Collins M.C., Moore D.J., McBride K.D. A comparative trial of magnesium citrate (Citramag) and Picolax for barium enema bowel preparation // Clin Radiol. 1994; 49 (6): 379-381.
9. Gaudreault P., Friedman P.A., Lovejoy F.H.Jr. Efficacy of activated charcoal and magnesium citrate in the treatment of oral paraquat intoxication // Ann Emerg Med. 1985; 14 (2): 123-125.
10. Sue YJ., Woolf A., Shannon M. Efficacy of magnesium citrate cathartic in pediatric toxic ingestions // Ann Emerg Med. 1994; 24 (4): 709-712.
11. Ranade V.V., Somberg J.C. Bioavailability and pharmacokinetics of magnesium after administration of magnesium salts to humans // Am J Ther. 2001; 8 (5): 345-357.
12. Sriboonlue P., Jaipakdee S., Jirakulsomchok D., Mairiang E., To-sukhowong P., Prasongwatana V., Savok S. Changes in erythrocyte contents of potassium, sodium and magnesium and Na, K-pump activity after the administration of potassium and magnesium salts // J Med Assoc Thai. 2004; 87 (12): 1506-1512.
13. Coudray C, Rambeau M., Feillet-Coudray C., Gueux E., Tressol J.C., Mazur A., Rayssiguier Y Study of magnesium bioavailability from ten organic and inorganic Mg salts in Mg-depleted rats using a stable isotope approach //Magnes Res. 2005 Dec; 18 (4): 215-23.
14. Lindberg J.S., Zobitz M.M., Poindexter J.R., Pak C.Y Magnesium bioavailability from magnesium citrate and magnesium oxide // J Am Coll Nutr. 1990; 9 (1): 48-55.
15. Gonzalez G.B., Pak C.Y, Adams-Huet B., Taylor R., Bilhartz L.E. Effect of potassium-magnesium citrate on upper gastrointestinal mucosa // Aliment Pharmacol Ther. 1998; 12 (1): 105-110.
16. Walker A.F., Marakis G., Christie S., Byng M. Mg citrate found more bioavailable than other Mg preparations in a randomised, double-blind study // Magnes Res. 2003; 16 (3): 183-191.
17. Abdel-Halim R.E. Urolithiasis in adults. Clinical and biochemical aspects // Saudi Med J. 2005; 26 (5): 705-713.
18. Ferrari L., Meschi M., Musini S., Frattini A., Savazzi G.M. Etiopathogenesis and clinical aspects of nephrolithiasis-at present // Recenti Prog Med. 2003; 94 (3): 136-141.
19. Громова О.А., Кудрин А.В. Нейрохимия макро- и микроэлементов. Алеф-В, М., 2001; 230.
20. Kerr G.R., Lee E.S., Lam M.K., Lorimor R.J., Randall E., Forthofer R.N., Davis M.A., Magnetti S.M. Relationship between dietary and biochemical measures of nutritional status in HANES I data // Am J Clin Nutr. 1982; 35 (2): 294-307.
21. Pak C.Y Medical prevention of renal stone disease // Nephron. 1999; 81: Suppl 1: 60-65.
22. Schmiedl A., Schwille P.O., BergO B., Markovic M., Dvorak O. Reappraisal of the quantity and nature of renal calcifications and mineral metabolism in the magnesium-deficient rat. Effects of treatment with potassium citrate or the combination magnesium citrate and potassium citrate // Urol Int. 1998; 61 (2): 76-85.
23. Ogawa Y, Yamaguchi K., Morozumi M. Effects of magnesium salts in preventing experimental oxalate urolithiasis in rats / J Urol. 1990; 144: 2 Pt 1: 385-389.
24. Zerwekh J.E., Odvina C.V., Wuermser L.A., Pak C.Y Reduction of renal stone risk by potassium-magnesium citrate during 5 weeks of bed rest // J Urol. 2007; 177 (6): 2179-2184.
25. Jaipakdee S., Prasongwatana V., Premgamone A. et al. The effects of potassium and magnesium supplementations on urinary risk factors of renal stone patients // J Med Assoc Thai. 2004; 87 (3): 255-263.
26. Weiss G.H., Sluss P.M., Linke C.A. Changes in urinary magnesium, citrate, and oxalate levels due to cola consumption // Urology. 1992; 39: (4): 331-333.
27. Schwille P.O., Schmiedl A., Herrmann U., Fan J., Gottlieb D., Manoharan M., Wipplinger J. Magnesium, citrate, magnesium citrate and magnesium-alkali citrate as modulators of calcium oxalate crystallization in urine: observations in patients with recurrent idiopathic calcium urolithiasis // Urol Res. 1999; 27 (2): 117-126.
28. Ettinger B., Pak C.Y, Citron J.T., Thomas C., Adams-Huet B., Vangessel A. Potassium-magnesium citrate is an effective prophylaxis against recurrent calcium oxalate nephrolithiasis // J Urol. 1997; 158 (6): 2069-2073.
29. Громова О.А, Серов В.Н., Торшин И.Ю. Магний в акушерстве и гинекологии: история применения и современные взгляды // Трудный пациент. 2008; 8: 20-29.
30. Odvina C.V., Mason R.P., Pak C.Y Prevention of thiazide-induced hypokalemia without magnesium depletion by potassium-magnesium-citrate // Am J Ther. 2006; 13 (2): 101-108.
31. Wuermser L.A., Reilly C., Poindexter J.R., Sakhaee K., Pak C.Y Potassium-magnesium citrate versus potassium chloride in thiazide-in-duced hypokalemia // Kidney Int. 2000; 57 (2): 607-612.
32. Ruml L.A., Gonzalez G., Taylor R., Wuermser L.A., Pak C.Y Effect of varying doses of potassium-magnesium citrate on thiazide-induced hypokalemia and magnesium loss // Am J Ther. 1999; 6 (1): 45-50.
33. Pak C.Y Correction of thiazide-induced hypomagnesemia by potassium-magnesium citrate from review of prior trials // Clin Nephrol. 2000; 54 (4): 271-275.
34. Schimatschek H.F., Rempis R. Prevalence of hypomagnesemia in an unselected German population of 16,000 individuals // Magnes Res. 2001; 14 (4): 283-290.
35. Андреев А.В., Громова О.А., Федотова Л.Э., Бурцев Е.М. Влияние препарата Магне В6 на цереброваскулярную реактивность у детей с синдромом дефицита внимания в зависимости от содержания магния в организме // Клин. фармакол тер. 2000; 5: 31-34.
36. Schwille P.O., Schmiedl A., Schwille R., Brunner P., Kissler H., Cesnjevar R., Gepp H. Media calcification, low erythrocyte magnesium, altered plasma magnesium, and calcium homeostasis following grafting of the thoracic aorta to the infrarenal aorta in the rat - differential preventive effects of long-term oral magnesium supplementation alon // Biomed Pharmacother. 2003; 57 (2): 88-97.
37. Aydin B., Onol M., Hondur A., Kaya M.G., Ozdemir H., Cengel A., Hasanreisoglu B. The effect of oral magnesium therapy on visual field and ocular blood flow in normotensive glaucoma // Eur J Ophthalmol. 2010; 20 (1): 131-135.
38. Koseoglu E., Talaslioglu A., Gonul A.S., Kula M. The effects of magnesium prophylaxis in migraine without aura // Magnes Res. 2008; 21 (2): 101-108.
39. Dumont L., Mardirosoff C., Soto-Debeuf G., Tassonyi E. Magnesium and acute mountain sickness // Aviat Space Environ Med. 1999; 70 (6): 625.
40. Young G.L. Interventions for leg cramps in pregnancy //Cochrane Database Syst Rev. 2002; 1: D000121.
41. Bohus B., Hendrickx H.H., van Kolfschoten A.A., Krediet T.G. Proceedings: Effects of corticotrophin-like neuropeptides on male sexual behaviour in the rat // J Endocrinol. 1975; 64 (3): 37P.
42. Vinod J., Bonheur J., Korelitz B.I., Panagopoulos G. Choice of laxatives and colonoscopic preparation in pregnant patients from the viewpoint of obstetricians and gastroenterologists // World J Gastroenterol. 2007; 13 (48): 6549-6552.
43. Ducarme G., Davitian C., Uzan M., Belenfant X., Poncelet C. Pregnancy in a patient with Gitelman syndrome: a case report and review of literature // J Gynecol Obstet Biol Reprod (Paris). 2007; 36 (3): 310-3.
44. Aydin H., Deyneli O., Yavuz D., Gozu H., Mutlu N., Kaygusuz I., Akalin S. Short-term oral magnesium supplementation suppresses bone turnover in postmenopausal osteoporotic women // Biol Trace Elem Res. 2010; 133 (2): 136-43.
45. Roffe C., Sills S., Crome P., Jones P. Randomised, crossover, placebo controlled trial of magnesium citrate in the treatment of chronic persistent leg cramps // Med Sci Monit. 2002; 8 (5): CR326-CR330.
46. Bede O., Suranyi A., Pinter K., Szlavik M., Gyurkovits K. Urinary magnesium excretion in asthmatic children receiving magnesium supplementation: a randomized, placebo-controlled, double-blind study // Magnes Res. 2003; 16 (4): 262-270.
