 www.binnopharmgroup.ru
www.binnopharmgroup.ru

Максилак® - линейка средств для коррекции дисбактериоза и поддержания баланса микрофлоры желудочно‑кишечного тракта взрослых и детей с 3 лет в любых ситуациях ее нарушения.
Синбиотики как средство борьбы против формирующихся и зрелых биопленок патогенных микроорганизмов
СтатьиП.В.Слукин1, Е.А.Кукес2, А.Д.Фурсова1, Н.К.Фурсова1
1Государственный научный центр прикладной микробиологии и биотехнологии Роспотребнадзора, Оболенск, Российская Федерация;
2Российский национальный исследовательский медицинский университет им. Н.И.Пирогова, Москва, Российская Федерация
Цель. Оценка антибиопленочной активности синбиотического препарата «Максилак Бэби».
Материалы и методы. «Максилак Бэби» - синбиотик, в состав которого входят 9 культур пробиотических бактерий. Чистые культуры из препарата выделяли на питательных средах лактобакагар, бифидум-среда и среда Бликфельдта, идентифицировали методом MALDI-TOF и секвенированием гена 16S рРНК. Степень биопленкообразования тест-штаммов Escherichia coli (n = 5), Klebsiella pneumoniae (n = 5), Staphylococcus aureus (n = 4), Candida albicans (n = 4), Candida parapsilosis (n = 3) и Candida auris (n = 2) определяли «планшетным» методом. Активность препарата «Максилак Бэби» против формирующихся и зрелых биопленок тест-штаммов оценивали методом «купонов».
Результаты. Тест-штаммы патогенных микроорганизмов характеризовались высоким (n = 9) и средним (n = 14) уровнями биопленкообразования. Препарат «Максилак Бэби» эффективно подавлял формирующиеся биопленки большей части (83%) тест-штаммов, в том числе грамотрицательных бактерий (80%), грамположительных бактерий (75%) и грибов рода Candida (89%), а также достоверно снижал плотность зрелых биопленок 50% тест-штаммов грамположительных бактерий и 20% тест-штаммов грамотрицательных бактерий, при этом снижения плотности зрелых биопленок грибов рода Candida зафиксировано не было.
Заключение. Препарат «Максилак Бэби» может быть использован при профилактике инфекционных заболеваний, связанных с биопленками патогенных микроорганизмов.
Ключевые слова: синбиотик, «Максилак Бэби», формирующиеся биопленки, зрелые биопленки, антибиопленочная активность, патогенные микроорганизмы
Для цитирования: Слукин П.В., Кукес Е.А., Фурсова А.Д., Фурсова Н.К. Синбиотики как средство борьбы против формирующихся и зрелых биопленок патогенных микроорганизмов. Инфекционные болезни. 2022; 20(4): 69-76. DOI: 10.20953/1729-9225-2022-4-69-76
Synbiotics as a means of tackling forming and mature biofilms of pathogens
P.V.Slukin1, E.A.Kukes2, A.D.Fursova1, N.K.Fursova1
1State Research Center for Applied Microbiology and Biotechnology of Rospotrebnadzor, Obolensk, Russian Federation;
2Pirogov Russian National Research Medical University, Moscow, Russian Federation
Objective. To evaluate the anti-biofilm activity of the synbiotic “Maxilac Baby”.
Material and methods. Maxilac Baby is a synbiotic containing 9 probiotic cultures. Pure cultures were isolated from the medication on Lactobacillus agar, Bifidum, and Blickfeldt nutrient media and identified by MALDI-TOF and 16S rRNA gene sequencing. The biofilm-forming ability of the test strains of Escherichia coli (n = 5), Klebsiella pneumoniae (n = 5), Staphylococcus aureus (n = 4), Candida albicans (n = 4), Candida parapsilosis (n = 3), and Candida auris (n = 2) was determined by the “tablet” method. The activity of Maxilac Baby against forming and mature biofilms of test strains was assessed by the “coupon” method.
Results. The test strains of pathogenic microorganisms were characterized by high (n = 9) and moderate (n = 14) degree of biofilm-forming ability. Maxilac Baby effectively suppressed forming biofilms of most of the test strains (83%), including gramnegative bacteria (80%), gram-positive bacteria (75%), and Candida fungi (89%), and significantly reduced the density of mature biofilms of 50% of the test strains of gram-positive bacteria and 20% of the test strains of gram-negative bacteria, while no reduction in the density of mature biofilms of Candida fungi was recorded.
Conclusion. The synbiotic “Maxilac Baby” can be used to prevent infectious diseases associated with biofilms of pathogenic microorganisms.
Key words: synbiotic; Maxilac Baby; forming biofilms; mature biofilms; anti-biofilm activity; pathogenic microorganisms
For citation: Slukin P.V., Kukes E.A., Fursova A.D., Fursova N.K. Synbiotics as a means of tackling forming and mature biofilms of pathogens. Infekc. bolezni (Infectious Diseases). 2022; 20(4): 69-76. (In Russian). DOI: 10.20953/1729-9225-2022-4-69-76
Одним из наиболее значимых достижений микробиологии в последние 30 лет можно считать открытие и создание концепции формирования биопленок микроорганизмами [1]. Стремительно возрастающий интерес к этой проблеме можно проследить по количеству публикаций, посвященных теме биопленок. Так, например, ресурс PubMed отражает наличие более 38 тыс. публикаций по данной проблематике - от единичных работ в 1980-х гг. до нескольких тысяч к 2022 г.
Бактериальные биопленки имеют существенное значение в клинической медицине. Так, по данным CDC (Центр по контролю и профилактике заболеваний США) известно, что более 70% всех инфекционных заболеваний протекает с образованием биопленок [2]. Биопленкообразование играет важную роль при таких инфекциях, как кариес зубов, кистозный фиброз, инфекции мочевых путей, эндокардит, отит, глазные и раневые инфекции [3]. Доказано, что бактериальные клеточные патогены в составе биопленки имеют более высокую степень вирулентности в сравнении с их планктонными формами существования [4]. Кроме того, на сегодняшний день известно, что одним из механизмов устойчивости микроорганизмов к антимикробным препаратам являются их способность к биопленкообразованию. Реакция микроорганизмов на изменение условий окружающей среды в биопленке существенно отличается от реакции каждого отдельного вида в монокультуре. Такая организация обеспечивает ее физиологическую и функциональную стабильность и, следовательно, является залогом конкурентного выживания в экологической нише.
Таким образом, все больший интерес у исследователей и клиницистов стала вызывать стратегия достижения анти-биопленочной активности, в том числе путем назначения пробиотиков. Отсутствие факторов вирулентности, множественная устойчивость к антибиотикам, выживаемость в условиях желудочно-кишечного тракта, биопленкообразующая способность и антимикробная активность в отношении патогенов являются важными критериями выбора пробиотических культур. Показано, что среди пробиотических бактерий Lactobacillus spp. особенно выделяются своей способностью положительно влиять на здоровье организма-хозяина благодаря наличию перечисленных механизмов [5]. Методами синтетической биологии создаются инженерные пробиотические штаммы с улучшенной способностью конкурировать с определенными патогенами или целенаправленно убивать их за счет изменения их метаболизма, нацеленного на модулирование иммунного ответа хозяина и улучшение распознавания патогенов. Основные направления создания таких пробиотических штаммов: 1) повышение уровня секреции короткоцепочечных жирных кислот и других малых молекул, усиливающее эпителиальную барьерную функцию;
2. повышение секреции антимикробных пептидов и других малых молекул, подавляющих патогенные бактерии; 3) модуляция воспалительных реакций макроорганизма за счет воздействия на дендритные клетки и Т-клетки для улучшения иммунной функции и подавления секреции воспалительных цитокинов; 4) конкуренция с патогенами за пространство и питательные вещества, ограничивающая их пролиферацию в кишечной среде; 5) подавление адгезии патогенов и колонизации стенок кишечника с целью уменьшения воспалительных реакций; 6) нейтрализация токсинов, выделяемых патогенами для блокирования их вирулентности. Примечательно, что перечисленные направления не исключают друг друга, поскольку штаммы могут быть сконструированы таким образом, чтобы включать более одной из этих функций [6].
Таким образом, научное использование пробиотиков, пребиотиков и синбиотиков может быть безопасной и альтернативной стратегией против микробных инфекций, особенно в текущей и постпандемической ситуации. Следовательно, существует потребность в обновлении знаний в этой области для изучения будущих возможностей применения пробиотиков при заболеваниях человека. Современные методы, основанные на молекулярной биологии, генной инженерии, системной биологии, мультиомике, нанотехнологиях и иммунологии, должны использоваться для полного понимания структуры и функции микробиома в отношении пробиотиков и пребиотиков. Эти исследования помогут понять взаимодействие между функциями человеческого организма и микробиомом.
Механизм терапевтической эффективности пробиотических препаратов против инфекций, связанных с биопленками патогенных микроорганизмов, основан на предотвращении первичной адгезии бактерий к биотическим поверхностям, блокировании синтеза или разрушении полимерного матрикса, нарушении межклеточного обмена информацией, то есть на подавлении формирования и созревания биопленок [7, 8].
Целью данного исследования была оценка антибиопленочной активности синбиотического препарата «Максилак Бэби».
Материал и методы
Препарат «Максилак Бэби» (Производитель: Labomar S.p.A, Via N Sauro, 35/1-31036 Istrana (TV), Италия. Свидетельство о государственной регистрации №АМ.01.07.01.003.К.000079. 09.19 от 05.09.2019) - синбиотик, в состав которого входят 9 культур пробиотических бактерий в концентрации 1 х 109 колониеобразующих единиц (КОЕ). Общая численность бактерий в 1 пакетике «Максилак Бэби» составляет 1 х 109 КОЕ (табл. 1).
Таблица 1.
Состав саше препарата «Максилак Бэби»
Table 1.
Composition of Maxilac Baby sachet
| «Максилак Бэби» (саше) >1 х 109 КОЕ / Maxilac Baby (sachet) >1 х 109 CFU | |
| Lactobacillus acidophilus LA-14 | 1,1 х 108 КОЕ / CFU |
| Lactobacillus casei LC-11 | 1,1 х 108 КОЕ / CFU |
| Lactobacillus paracasei Lpc-37 | 1,1 х 108 КОЕ / CFU |
| Lactobacillus plantarum Lp-115 | 1,1 х 108 КОЕ / CFU |
| Lactobacillus rhamnosus GG | 1,1 х 108 КОЕ / CFU |
| Lactobacillus salivarius Ls-33 | 1,1 х 108 КОЕ / CFU |
| Всего / Total | 0,7 х 109 КОЕ / CFU |
| Bifidobacterium lactis BI-04 | 1,1 х 108 КОЕ / CFU |
| Bifidobacterium bifidum Bb-02/Lactis | 1,1 х 108 КОЕ / CFU |
| Bifidobacterium longum BI-05 | 1,1 х 108 КОЕ / CFU |
| Всего / Total | 0,3 х 109 КОЕ / CFU |
| Пробиотический компонент / Probiotic component Фруктоолигосахариды / Fructooligosaccharides |
0,5 г / g |
| Вспомогательные компоненты / Excipients: | |
| Мальтодекстрин (наполнитель) / Maltodextrin (filler) | 0,85 г / g |
| Диоксид кремния (разрыхлитель) / Silicon dioxide (leavening agent) | 0,1 г / g |
Тест-штаммы патогенных микроорганизмов. В качестве тест-штаммов использованы 9 референс-штаммов из международных коллекций: Escherichia coli ATCC25922 (B-2393) и ATCC35218 (B-7470), Klebsiella pneumoniae ATCC700603 (B-7474), Staphylococcus aureus ATCC25923 (B-5931) и ATCC6538p (B-4471), Candida albicans ATCC90028 (F-2033) и ATCC10231 (B-7617), Candida parapsilosis ATCC90018 (F-2036) и Candida auris CBS344 (F-2035); а также 15 клинических штаммов из лабораторной коллекции лаборатории антимикробных препаратов ГНЦ ПМБ: E. coli U17 (В-8972), U48 (В-8769) и U80 В-8959, K. pneumoniae B-2523/18 (B-9220), B-102/19 (B-9137), B-14/19 (B-9136) и B-86/18, S. aureus B-7772 (CC8), B-8470 (CC15) и B-7778 (CC30), C. albicans C24796/21 и B-2528/20 (F-2042), C. parapsilosis C2747/21 (F-2051) и C482/16 (F-2052) и C. auris B-48/20 (F-2040). Культуры микроорганизмов выращивали на соответствующих селективных питательных средах: среде Эндо (E. coli), лактозном ТТХ-агаре с тергитолом 7 (K. pneumoniae), стафилококк-агаре (S. aureus) и среде Сабуро с 200 мг/л хлорамфеникола (Candida spp.) (ФБУН ГНЦ ПМБ, Оболенск, Россия).
Определение степени биопленкообразования тест-штаммов. Уровень биопленкообразования тест-штаммов микроорганизмов определяли согласно стандартному протоколу [9]. Микроорганизмы культивировали в 96-луночном планшете в соответствующих питательных средах в течение 24 ч при температуре 37°С, отмывали от питательной среды дистиллированной водой, окрашивали 0,1%-м водным раствором кристаллвиолета, повторно отмывали дистиллированной водой, экстрагировали 30%-й уксусной кислотой адсорбированный клетками кристаллвиолет, измеряли показатель оптической плотности раствора (OD) на планшетном фотометре Multiskan FC (Thermo Scientific, США) при длине волны 595 нм. Степень биопленкообразования тест-штаммов оценивали относительно контрольных лунок планшета без культуры микроорганизма по критериям Rodrigues et al., 2010 [9]: отсутствие биопленки при ODT ≤ ODK, слабое биопленкообразование при ODK < ODt ≤ 2xODk; средняя степень биопленкообразования при 2xODk < ODt ≤ 4xODk; сильно выраженное биопленкообразование при 4xODk < ODt, где ODt - оптическая плотность тестируемого образца, ODK -оптическая плотность контрольного образца.
Оценка антибиопленочной активности препарата «Максилак Бэби» против формирующихся биопленок тест-штаммов. Одно саше препарата «Максилак Бэби» суспендировали в 10 мл физиологического раствора (ФР), полную петлю ночной культуры тест-штамма - в 0,5 мл ФР. В жидкую питательную среду Бликфельдта (4 мл) в пробирке типа Фалькон (50 мл) помещали 2 стерильных купона из промышленного полипропилена (300 мм2) и вносили 1 мл суспензии препарата «Максилак Бэби» и 0,1 мл суспензии тест-штамма. В контрольную пробирку вносили 1 мл ФР и 0,1 мл суспензии тест-штамма. Пробирки закрывали пленкой Parafilm, аккуратно перемешивали и инкубировали в атмосфере 5% CO2 при температуре 37°С в течение 72 ч. Затем купоны трижды промывали в 10 мл стерильной воды, дезинтегрировали биопленку в 5 мл стерильного ФР ультразвуком на гомогенизаторе Soniprep 150 (MSE Ltd, Великобритания) при амплитуде 4 х 10-6 м в течение 2 мин. Бактериальную суспензию титровали и высевали на чашки Петри с соответствующей для тест-штамма питательной средой. Посевы инкубировали при температуре 37°С в течение 24 ч, подсчитывали колонии и определяли число КОЕ тест-штамма. Антибиопленочную активность препарата «Максилак Бэби» на формирующуюся биопленку тест-штамма определяли как статистически достоверное снижение показателя КОЕ относительно числа КОЕ тест-штамма в контроле.
Оценка антибиопленочной активности препарата «Максилак Бэби» против зрелых биопленок тест-штаммов. Полную петлю ночной культуры тест-штамма суспендировали в 0,5 мл ФР, вносили 0,1 мл суспензии в 5 мл соответствующей жидкой питательной среды для тест-штамма, вносили 4 стерильных купона (300 мм2) из промышленного полипропилена, инкубировали при температуре 37°С в течение 72 ч с аэрацией при скорости вращения 150 об./мин на шейкере Unimax 1010 (Heidolph Instruments, Германия). Затем купоны извлекали, трижды промывали в 10 мл стерильной воды и переносили по 2 купона в две пробирки типа Фалькон (50 мл) с 4 мл жидкой питательной среды Бликфельдта. В одну из пробирок вносили 1 мл суспензии препарата «Максилак Бэби», приготовленной как описано выше, а во вторую - равное количество ФР. Пробирки закрывали пленкой Parafilm, аккуратно перемешивали и инкубировали в атмосфере 5% CO2 при температуре 37°С в течение 72 ч. Затем купоны извлекали, трижды промывали в 10 мл стерильной воды и дезинтегрировали биопленку в 5 мл стерильного ФР ультразвуком на гомогенизаторе Soniprep 150 (MSE Ltd, Великобритания) при амплитуде 4 х 10-6 м в течение 2 мин. Суспензию титровали и высевали на чашки Петри с селективными средами для соответствующих тест-штаммов, выращивали при температуре 37°С в течение 24 ч и подсчитывали показатель КОЕ. Антибиопленочную активность препарата «Максилак Бэби» на зрелую биопленку тест-штамма определяли как статистически достоверное снижение показателя КОЕ относительно числа КОЕ тест-штамма в контроле.
Выделение и культивирование чистых культур пробиотических штаммов из консорциума препарата «Максилак Бэби» осуществляли на плотных питательных средах лактобакагар и бифидум-среда (ФБУН ГНЦ ПМБ, Оболенск, Россия) и жидкой питательной среде Бликфельдта [10]. Для определения количество клеток бифидобактерий и лактобактерий в 1 саше препарата «Максилак Бэби» растворяли содержимое 1 саше в 10 мл ФР, готовили 10-кратные разведения, высевали по 0,1 мл из каждого разведения на плотные питательные среды и выращивали при температуре 37°С в анаэростате в атмосфере 5% CO2 в течение 24 ч. Чистые культуры хранили в 20%-м растворе глицерина в ФР при температуре -72°С.
Видовую идентификацию бактерий осуществляли на приборе MALDI-TOF Biotyper (Bruker, Карлсруэ, Германия), а также методом секвенирования гена 16S рРНК, в качестве матрицы ДНК использовали термолизаты ночных бактериальных культур и специфичные праймеры Modern 16s For (5’ agagtttgatcctggctcag-3’) и Modern 16s Rev (5’ acggctaccttgttacgact-3’) [11]. Секвенирование ДНК осуществляли в НПО «Синтол» (Москва, Россия), анализировали с помощью программ Vector NTI9 (Life Technologies, США) и Chromas 2.6.2. (Technelysium Pty Ltd, Брисбен, Австралия). Идентификацию генов 16S-субъединицы рибосомы проводили с помощью веб-ресурса BLAST (http://blast.ncbi.nlm.nih.gov/Blast.cgi) на основании сравнения с референсными последовательностями: Bifidobacterium bifidum ATCC 29521 (M84777.1), Bifidobacterium longum ATCC 1570 (M84781.1), Lactobacillus acidophilus JCM1132 (LC064893.1), Lactobacillus casei (D86518.1), Lactobacillus paracasei Z2 (MT682913.1), Lactobacillus plantarum FY1 (KY038178.1), Lactobacillus rhamnosus DSM20021 (M58815.1), Lactobacillus salivarius NCIMB8817 (DQ901735.1).
Статистическую обработку данных проводили с использованием программы Microsoft Office методом t-теста Стьюдента, значимым считали различия при p < 0,05.
Результаты исследования и обсуждение
Оценка способности тест-штаммов микроорганизмов к биопленкообразованию
Показано, что все использованные в работе тест-штаммы микроорганизмов обладали способностью к биопленкообразованию на модели 96-луночных планшетов (табл. 2).
Таблица 2.
Степень биопленкообразования тест-штаммов, использованных в исследовании
Table 2.
Degree of biofilm-forming ability of the test strains used in the study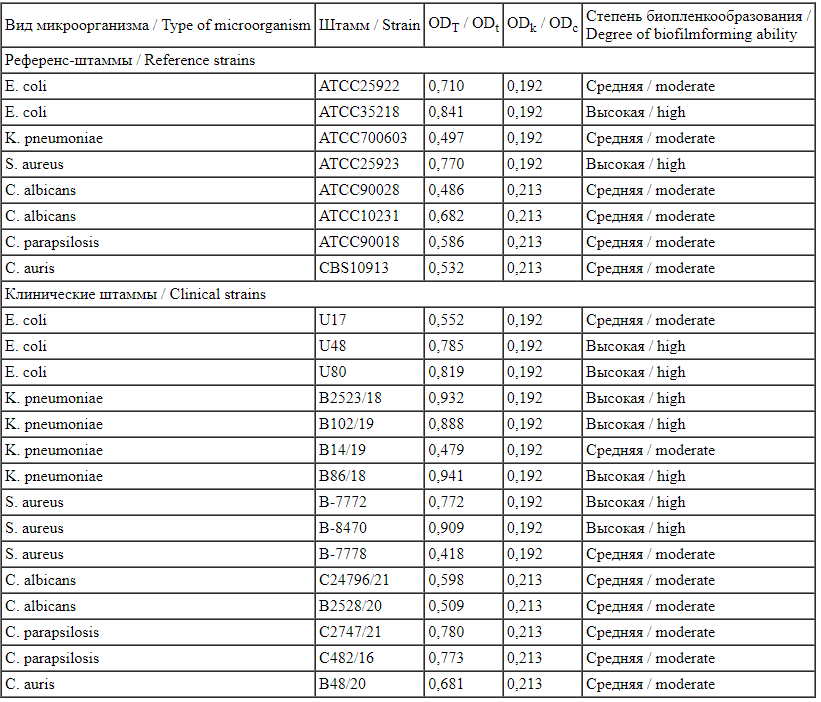 ODT - оптическая плотность тестируемого образца; ODK - оптическая плотность контрольного образца; высокая степень биопленкообразования -при 4xODK<ODT где ODT; средняя степень биопленкообразования - при 2xODK<ODT≤4xODK
ODT - оптическая плотность тестируемого образца; ODK - оптическая плотность контрольного образца; высокая степень биопленкообразования -при 4xODK<ODT где ODT; средняя степень биопленкообразования - при 2xODK<ODT≤4xODK
ODt - optical density of the test sample; ODc - optical density of the control sample; high degree of biofilm-forming ability at 4xODc<ODt, where ODt ?; moderate degree of biofilm-forming ability at 2xODc<ODt<4xODc
Высокая степень биопленкообразования отмечена для 9 штаммов: одного референс-штамма E. coli и одного референс-штамма S. aureus, а также для трех клинических штаммов K. pneumoniae, двух клинических штаммов E. coli и двух клинических штаммов S. aureus. Для остальных тест-штаммов степень биопленкообразования зафиксирована на среднем уровне.
Ингибирующая активность препарата «Максилак Бэби» против формирующихся биопленок микроорганизмов
Оценка влияния препарата «Максилак Бэби» на формирование биопленок патогенных микроорганизмов показала, что 19 (83%) штаммов из 23 достоверно снижали плотность биопленок под воздействием препарата «Максилак Бэби».
Наиболее ярко выраженный эффект, снижение плотности формирующейся биопленки на 2-3 порядка, зафиксирован для 6 тест-штаммов: E. coli ATCC25922, K. pneumoniae ATCC700603, S. aureus B-7772 K. pneumoniae B-102/19, S. aureus ATCC25923 и C. albicans ATCC90028. Для 13 штаммов отмечено снижение плотности формирующейся биопленки на 1 порядок, а для 4 тест-штаммов (E. coli U80, K. pneumoniae B-86/18, S. aureus B-8470 и C. albicans B2528/20) снижение плотности формирующейся биопленки не отмечено (рис. 1-3).
 Рис. 1. Изменение плотности формирующихся биопленок штаммов грамотрицательных бактерий при воздействии препарата «Максилак Бэби» (белый цвет), контроль - черный цвет.
Рис. 1. Изменение плотности формирующихся биопленок штаммов грамотрицательных бактерий при воздействии препарата «Максилак Бэби» (белый цвет), контроль - черный цвет.
Fig. 1. Change in the density of forming biofilms of gram-negative bacterial strains when exposed to Maxilac Baby (white color); black color is control.
 Рис. 2. Изменение плотности формирующихся биопленок штаммов грамположительных бактерий при воздействии препарата «Максилак Бэби» (белый цвет), контроль - черный цвет.
Рис. 2. Изменение плотности формирующихся биопленок штаммов грамположительных бактерий при воздействии препарата «Максилак Бэби» (белый цвет), контроль - черный цвет.
Fig. 2. Change in the density of forming biofilms of gram-positive bacterial strains when exposed to Maxilac Baby (white color); black color is control.
 Рис. 3. Изменение плотности формирующихся биопленок штаммов дрожжеподобных грибов Candida spp. при воздействии препарата «Максилак Бэби» (белый цвет), контроль - черный цвет.
Рис. 3. Изменение плотности формирующихся биопленок штаммов дрожжеподобных грибов Candida spp. при воздействии препарата «Максилак Бэби» (белый цвет), контроль - черный цвет.
Fig. 3. Change in the density of forming biofilms of Candida spp. yeast-like fungal strains when exposed to Maxilac Baby (white color); black color is control.
Таким образом, формирование биопленок большей части (83%) тест-штаммов, в том числе грамотрицательных бактерий (80%), грамположительных бактерий (75%) и грибов рода Candida (89%) эффективно подавлялось при совместном культивировании с пробиотическим консорциумом препарата «Максилак Бэби».
Влияние препарата «Максилак Бэби» на зрелые биопленки микроорганизмов
Оценка влияния препарата «Максилак Бэби» на зрелые биопленки показала, что плотность зрелых биопленок после воздействия препарата «Максилак Бэби» достоверно снижалась для 4 штаммов: двух штаммов грамположительных бактерий (S. aureus ATCC25923 и B-7778) и двух штаммов грамотрицательных бактерий (E. coli U17 и K. pneumoniae B-2523/18) (табл. 3).
Таблица 3.
Плотность зрелых биопленок тест-штаммов на полипропиленовых купонах в контроле и после воздействия препарата «Максилак Бэби»
Table 3.
Density of mature biofilms of test strains on polypropylene coupons in control and after exposure to Maxilac Baby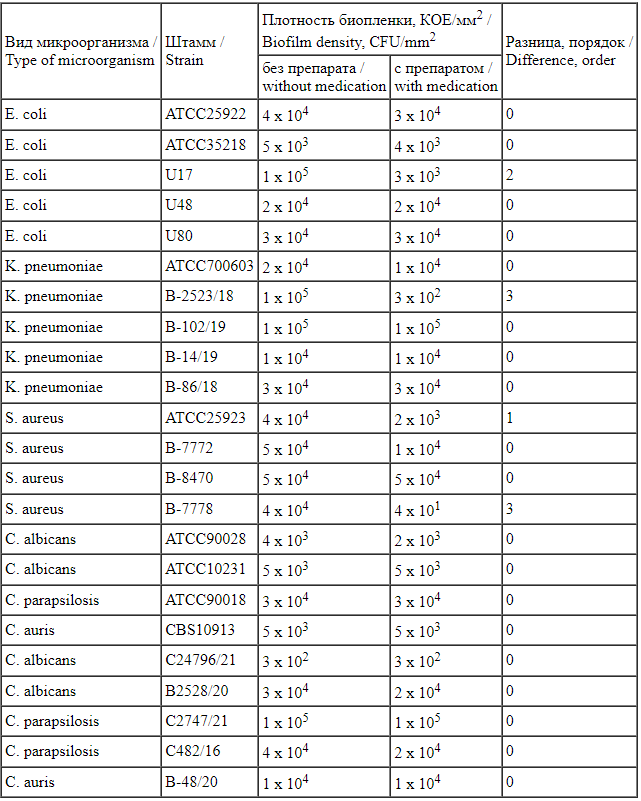 Жирным шрифтом выделена статистически достоверная разница (р ≤ 0,05).
Жирным шрифтом выделена статистически достоверная разница (р ≤ 0,05).
Statistically significant difference is marked in bold type (p ≤ 0.05).
Таким образом, препарат «Максилак Бэби» достоверно снижал плотность зрелых биопленок 50% тест-штаммов грамположительных бактерий и 20% тест-штаммов грам-отрицательных бактерий, при этом снижения плотности зрелых биопленок грибов рода Candida не зафиксировано.
Выделение чистых культур из препарата «Максилак Бэби»
В ходе исследования из препарата «Максилак Бэби» изолировано 48 чистых бактериальных культур: 33 культуры на плотной питательной среде лактобакагар и 15 культур на плотной питательной среде бифидум-среда. Идентификация культур на приборе MALDI-TOF Biotyper позволила определить 5 видов Lactobacillus spp., в том числе L. paracasei (n = 17), L. plantarum (n = 14), L. casei (n = 4), L. rhamnosus (n = 4), L. acidophilus (n = 1), 7 культур не идентифицировано. Анализ последовательностей гена рРНК 16S позволил идентифицировать 7 культур, изолированных с питательной среды лактобакагар: L. paracasei (n = 2), L. casei (n = 2), L. rhamnosus (n = 2), L. acidophilus (n = 1) и 3 культуры, изолированных с бифидум-среды: B. longum (n = 2) и B. bifidum (n = 1). Таким образом, всего идентифицировано 6 штаммов Lactobacillus spp. и 3 штамма Bifidobacterium spp. (табл. 4), что соответствует заявленному компонентному составу.
Таблица 4.
Бактериальные изоляты, изолированные из препарата «Максилак Бэби»
Table 4.
Bacterial isolates from Maxilac Baby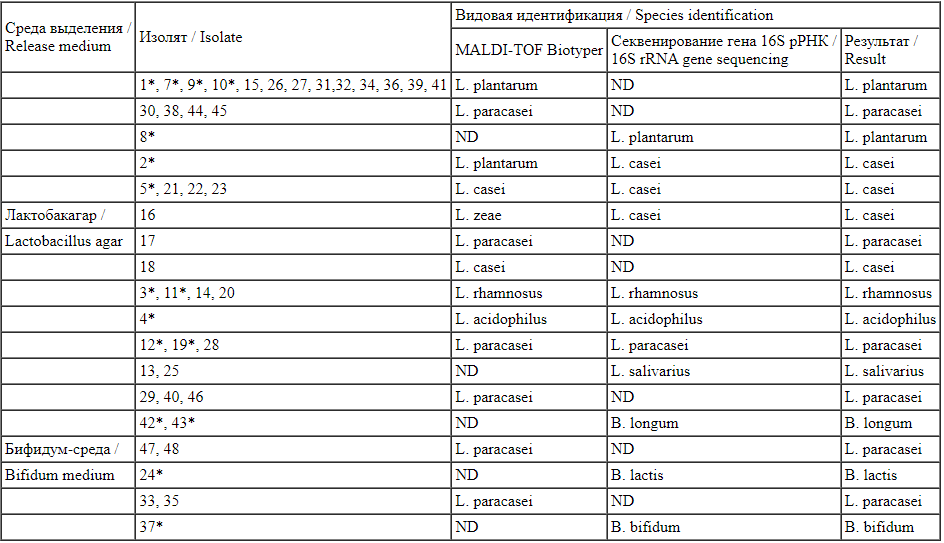 *изоляты идентифицированы с помощью секвенирования генов 16S рРНК; ND - нет данных.
*изоляты идентифицированы с помощью секвенирования генов 16S рРНК; ND - нет данных.
*isolates identified by 16S rRNA gene sequencing; ND - no data.
Контроль численности КОЕ пробиотических микроорганизмов в препарате «Максилак Бэби» показал, что при высеве на среду лактобакагар она составила 0,3 х 109 КОЕ/ саше, а при высеве на бифидум-среду - 0,7 х 109 КОЕ/саше (рис. 4), что соответствует заявленному в препарате количеству бактерий - 1 х 109 КОЕ/саше.
 Рис. 4. Фото чашек Петри с колониями бактерий, изолированными из препарата «Максилак Бэби»: A - «Бифидум-среда»; B -«Лактобакагар».
Рис. 4. Фото чашек Петри с колониями бактерий, изолированными из препарата «Максилак Бэби»: A - «Бифидум-среда»; B -«Лактобакагар».
Fig. 4. Photo of Petri dishes with bacterial colonies isolated from Maxilac Baby: A - Bifidum medium; B - Lactobacillus agar.
Заключение
В ходе исследования изучена in vitro способность синбиотического препарата «Максилак Бэби» подавлять формирование биопленок клинически значимых микроорганизмов - патогенных грамотрицательных и грамположительных бактерий, а также дрожжеподобных грибов рода Candida. Консорциум пробиотических штаммов препарата «Максилак Бэби» эффективно подавлял формирование биопленок большинства (83%) тест-штаммов, а также значительной части зрелых биопленок грамположительных бактерий - стафилококков (50%) и грамотрицательных бактерий - E. coli и K. pneumoniae (20%). Полученные данные указывают на возможность успешного использования препарата «Максилак Бэби» при профилактике инфекционных заболеваний, связанных с биопленками патогенных микроорганизмов. Это согласуется с результатами исследования Barzegari et al. (2020), в котором было продемонстрировано преимущество использования пробиотиков и их производных, по сравнению с антибиотиками, против биопленок метициллин-резистентных S. aureus, поскольку такая терапия не приводила к элиминации нормальной микрофлоры [12]. Можно предположить, что при использовании синбиотика «Максилак Бэби» может быть достигнуто повышение эффективности антимикробной терапии инфекций, вызванных патогенными микроорганизмами, за счет подавления формирования их биопленок. Возможность применения пробиотических штаммов в качестве дополнения к терапии антибиотиками высказывалась ранее, на основании их свойств, связанных с уменьшением побочных эффектов, улучшением функции антибиотиков и усилением мукозального иммунитета [13].
Показано, что видовой состав выделенных из препарата «Максилак Бэби» чистых культур и концентрация жизнеспособных бактерий (1 х 109 КОЕ/саше) соответствуют заявленному в инструкции по применению препарата. В дальнейшей работе планируется изучить вклад отдельных штаммов лактобацилл и бифидобактерий в противобиопленочную активность препарата «Максилак Бэби».
Информация о соавторах:
Слукин Павел Владимирович, научный сотрудник лаборатории антимикробных препаратов Государственного научного центра прикладной микробиологии и биотехнологии Роспотребнадзора
Кукес Евгения Александровна, аспирант кафедры госпитальной педиатрии им. акад. В.А.Таболина Российского национального исследовательского медицинского университета им. Н.И.Пирогова
Фурсова Анастасия Дмитриевна, младший научный сотрудник лаборатории антимикробных препаратов Государственного научного центра прикладной микробиологии и биотехнологии Роспотребнадзора
Information about co-authors:
Pavel V. Slukin, Researcher, Laboratory of Antimicrobial Preparations, State Research Center for Applied Microbiology and Biotechnology of Rospotrebnadzor
Evgenia A. Kukes, Postgraduate Student, Department of Hospital Pediatrics, named after acad. V.A.Tabolin, Pirogov Russian National Research Medical University
Anastasia D. Fursova, Junior Researcher, Laboratory of Antimicrobial Preparations, State Research Center for Applied Microbiology and Biotechnology of Rospotrebnadzor
Литература / References
1. Characklis WG, Cooksey KE. Biofilms and microbial fouling. Advances in Applied Microbiology 1983;29:93-138.
2. Тец ВВ, Тец ГВ. Микробные биоплёнки и проблемы антибиотикотерапии. Атмосфера. Пульмонология и аллергология. 2013;4:60-64. / Tets VV, Tets GV. Mikrobnye bioplenki i problemy antibiotikoterapii. Atmosfera. Pul'monologiya i Allergologiya. 2013;4:60-64. (In Russian).
3. Hancock V, Ferrieres L, Klemm P. Biofilm formation by asymptomatic and virulent urinary tract infectious Escherichia coli strains. FEMS Microbiol Lett. 2007 Feb;267(1):30-7.
4. Wang G, Zhao G, Chao X, Xie L, Wang H. The Characteristic of Virulence, Biofilm and Antibiotic Resistance of Klebsiella pneumoniae. Int J Environ Res Public Health. 2020 Aug 28;17(17):6278.
5. Das S, Vishakha K, Banerjee S, Bera T, Mondal S, Ganguli A. A novel probiotic strain of Lactobacillus fermentum TIU19 isolated from Haria beer showing both in vitro antibacterial and antibiofilm properties upon two multi resistant uropathogen strains. Curr Res Microb Sci. 2022 Jun 24;3:100150.
6. Cruz KCP, Enekegho LO, Stuart DT. Bioengineered Probiotics: Synthetic Biology Can Provide Live Cell Therapeutics for the Treatment of Foodborne Diseases. Front Bioeng Biotechnol. 2022 May 17;10:890479.
7. Barzegari A, Kheyrolahzadeh K, Hosseiniyan Khatibi SM, Sharifi S, Memar MY, Zununi Vahed S. The Battle of Probiotics and Their Derivatives Against Biofilms. Infect Drug Resist. 2020 Feb 26;13:659-672.
8. Carvalho FM, Teixeira-Santos R, Mergulhao FJM, Gomes LC. The Use of Probiotics to Fight Biofilms in Medical Devices: A Systematic Review and Meta-Analysis. Microorganisms. 2020 Dec 23;9(1):27.
9. Rodrigues LB, Dos Santos LR, Tagliari VZ, Rizzo NN, Trenhago G, de Oliveira AP, et al. Quantification of biofilm production on polystyrene by Listeria, Escherichia coli and Staphylococcus aureus isolated from a poultry slaughterhouse. Braz J Microbiol. 2010 Oct;41(4):1082-5.
10. ГОСТ 10444.11-2013. (ISO 15214:1998). Межгосударственный стандарт. Микробиология пищевых продуктов и кормов для животных. Методы выявления и подсчета количества мезофильных молочнокислых микроорганизмов. / GOST 10444.11-2013. (ISO 15214:1998). Mezhgosudarstvennyi standart. Mikrobiologiya pishchevykh produktov i kormov dlya zhivotnykh. Metody vyyavleniya i podscheta kolichestva mezofil'nykh molochnokislykh mikro-organizmov. (In Russian).
11. Essam T, Amin MA, El Tayeb O, Mattiasson B, Guieysse B. Kinetics and metabolic versatility of highly tolerant phenol degrading Alcaligenes strain TW1. J Hazard Mater. 2010 Jan 15;173(1-3):783-8.
12. Barzegari A, Kheyrolahzadeh K, Hosseiniyan Khatibi SM, Sharifi S, Memar MY, Zununi Vahed S. The Battle of Probiotics and Their Derivatives Against Biofilms. Infect Drug Resist. 2020 Feb 26;13:659-672.
13. Jalalifar S, Mirzaei R, Motallebirad T, Razavi S, Talebi M. The Emerging Role of Probiotics and their Derivatives against Biofilm-Producing MRSA: A Scoping Review. Biomed Res Int. 2022 Dec 27;2022:4959487.
