Анализ эффективности нефропротекции с применением малобелковой диеты и кетоаналогов аминокислот у пациентов с хронической болезнью почек
СтатьиОпубликовано в журнале, Кардиология (Kardiologiia), 2015;55:9 О.Н. Сигитова, Е.В. Архипов, Т.Ю. Ким
ГБО ВПО Казанский государственный медицинский университет Минздрава России, Казань, Россия
Цель. Анализ эффективности нефропротекции у пациентов с хронической болезнью почек (ХБП), находившихся под наблюдением участковых врачей (до 72,1 мес), соблюдавших традиционную малобелковую диету (МБД) или МБД в сочетании с назначением препаратов кетоаналогов аминокислот (КА/АК). Материалы и методы. 63 больных ХБП III-IV стадии, обусловленной в основном гломерулонефритами, распределены в 3 группы: 1-я группа - 31 пациент (53,3 + 3,1 года, М/Ж - 18/13), соблюдавший МБД в комбинации с КА/АК, 2-я группа - 22 пациента (54,9 + 3,2 года; М/Ж - 13/9), получавших МБД без КА/АК, 3-я группа - 10 пациентов (51,7 + 4,2 года; М/Ж - 6/4) с естественным течением ХБП, 4-я группа (контроля) - 30 здоровых лиц (52,3 + 2,2 года; М/Ж - 16/14). Изучены в динамике скорость клубочковой фильтрации, показатели систолического артериального давления (САД), диастолического артериального давления (ДАД), уровни гемоглобина (Hb), суточная протеинурия, основные показатели белкового, липидного, форфорно-кальциевого метаболизма. Результаты. Темпы снижения СКФ в 1-й группе (-0,78 мл/мин/год) были значительно ниже, чем во 2-й (-4,9 мл/мин/год). В конце периода наблюдения начало заместительной почечной терапии потребовалось 9,7% пациентов из 1-й группы, 18,1% из 2-й и 40% из 3-й группы. Проведение нефропротекции на фоне МБД и приема КА/АК позволило у всех пациентов 1-й группы достичь целевого уровня АД (< 140/90 мм рт.ст.), уменьшить протеинурию, улучшить показатели метаболизма липидов, предупредить снижение уровня Hb и нарушения белкового и фосфорно-кальциевого обменов. При проведении нефропротекции во 2-й группе на фоне стандартной МБД без приема кетоаналогов аминокислот САД несколько снизилось, ДАД не изменилось, снижение суточной протеинурии было менее значимым, чем в 1-й группе; отсутствовала отрицательная динамика показателей белкового и фосфорно-кальциевого обменов, незначительно повысились уровни общего ХС и ЛВП. В 3-й группе пациентов, не соблюдавших рекомендации по нефропротекции, выявлена отрицательная динамика всех изучаемых показателей. Заключение. Нефропротекция на фоне МБД с назначением КА/АК у пациентов с ХБП III-IV стадии является более эффективной, чем стандартная МБД, в плане замедления темпов снижения СКФ, коррекции АГ, снижения протеинурии, сохранения уровня Hb, профилактики нарушений белкового и фосфорно-кальциевого метаболизма, коррекции нарушений липидного обмена.
Ключевые слова: хроническая болезнь почек, нефропротекция, малобелковая диета, кетоаналоги аминокислот.
Analysis of the Effectiveness of Renoprotection of Low-Protein Diet and Ketoanalogues of Amino Acids In Patients With Chronic Kidney Disease
O.N. Sigitova, E.V. Arkhipov, T.Y. Kim
Kazan state medical university, Kazan, Russia
Aim. Analysis of the effectiveness of renoprotection in patients with chronic kidney disease (CKD), who is observed by general practitioners for up to 72.1 months, keeping traditional LPD or LPD with prescription of ketoanalogues of amino acids (KA/АК). Methods. 63 patients with CKD stages 3—4, mainly with glomerulonephritis (GN), were divided into 3 groups: 1 gr — 31 patients (53.3 + 3.1 years old; M/F — 18/13), LPD with prescription of ketoanalogues of amino acids; 2 gr — 22 patients (54.9 + 3.2 years old; M/F — 13/9) traditional LPD without ketoanalogues; 3 gr — 10 patients (51.7 + 4.2 years old; M/F — 6/4) with natural course of CKD. Group 4 (control) — 30 healthy subjects (52.3 + 2.2 years old; M/F — 16/14). The following parameters were studied: dynamics of the glomerular filtration rate (GFR), systolic blood pressure (SBP), diastolic blood pressure (DBP), hemoglobin levels (Hb), daily proteinuria, and basic parameters of protein, lipid and phosphate-calcium metabolism. Results. The rate of decline in GFR was significantly lower in patients of the first group (-0.78 mL/min/year) than those of the second group (-4.9 ml/min /year). 9.7% of patients of the first group needed the start of renal replacement therapy at the end of the observation, 18.1% - of the second group and 40% — of the third. All patients who received renoprotective therapy, including low-protein diet with KA/AA reached target levels of blood pressure < 140/90 mm Hg. Patients of this group was able to achieve a significant reduction in proteinuria, improvement of lipid metabolism, prevent of reduction of Hb and the development of metabolic disorders of protein and calcium-phosphate metabolism. The second group of patients, following nephroprotection recommendations and LPD without KA/AA, had fewer reductions in SBP without reaching the target level, DBP did not change; reduction of proteinuria was less significant than in group 1. There was no negative dynamics of protein and calcium-phosphate metabolism, though significantly increased levels of total cholesterol and LHD were observed. The third group of patients, who did not follow the renoprotection recommendations demonstrated negative dynamics of the studied parameters. Conclusion. Renoprotection based on the use KA/AA in patients with CKD stages 3—4 proved to be more effective than without it in slowing the rate of decline in GFR, hypertension correction, proteinuria reduction, maintaining the level of Hb, prevention of disorders of protein and calcium-phosphate metabolism, as well as correction of the lipid metabolism.
Key words: chronic kidney diseas; renoprotection; low-protein diet (LPD; ketoanalogues of amino acids.
Хроническая болезнь почек (ХБП) во всем мире, в том числе в России, приобретает все большую медицинскую и экономическую значимость. Распространенность ХБП сопоставима с такими социально значимыми заболеваниями, как гипертоническая болезнь и сахарный диабет (СД). Практически у каждого 10-го человека в общей популяции отмечается снижение скорости клубочковой фильтрации (СКФ) [1]. В России только у лиц молодого возраста в 16% случаев выявляется снижение СКФ, при этом ежегодный прирост числа больных, получающих заместительную почечную терапию (ЗПТ), составляет 10,5%, а средний возраст таких больных — 47—50 лет, т.е., страдает молодое трудоспособное население [2].
Доказана связь сниженной расчетной скорости клубочковой фильтрации (рСКФ) с общей и сердечно-сосудистой смертностью, прогрессированием ХБП и риском развития острого повреждения почек [3—5].
Принципы консервативной кардионефропротективной терапии, имеющей решающее значение в торможении прогрессирования дисфункции почек и сердца с точки зрения отдаления неблагоприятного исхода в виде терминальной почечной недостаточности и снижения риска развития сердечно-сосудистых осложнений (ССО), разработаны и изложены в национальных и международных рекомендациях по ХБП [6—9]. В основе стратегии кардионефропротекции у пациентов с ХБП положены контроль артериальной гипертонии (АГ) [10], профилактика ССО [11, 12], коррекция нарушений липидного обмена [13—15].
Ограничение употребления поваренной соли замедляет прогрессирование ХБП [16], а ограничение белка у пациентов с поражением почек и протеинурией, по данным субисследования А MDRD (Modification of Diet in Renal Disease) [17, 18], способствует замедлению снижения СКФ и удлинению додиализного периода у пациентов с ХБП, особенно с исходно сниженной функцией почек, соответствующей Ша стадии и последующим уровням снижения СКФ по градации KDIGO (2012) [8]. На III стадии ХБП рекомендовано снижение потребления белка до 0,8 г/кг/сут и на IV стадии — от 0,6 до 0,3 г/кг/сут с назначением препаратов незаменимых аминокислот и их кетоаналогов с целью профилактики белково-энергетической недостаточности [18, 19].
В последние годы появляются убедительные данные в пользу сочетанного применения малобелковой диеты (МБД) и кетоаналогов незаменимых аминокислот у больных ХБП на додиализных стадиях, позволяющего не только удлинить додиализный период и предупреждать белково-энергетическую недостаточность, но и достигать лучшего контроля АГ, индекса массы тела; нарушений кислотно-щелочного, фосфорно-кальциевого, белкового и липидного обменов; уровня гемоглобина (Hb) и эритроцитов при меньшей дозе эритропоэтина; снижать выраженность уремической интоксикации и степень риска развития ССО. Применение МБД способствует повышению концентрации в плазме крови уровней альбумина, трансферрина, холестерина (ХС) липопротеидов высокой плотности (ЛВП), снижению уровня общего ХС при исходно сниженном уровне альбумина в плазме [20—25].
Результаты рандомизированного клинического исследования, изучавшего влияние МБД на выживаемость больных ХБП IV—V стадии при долгосрочном наблюдении (48 мес), показало, что ограничение белка в диете в сочетании с кетоаналогами аминокислот не приводит к белково-энергетической недостаточности и не оказывает отрицательного влияния на прогноз (раннее начало диализа и риск смерти) [26]. В проспективном наблюдении в течение 90±6,3 мес 102 пациентов c ХБП на додиализной стадии (возраст 62,4±11,3 года), получавших строгую МБД (33,4±24 мес), показано увеличение выживаемости пациентов и додиализного периода на 15,4 мес [27]. В исследовании с участием 200 больных ХБП III—IV стадии с хроническими гломерулонефритами (возраст 46,7 года) с длительностью ХБП 5,2 года и падением СКФ на 4 мл/мин/год у пациентов, получавших МБД (белок 0,6 г/кг/сут в период от 6 мес до 2,5 года) получено замедление снижения СКФ на 0,8 мл/мин/год и на 2 мл/мин/год через 2,5 года, что позволило отсрочить начало диализа на 12 мес. По данным исследования MDRD (1994), применение МБД в течение 4,5 года отдалило потребность в диализе на 11 мес у пациентов с уровнем клубочковой фильтрации от 25 до 10,5 мл/мин при линейном характере ее снижения 4 мл/мин/год.
Клинические рекомендации по кардио- и нефропротекции у больных ХБП достаточно полно отражены в литературе: итоги исследований ACCOMBLISH, EDVANCE, ALTITUDE, CARRESS-HF, ONTARGET, ROADMAP, SHARP; национальные, Европейские и международные клинические рекомендации научных обществ и ассоциаций нефрологов, кардиологов, обществ по АГ (KDIGO, KDOQI, ESH/ESC). Несмотря на возможности консервативной ренопротективной терапии, имеющей решающее значение в торможении прогрессирования дисфункции почек, ее рекомендации в реальной клинической практике используются недостаточно эффективно [2]. Большинство публикаций результатов клинического применения МБД и КА/АК у пациентов с ХБП посвящены оценке статуса питания [25—28].
Единичные публикации о результатах внедрения клинических рекомендаций по кардио- и нефропротекции в клиническую практику отражают трудности достижения целевых уровней АГ, липидов. Так, по данным регистра российского диализного общества 2000—2007 гг., у больных ХБП, впервые поступавших на диализ в России, лишь у каждого 5-го систолическое артериальное давление (САД) было ниже 140 мм рт.ст., т.е. у 80% контроль артериального давления (АД) на додиализном этапе проводится неудовлетворительно. Изучение опыта 28 врачебных практик в США (2010 г.) по наблюдению 6527 больных АГ старше 18 лет с комбинацией нескольких факторов риска и ассоциированных заболеваний (у 48,7% пациентов — ожирение, у 25,3% — СД 2-го типа, у 60,7% — дислипопротеидемия), только у 55,5% достигался контроль АД, в том числе у 62,4%, не имевших СД, и в 2 раза реже (у 33%) у пациентов с СД [29].
Цель исследования: оценить эффективность нефропротекции у пациентов с ХБП III—IV стадий, соблюдавших МБД в сочетании с приемом кетоаналогов аминокислот (кетостерил) и без приема кетоаналогов, при длительном наблюдении врачами первичного звена.
Материал и методы
В исследование вошли 63 пациента с ХБП III или IV стадии в возрасте 17—65 лет (49,3±3,1 года; 55 мужчин, 38 женщин), подписавших информированное согласие на исследование. Определение стадий ХБП осуществляли в соответствии с классификацией K/DOQI [30]. Критерии исключения из исследования: активность основного заболевания почек, проведение иммуносупрессивной терапии, а также сопутствующие заболевания, требующие госпитализации, операции или активной терапии.
Пациенты с ХБП были разделены на 3 группы (2 группы наблюдения и 1 группа сравнения): 1-я и 2-я группы (наблюдения) — пациенты, соблюдающие рекомендации врача по нефропротекции, включая ограничение белка в диете; в 1-й группе (31 пациент в возрасте 53,3±3,1 года) — в сочетании с кетоаналогами аминокислот (кетостерил), во 2-й группе (22 пациента в возрасте 54,9±3,2 года) — без кетоаналогов аминокислот. В 3-ю группу (сравнения) вошли 10 пациентов (51,7±4,2 года), не выполнявших рекомендации лечащего врача по нефропротекции или принимавших лекарственные препараты эпизодически, «по требованию», т.е. по сути с естественным течением ХБП. Группу контроля составили 30 здоровых лиц (52,3±2,2 года; М/ Ж=16/14), сопоставимые по возрасту и полу с больными групп наблюдения. В структуре ХБП преобладал хронический гломерулонефрит (табл. 1).
Таблица 1. Структура ХБП по нозологии и стадиям
| Показатель | 1-я группа наблюдения (n=31) | 2-я группа наблюдения (n=22) | 3-я группа сравнения (n=1) | χ2 | Р |
| По нозологии | |||||
| Хронический гломерулонефрит | 24 (77,4) | 14 (63,7) | 7 (70) | 0,122 | 0,941 |
| Тубулоинтерстициальный нефрит | 4 (12,9) | 6 (27,2) | 1 (10) | 1,570 | 0,456 |
| Диабетическая нефропатия | 3 (9,7) | 2 (9,1) | 2 (20) | 0,719 | 0,698 |
| По стадиям | |||||
| III | 17 (54,8) | 15 (68,2) | 6 (60) | 0,236 | 0,890 |
| IV | 14 (45,2) | 7 (31,8) | 4 (40) | 0,422 | 0,810 |
Примечание. р —для множественного сравнения групп с помощью χ2-критерия. Здесь и в табл. 2: ХБП — хроническая болезнь почек.
Статистический анализ проводили методами параметрической и непараметрической статистики: для количественных признаков рассчитывали среднюю величину (М) и стандартную ошибку (m) при нормальном распределении и медиану (Ме) с указанием 25-го и 75-го процентилей — при негауссовском распределении; для сравнения долей использовали χ2-критерий.
Результаты и обсуждение
Пациенты находились под наблюдением нефрологов или участковых врачей (терапевтов или врачей общей практики). Все пациенты имели АГ стадии, 88% — нарушения липидного обмена (гиперлипидемия и дислипидемия). Длительность ХБП к началу исследования составила 14,8 года.
Все пациенты 1-й и 2-й подгрупп соблюдали диету с ограничением поваренной соли (не более 5 г/сут) и белка: на СIIIa стадии — менее 0,8 г/кг/сут, на СIIIб—IV стадии — 0,6—0,3 г/кг/сут. Доза кетоаналогов незаменимых аминокислот (кетостерил) составила: 1 таблетка на 5 кг массы тела в сутки или 0,1 г/кг массы тела в сутки [17]. Пациенты получали комбинированную антигипертензивную терапию: комбинацию ингибиторов ангиотензинпревращающего фермента (ИАПФ) или блокаторов рецепторов к ангиотензину (БРА) с антагонистами кальция (АК), диуретиками или β-адреноблокаторами. Дозы и комбинации гипотензивных препаратов подбирали в зависимости от уровня АД для достижения целевых показателей в соответствии с рекомендациями KDOQI [30]: для пациентов III—IV стадии ХБП — lt;135/85 мм рт.ст. при суточной протеинурии <1 г/л или <125/75 мм рт.ст. при суточной протеинурии >1 г/л, а при невозможности достижения данных показателей — в пределах <140—160/90 мм рт.ст. Указанные целевые уровни были более жесткими по сравнению с представленными в последних Европейскими рекомендациями по ведению пациентов с АГ [31].
Гиполипидемическая терапия у пациентов с гипер- и дислипидемией состояла в назначении статинов в рекомендуемых дозах с коррекцией доз у больных АГ при высоком и очень высоком риске развития ССО для достижения уровня общего ХС<4,5 ммоль/л(175 мг/дл) и ХС липопротеидов низкой плотности (ЛНП)<2,5 ммоль/л (100 мг/дл). Пациенты с анемией легкой степени (выявлена лишь у 3 больных 1-й группы, 2 — 2-й и 1 — 3-й группы) получали эритропоэтин и/или препараты железа.
Обследование пациентов включало данные анамнеза (длительность основного заболевания и ХБП), изучение клинических проявлений с измерением САД и ДАД; лабораторные показатели — уровень креатинина в сыворотке крови, анализ липидного состава крови — общий ХС, ЛНП и ЛВП, триглицериды (ТГ); общий белок и протеинограмма, фосфорно-кальциевый обмен (P и Са в сыворотке крови), суточная протеинурия, показатели красной крови (гемоглобин, эритроциты), ультразвуковое исследование (УЗИ) почек. Рассчитывали объем почек по формуле А.И. Дергачева (1995), СКФ (рСКФ) по формуле CKD-EPI [32, 33], скорость снижения СКФ (ДСКФ). Длительность проспективного наблюдения составила 43,2—72,1 мес (табл. 2).
Таблица 2. Клинико-лабораторные показатели у больных с ХБП III—IV стадии при поступлении под наблюдение (начальный уровень)
| Показатель | 1-я группа наблюдения (n=31) | 2-я группа наблюдения (n=22) | 3-я группа сравнения (n=10) | Р | Контрольная группа (n=30) |
| Возраст, годы | 53,3±3,1 | 54,9+3,2 | 51,1+2,8 | 0,809 | 52,3+2,2 |
| Пол: М/Ж | 18/13 | 13/9 | 4/6 | 1,000 | 16/14 |
| Длительность заболевания, годы | 14,8±1,8 | 12,6+1,4 | 13,6+1,9 | 0,643 | — |
| САД, мм рт.ст. | 152,4+1,6* | 157,6+2,5* | 158,9+3,9* | 0,110 | 122,6+1,5 |
| ДАД, мм рт.ст. | 85,7±1,3* | 89,1+1,7* | 91,3+2,3* | 0,081 | 78,9+2,5 |
| Общий ХС, ммоль/л | 6,0+0,3* | 6,4+0,2* | 6,3+0,5* | 0,641 | 4,6+0,1 |
| ТГ, ммоль/л | 2,4+0,3 | 2,2+0,2 | 2,5+0,4 | 0,815 | 1,4+0,2 |
| ЛНП, ммоль/л | 3,8+0,2* | 3,6+0,1* | 3,6+0,2* | 0,662 | 2,9+0,2 |
| ЛВП, ммоль/л | 1,0+0,1* | 1,0+0,07* | 0,9+0,06* | 0,809 | 1,4+0,1 |
| Общий белок, г/л | 71,9+1,1 | 73,8+1,7 | 72,8+1,5 | 0,251 | 75,6+1,5 |
| Кальций, ммоль/л | 2,36+0,03 | 2,24+0,06* | 2,34+0,04 | 0,121 | 2,41+0,02 |
| Фосфор, ммоль/л | 1,24+0,07 | 1,35+0,05* | 1,23+0,09 | 0,434 | 1,06+0,04 |
| Hb, г/л | 128,5+4,1 | 126,1+4,8 | 123,1+4,9 | 0,779 | 134,7+5,2 |
| Суточная протеинурия, г/сут | 1,8+0,2 | 1,4+0,1 | 1,5+0,3 | 0,273 | 0,0 |
| Объем почек, см3 | 105,0+2,3* | 94,8+1,6*, ** | 95,7+1,8*, ** | 0,001 | 114,9+2,2 |
| Креатинин, мкмоль/л | 258,9+16,2* | 230,7+18,7* | 212,2+21,3* | 0,259 | 122,6+5,5 |
| СКФ, мл/мин/1,73 м2 | 26,7+4,8* | 35,7+1,9* | 33,4+2,1* | 0,248 | 97,3+3,5 |
Примечание. р — для множественного сравнения групп с помощью дисперсионного анализа (без учета контрольной группы); различия достоверны (р<0,05; критерий Ньюмена—Кейлса) * — с контрольной группой; ** — с 1-й группой наблюдения. САД — систолическое артериальное давление; ДАД — диастоличегкое артериальное давление; ХС — холестерин; ТГ — триглицериды; ЛИП — липопротеиды низкой плотности; ЛВП — липопротеиды высокой плотности; Hb — гемоглобин; СКФ — скорость клубочковой фильтрации.
Наблюдаемые пациенты были трудоспособного возраста, преобладали мужчины. В группах наблюдения и сравнения уровень АД и лабораторных показателей, характеризующих белковый, липидный, фосфорно-кальциевый обмены, функцию почек, состояние периферической крови были сопоставимы, но отличались от показателей контрольной группы. Суточная протеинурия во всех группах превышала 1 г/л (1,4—1,8 г/л). Показатели функции почек по уровню СКФ (CKD-EPI) соответствовали III и IV стадии ХБП. Объем почек во всех группах был снижен по сравнению с контролем, также различался между группами (р=0,001).
К завершению исследования наибольшая степень снижения АД по сравнению с исходным уровнем отмечена в 1-й группе (рис. 1):
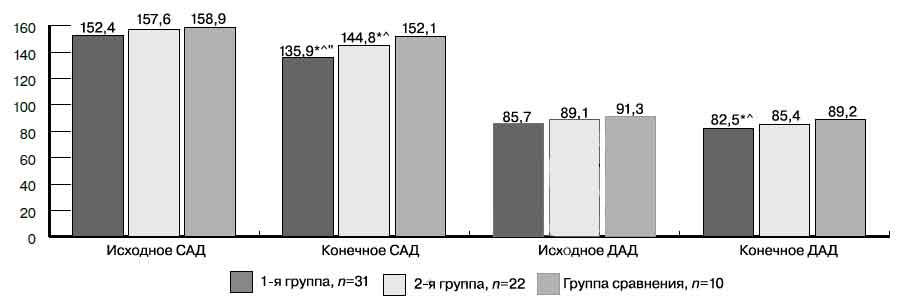
Рис. 1. Исходные и конечные уровни САД и ДАД у пациентов с ХБП 1—3-й групп.
Здесь и на рис. 2, 3: различия достоверны (р<0,05) * — соответствующего показателя с его исходным уровнем; ^ — с группой сравнения; " — между 1-й и 2-й группами. САД — систолическое артериальное давление; ДАД — диастолическое артериальное давление.
САД (135,9±1,3 мм рт.ст.; р=0,000) и ДАД (82,5±0,9 мм рт.ст.; р=0,047). Средние темпы снижения САД оказались более значимыми (ДСАД): -0,78 мм рт.ст. в год (р=0,021) по сравнению с ДДАД: -0,14 мм рт.ст. в год (р=0,679). Во 2-й группе САД также снизился (144,8±2,1 мм рт.ст.; р=0,000), уровень ДАД не изменился. В 3-й группе пациентов выявлена отрицательная динамика АД: прирост САД и ДАД на 1,50 (р=0,047) и 1,55 мм рт.ст. в год соответственно (р=0,039).
Целевых уровней АД (менее 135/85 мм рт.ст.) не достиг ни один из пациентов, а уровня менее 140/90 мм рт.ст. достигли лишь 17 (54,8%) пациентов, как правило, к 3-му месяцу наблюдения. Наилучшие результаты по достижению и удержанию САД и ДАД <140/90 мм рт.ст. были получены в 1-й группе наблюдения у пациентов, которые в комплексе нефропротективной терапии получали КА/АК.
Динамика суточной протеинурии у пациентов с ХБП в группах была следующая (рис. 2): уровень в 1-й группе постепенно снижался к 4-му году наблюдения и в дальнейшем был стабильным, за период наблюдения суточная протеинурия уменьшилась на 61% от исходной (р<0,05), темп снижения протеинурии составил 0,15 г/сут/год (р=0,000).
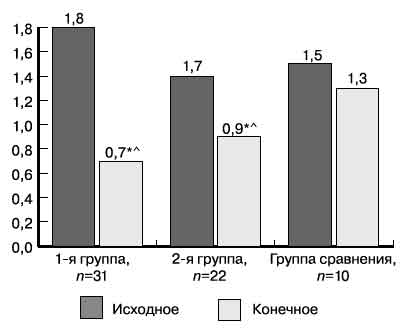
Рис. 2. Уровень суточной протеинурии у больных ХБП в начале и в конце наблюдения.
Здесь и на рис. 3: ХБП — хроническая болезнь почек.
Во 2-й группе пациентов суточная протеинурия также снизилась, но менее значительно — на 35,7% (р<0,05). В 3-й группе уровень суточной протеинурии вплоть до окончания наблюдения оставался без динамики. Таким образом, МБД в комплексе нефропротективной терапии у пациентов с ХБП III—IV стадии способствует уменьшению протеинурии, а применение КА/АК усиливает антипротеинурическую активность МБД.
Уровни общего белка и альбумина сыворотки в крови у больных 1-й группы имели тенденцию к росту (соответственно с 71,9+1,1 до 74,2±1,3 г/л, р=0,182; с 38,7±0,9 до 40,5±1,4 г/л; p=0,264), во 2-й группе — тенденцию к снижению (с 73,8±1,7 до 69,2±1,9 г/л; р=0,078; и с 39,8±1,4 до 38,3±1,1 г/л; р=0,404), в 3-й группе уровни достоверно снизились (с 72,8±1,5 до 66,2±1,9; р=0,014 и с 38,7±0,9 до 31,3±1,6 г/л; р=0,000). Содержание общего белка и альбумина в сыворотке крови по завершению наблюдения в 1-й группе превышало соответствующие показатели 2-й группы (p=0,029) и группы сравнения (р=0,003). На основании изложенного можно судить о том, что применение кетоаналогов аминокислот в сочетании с ограничением белка в рационе является не только эффективным с точки зрения нефропротекции, но и безопасным при длительном применении с точки зрения развития нарушений белкового обмена. Интересным представляется то, что нарушения белкового обмена отмечались к концу исследования в группе пациентов с ХБП, у которых потребление белка не ограничивалось.
По завершению исследования уровень Hb в 1-й группе составил 122,7+4,1 г/л, ΔНb=(-0,97) г/л/год (р=0,323); во 2-й группе — 117,5+3,2 г/л, ΔНb=(-1,43) г/л/год (р=0,143). Конечный уровень Нb в 3-й группе был ниже (98,7+3,8 г/л) по сравнению с таковым в 1-й и 2-й группах (р=0,004), ΔНb в ней составил 4,07 г/л/год (р=0,000). Таким образом, темпы снижения уровня Нb за период наблюдения у пациентов 1-й группы, получающих кетоаналоги аминокислот, были ниже, чем в группе только с ограничением белка в диете. Самые высокие темпы снижения Нb были в 3-й группе, средний уровень Нb к окончанию наблюдения соответствовал анемии I степени. Наиболее клинически значимые положительные изменения обмена липидов наблюдались в 1-й группе: уровень ЛВП вырос с 1,1+0,06 до 1,36+0,07 ммоль/л (р=0,000), общего ХС снизился с 6,0+0,3 до 4,8+0,1 ммоль/л (р=0,001). Во 2-й группе уровень ЛВП вырос с 1,0+0,07 до 1,18+0,02 (р=0,018) ммоль/л, общего ХС снизился с 6,4+0,2 до 5,2+0,3 ммоль/л (р=0,002). В 3-й группе достоверных изменений уровней липидов не выявлено. В конце наблюдения достоверные различия оказались только по уровням ЛВП между всеми группами (р<0,05) и общему ХС между 1-й и 3-й группой (р<0,05) с наилучшими показателями в 1-й группе. Это подтверждает положительное влияние кетоаналогов аминокислот на липидный гомеостаз. Целевые уровни общего ХС и ЛНП не были достигнуты ни в одной из групп.
Анализ показателей фосфорно-кальциевого обмена в группах проводили раздельно на III и IV стадиях ХБП (рис. 3).
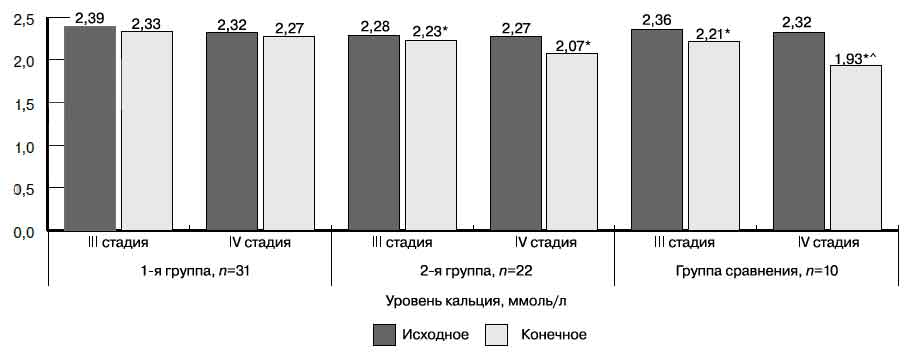
Рис. 3. Динамика уровня кальция крови у больных ХБП III—IV стадий в группах наблюдения и сравнения.
^ — для различий с 1-й группой (р<0,05).
Исходные уровни кальция в сыворотке крови во всех группах больных ХБП не различались и были в пределах нормы. Конечные уровни кальция во 2-й и 3-й группах по сравнению с 1-й группой оказались ниже исходного (р<0,05). Однако если в 1-й и 2-й группах конечный уровень кальция оставался в пределах нормы, то в 3-й группе на IV стадии ХБП была зарегистрирована гипокальциемия.
Уровень фосфора в сыворотке крови в начале наблюдения во всех группах был в границах нормы, но в 1-й и 2-й группах — ниже, чем в группе сравнения (р<0,05). В конце наблюдения у пациентов 1-й и 2-й групп с IV стадией ХБП уровень фосфора был также ниже, чем в группе сравнения (р<0,05), а в 1-й группе он был ниже, чем во 2-й (р<0,05). На IV стадии ХБП во 2-й группе и группе сравнения отмечен значительный прирост уровня фосфора по сравнению с исходным. Наименьший прирост уровня фосфора оказался в группе пациентов с ХБП, получавших кетостерил.
Темпы снижения СКФ у пациентов 1-й группы составили 0,78 мл/мин/год (р=0,021) с колебаниями от -0,49 до -4,1 мл/ мин/ год. При этом у 7 (22,6%) пациентов этой группы СКФ оставалась стабильной на протяжении всего периода наблюдения, а у 3 (9,7%) больных ХБ П IV стадии перешла в V стадию и эти больные получали ЗПТ к моменту окончания наблюдения. Темпы снижения СКФ во 2-й группе были выше, чем в 1-й группе — -4,9 мл/мин/год (р=0,000) с колебаниями от -3,1 до -9,4 мл/мин/год, у 4 (18,1%) пациентов ХБП перешла в V стадию и они начали плановую ЗПТ; в 3-й группе темпы снижения были еще выше — -8,2 мл/мин/год (р=0,000) с колебаниями от -5,3 до -10,1 мл/мин/год; плановую ЗПТ начали 4 (40%) пациента с ХБП. Наименьшие темпы снижения СКФ отмечались в 1-й группе, умеренные — во 2-й, а наибольшие — в 3-й группе, что также свидетельствует в пользу повышения нефропротективной эффективности при применении кетоаналогов аминокислот в сочетании с МБД.
Уровень СКФ к завершению наблюдения в 1-й группе (19,9 мл/мин/год) оказался выше, чем во 2-й (16,1 мл/мин/год), а во 2-й группе — выше, чем в 3-й (8,9 мл/мин/год).
Заключение
Применение кетоаналогов аминокислот (кетостерил) повышает эффективность и безопасность кардионефропротективной терапии у пациентов с хронической болезнью почек III—IV стадии, получающих малобелковую диету, в плане замедления темпов снижения скорости клубочковой фильтрации и отдаления сроков начала диализной терапии, коррекции артериальной гипертонии, снижения протеинурии, сохранения уровня гемоглобина, коррекции нарушений липидного обмена, а также профилактики нарушений белкового и фосфорно-кальциевого метаболизма. Учитывая высокую стоимость заместительной почечной терапии, можно констатировать повышение экономической эффективности кардионефропротективной терапии при применении кетоаналогов незаменимых аминокислот.
Литература
1. Smirnov A.V., Shilov E.M., Dobronravov V.A., Kajukov I.G., Bobkova I.N., Shvecov M. Ju., Cygin A.N., Shutov A.M. Chronic kidney disease: the basic principles of screening, diagnosis, prevention and treatment approaches. National guidelines. Spb.: Izdatel'stvo «Levsha. Sankt-Peterburg» 2012;52 p. Russian (Смирнов А.В., Шилов Е.М., Добронравов В.А., Каюков И.Г., Бобкова И.Н., Швецов М.Ю., Цыгин А.Н., Шутов А.М. Хроническая болезнь почек: основные принципы скрининга, диагностики, профилактики и подходы к лечению. Национальные рекомендации. Спб.: Издательство «Левша. Санкт-Петербург» 2012;52 с.).
2. Bikbov B.T., Tomilina N.A. Replacement therapy in patients with chronic renal failure in the Russian Federation in 1998—2011 years. Nephrology and dialysis 2014;16(1):11—127. Russian (Бикбов Б.Т., Томилина Н.А. Заместительная терапии больных с хронической почечной недостаточностью в Российской Федерации в 1998—2011 гг. Нефрология и диализ. 2014;16(1):11—127).
3. hronic Kidney Disease Prognosis Consortium, van der Velde M., Matsushita K., Coresh J., Astor B.C., Woodward M., Levey A.S., de Jong P.E., Gansevoort R.T., Levey A., El-Nahas M., Eckardt K.U., Kasiske B.L., Ninomiya T., Chalmers J., Macmahon S., Tonelli M., Hemmelgarn B., Sacks F., Curhan G., Collins A.J., Li S., Chen S.C., Hawaii Cohort K.P., Lee B.J., Ishani A., Neaton J., Svendsen K., Mann J.F., Yusuf S., Teo K.K., Gao P., Nelson R.G., Knowler W.C., Bilo H.J., Joosten H., Kleefstra N., Groenier K.H., Auguste P., Veldhuis K., Wang Y., Camarata L., Thomas B., Manley T. Association of estimated glomerular filtration rate and albuminuria with all-cause and cardiovascular mortality in general population cohorts: a collaborative meta-analysis. Lancet 2010;375:2073—2081. 10.
4. Shilov E.M., Shvecov M.Ju., Bobkova I.Ju., Kolina I.B., Kamyshova E.S. Chronic kidney disease. Manual for doctors. М., 2012;83 p. Russian (Шилов Е.М., Швецов М.Ю., Бобкова И.Ю., Колина И.Б., Камышова Е.С. Хроническая болезнь почек: методическое 11. руководство для врачей. М. 2012;83 с).
5. Robinson B.M., Zhang J., Morgenstern H., Bradbury B.D, Ng L.J., McCullough K.P., Gillespie B.W., Hakim R., Rayner H., Fort J., Akizawa T., Tentori F., Pisoni R.L. Worldwide, mortality risk is high soon after initiation of hemodialysis. Kidney Int. 2014;84(1):158—165.
6. Smirnov A.V., Shilov E.M., Dobronravov V.A., Kajukov I.G., Bobkova I.N., Shvecov M.Ju., Cygin A.N., Shutov A.M. National guidelines. Chronic kidney disease: the basic principles of screening, diagnosis, prevention and treatment approaches. Nephrology. 2012;16(1):89—115. Russian (Смирнов А.В., Шилов Е.М., Добронравов В.А., Каюков И.Г., Бобкова И.Н., Швецов М.Ю., Цыгин А.Н., Шутов А.М. Национальные рекомендации. Хроническая болезнь почек: основные принципы скрининга: диагностика, профилактика и подходы к лечению. Нефрология. 2012;16(1):89—115).
7. Moiseev V.S., Mukhin N.A., Smirnov A.V. on behalf of the research team National guidelines. Cardiovascular risk and chronic kidney disease: cardio-nefroprotection strategy. Clinical Pharmacology and Therapeutics. 2014; 23(3):1—24. Russian (Моисеев В.С., Мухин Н.А., Смирнов А.В. от имени группы исследователей Национальные рекомендации. Сердечно-сосудистый риск и хроническая болезнь почек: стратегии кардио-нефропротекции. Клиническая фармакология и терапия. 2014; 23(3):1—24.)
8. KDIGO 2012. Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney Int Suppl. 2013; 3:1 — 136.
9. National Kidney Foundation. KDOQI. Clinical Practice Guideline for Diabetes and CKD: 2012 update. Am J Kidney Dis. 2012; 60(5):850-886.
10. 2013 ESH/ESC: guidelines for the management of arterial hypertension: the Task Force for the Management of Arterial Hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). Eur Heart J. 2013; 34:2159—219.
11. National guidelines on cardiovascular prevention. Cardiovascular therapy and prevention. 2011;10(6,suppl.2) Russian (Национальные рекомендации по кардиоваскулярной профилактике. Кардиоваскулярная терапия и профилактика.2011;10(6,прил.2).
12. European Guidelines on cardiovascular disease prevention in clinical practice (version 2012): the Fifth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice. Eur Heart J. 2012; 33:1635—701.
13. Diagnostics and correction of lipid disorders for the prevention and treatment of atherosclerosis. Russian recommendations. V review. Moscow. 2012. Russian (Диагностика и коррекция нарушений липидного обмена с целью профилактики и лечения атеросклероза. Российские рекомендации. V пересмотр.М.,2012).
14. ESH/ESC: Guidelines for the management of dyslipidaemias: the Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and of the European Atherosclerosis Society (EAS). Eur Heart J. 2011; 32:1769—818.
15. Kidney Disease: Improving Global Outcomes (KDIGO) Lipid Work Group. KDIGO Clinical Practice Guideline for Lipid Management in Chronic Kidney Disease. Kidney Int Suppl. 2013;3:259—305.
16. Jones-Burton C., Mishra S.I., Fink J.C., Brown J., Gossa W., Bakris G.L., Weir M.R. An in-depth review of the evidence linking dietary salt intake and progression of chronic kidney disease. Am J Nephrol. 2006;26(3):268—275.
17. Modification of Diet in Renal Disease Study Group. Effects of dietary protein restriction on the progression of moderate renal disease in the Modification of Diet in Renal Disease Study. J Am Nephrol. 1996;7:2616—2626.
18. Peterson J.C., Adler S., Burkart J.M., Greene T., Lee A. Hebert, Hunsicker L.G., King A.J., Klahr S., Massry S.G., Seifter J.L. Modification of Diet in Renal Disease Study Group. Blood pressure control, proteinuria, and the progression of renal disease. Ann Intern Med. 1995;123(10):754—762.
19. Aparicio M., Belizzi V., Chauveau P., Cupisti A., Ecder T., Fougue D., Garneata L., Lin S., Mich W.E., Teplan V., Zakar G., Yu X. Keto acid therapy in predialysis chronic kidney disease patients: final consensus. J Renal Nutr. 2012; 22:22—24.
20. Teplan V., Schuck O., Knotek A. Hajny J., Horackova M., Skibova J., Maly J. Effect of low-protein diet supplement with ketoacids and erytroportin in chronic renal failure: a long-term metabolic study. Ann Transpl. 2001;6(1):47—53.
21. Belizzi V., De Iorio B.R., De Ncola L., Minutolo R., Zamboli P., Trucillo P., Catapano F., Cristofano C., Scalfi L., Conte G. ERIKA Study Group. Very low protein diet supplemented with ketoanalogs improves blood pressure control in chronic kidney disease. Kidney Int 2007;71(3):245—251.
22. Mukhin N.A., Kozlovskaya L.V., Fomin V.V., Milovanov Ju.S. Research MDRD: importance for clinical nephrology. Clinical Nephrology. 2013; 4:4-7 Russian (Мухин Н.А., Козловская Л.В., Фомин В.В., Милованов Ю.С. Исследование MDRD: значение для клинической нефрологии. Клиническая нефрология 2013;4:4—7.).
23. Aparicio M., Cano N.J.M., Cupisti A., Ecder T., FouqueD., Garneata L., Liou H., Lin S., Schober-Halstenberg H.-J., Teplan V., Zakar G. KetoAcid Therapy in Predialysis Chronic Kidney Disease Patients: Consensus Statements. J Ren Nutr. 2009;19(5):33—35.
24. Jiang N., Qian J., Sun W., Lin A., Cao L., Wang Q., Ni Z., Wan Y., Lindholm B., Axelsson J., Yao Q. Better preservation of residual renal function in peritoneal dialysis patients treated with a low-protein diet supplemented with keto acids: a prospective, randomized trial. Nephrol Dial Transplant. 2009; 24:2551—2558.
25. Milovanov Ju.S., Kozlovskaya L.V., Milovanov L.Ju. Renal protection early correction of violations of nutritional status in patients with predialysis stage of chronic kidney disease. Therapeutic Archives. 2008;80(6):29—33. Russian (Милованов Ю.С., Козловская Л.В., Милованов Л.Ю. Нефропротективный эффект ранней коррекции нарушений нутритивного статуса у пациентов с преддиализной стадией хронической болезни почек. Терапевтический архив. 2008;80(6):29—33).
26. Cianciaruso B., Pota A., Bellizzi V., Di Giuseppe D., Di Micco L., Minutolo R., Pisani A., Sabbatini M., Ravani P. Effect of a Low-Versus Moderate-Protein Diet on Progression of CKD: Follow-up of a Randomized Controlled Trial. Am J Kidney Dis. 2009;54(5):1052—1061.
27. Chauveau P., Couzi L., Vendrely B., de Precigout V., Combe C., Fouque D., Aparicio M. Long-term outcome on renal replacement therapy in patients who previously received a keto acid-supplemented Very-low-protein diet. Am J Clin Nutr. 2009;90(4):969—974.
28. Milovanov Ju.S. Experience of essential AA and ketoanalogy at low-protein diet in patients with CKD predialysis renal insufficiency. Consilium-medicum. 2007; 9 (4):2-6. (Милованов Ю.С. Опыт применения незаменимых АК и их кетоаналогов при МБД у больных с ХБП на додиализном этапе почечной недостаточности. Consilium medicum. 2007;9(4):2—6).
29. Bellini D.A., Zacker C., Wogen J. Effect of cardiometabolic risk factors on hypertension management: a cross-sectional study among 28 physician practices in the United States Cardiovascular Diabetology. 2010;9:7.
30. National Kidney Foundation. K/DOQI clinical practice guidelines for chronic kidney disease: evaluation, classification, and stratification. Am J Kidney Dis. 2002;39(2,suppl.1):1—266.
31. ESH/ESC. Guidelines for the management of arterial hypertension. Journal of Hypertension. 2013;31:1281—1357.
32. Levey A.S., De Jong P.E., Gansevoort R.T., Coresh J., Astor B.C., Matsushita K., Nahas M.E., Kasiske B.L., Eckardt K.-U. The definition, classification, and prognosis of chronic kidney disease: a KDIGO Controversies Conference report. Kidney Int. 2010;80:17—28.
33. Levey AS, Stevens LA, Schmid CH, Zhang YL, Castro AF 3rd, Feldman HI, Kusek J.W., Eggers P., Van Lente F., Greene T., Coresh J., CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration). A new equation to estimate glomerular filtration rate. Ann Intern Med. 2009;150(9):604—12.
