Критический инцидент на марафонской дистанции как следствие декомпенсации метаболических процессов
Статьи
Орлов Ю.П.1, Говорова Н.В.1, Глущенко А.В.1, Ефремов Е.Н.2, Василенко Ю.Б.2
1ГБОУВПО «Омский государственный медицинский университет» Минздрава России,644099, Омск;
2БУЗОО «Городская клиническая больница скорой медицинской помощи №1», 664112, Омск
Клиническая медицина, vol. 95, no. 1, 2017, pp. 85-89.
В настоящей статье приведено клиническое наблюдение развития синдрома полиорганной недостаточности, обусловленного комой, судорожным синдромом, острой почечно-печеночной дисфункцией, острой дыхательной недостаточностью, гиповолемическим шоком и гипертермическим синдромом у 46-летнего участника марафона. В клинической картине преобладала острая печеночная недостаточность, интенсивная терапия которой осуществлялась с использованием ремаксола. Использование ремаксола в приведенном клиническом наблюдении является вариантом активации субстратного фосфорилирования за счет введения экзогенного сукцината, что позволяет затормозить энергетический дефицит в митохондриях в условиях недостаточного содержания кислорода. Приведенное клиническое наблюдение может быть рассмотрено как вариант коррекции митохондриальной дисфункции с помощью митохондриально-адресованного препарата, каковым является ремаксол, содержащий в своей структуре сукцинат — наиболее востребованный в условиях гипоксии субстрат. Назначение ремаксола привело к динамичному снижению активности аспартат- и аланинаминотрансферазы за счет введения экзогенного сукцината и уменьшения «затрат» ферментов на синтез сукцината при гипоксии из аминокислот аспартата и аланина. В приведенном клиническом наблюдении использование у пациента ремаксола продиктовано его патогенетической необходимостью и носит прямой заместительный характер.
Ключевые слова: синдром полиорганной недостаточности у 46-летнего участника марафона, ремаксол.
Для цитирования: Орлов Ю.П., Говорова Н.В., Глущенко А.В., Ефремов Е.Н., Василенко Ю.Б. Критический инцидент на марафонской дистанции как следствие декомпенсации метаболических процессов. Клин. мед. 2017; 95 (1): 85—89.
Для корреспонденции: Орлов Юрий Петрович — д-р мед. наук, проф. каф. анестезиологии и реаниматологии.
A critical incident during marathon competition as a result of metabolic decompensation
Orlov Yu.P.1, Govorova N.V.1, Glushchenko A.V.1, Efremov E.N.2, Vasilenko Yu.B.2
1Omsk State Medical University, 644099 Omsk, Russia;
2City Clinical Hospital №1, 664112 Omsk, Russia
A case of polyorganic insufficiency syndrome associated with coma, convulsive disorder, acute hepato-renal and respiratory dysfunction, hypovolemic shock, and hyperthermal syndrome in a 46 year-old participant of a marathon competition is reported. The clinical picture was dominated by acute hepatic insufficiency treated with remaxol to activate substrate phosphorylation under effect of exogenous succinate for slowing down the development of energy deficit in mitochondria under condition of oxygen deficit. This case can be regarded as a variant of correction of mitochondrial dysfunction with the use of a mitochondria-targeted medication such as succinate-containing remaxol. This medication reduced AST and ALT activities and utilization of endogenous enzymes for succinate synthesis from alanine and aspartate under hypoxic conditions. Prescription of remaxol as a form of direct substitution therapy was dictated by pathogenetic considerations.
Key words: polyorganic insufficiency syndrome; marathon runner; remaxol.
For citation: Orlov Yu.P., Govorova N.V., Glushchenko A.V. , Efremov E.N., Vasilenko Yu.B. A critical incident during marathon competition as a result of metabolic decompensation. Klin. med. 2017; 95 (1): 85—89.
For correspondence: Yuri P. Orlov — MD, PhD, DSc, prof. Dpt. of Anesthesiology and Resuscitation;
Conflict of interest. The authors declare no conflict of interest.
Acknowledgments. The study had no sponsorship.
С момента своего появления в 490 г. до н. э. и до последнего времени участие в марафонах и полумарафонах имеет большую популярность по ряду причин, в число которых входят предполагаемое преимущество в здоровье и важность выполнения физических упражнений в повседневной жизни. Но наряду с этим расширение участия большого числа населения в марафонах привело и к появлению сообщений о травмах и болезнях у участников соревнований.
Бег на различные дистанции сегодня является очень популярным видом спорта, но высокие физические требования к участникам марафонской гонки (42,2 км) превратили эту дисциплину в одну из самых сложных. Условия, при которых часто проводятся состязания марафонцев, безусловно, далеки от идеальных и способствуют развитию таких патологических состояний, как гипоксия (вследствие гипервентиляции и гипокапнии), гипертермия и обезвоживание (вследствие гиперкатаболизма). Наиболее часто осложнения связаны с гипонатриемией и избыточной потерей воды, что приводит к развитию судорог, отека легких и даже к смерти. Во время марафона наблюдается прогрессирующее истощение углеводных запасов активно работающих мышц [1], а недостаточное поступление глюкозы во время марафонской гонки может привести к гипогликемии и мышечной усталости [2].
Завершение марафона может быть сопряжено с серьезными повреждениями мышечных волокон [3] и привести к высвобождению мышечных белков (миоглобина) в кровь [4]. Исследования, проведенные в биоптатах икроножной мышцы спортсменов до и после марафона, подтверждают, что во время марафонской гонки происходит повреждение мышечных волокон, развиваются некроз и воспаление [5]. Хорошо известно, что тяжелые физические упражнения повышают как потребление кислорода, так и продукцию активных форм кислорода вследствие утечки электронов из комплексов I и III дыхательной цепи митохондрий [5]. Все это имеет место даже у спортсменов, тренированных и адаптированных к марафонским нагрузкам, что видно из табл. 1, в которой отмечено, что повышение ряда биохимических параметров превышает исходный уровень в несколько раз. При этом все участники марафона обезвоживаются во время соревнований, а уменьшение массы тела у них достигает 3 ± 1% [6].
Таблица 1
Биохимические показатели крови у спортсменов до и после марафонской дистанции (M ± т) (адаптировано из [3])
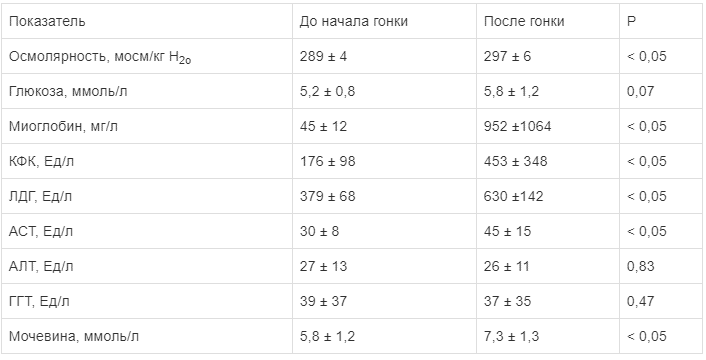
Примечание. КФК — креатинфосфокиназа; ЛДГ — лактатдегидрогеназа; АСТ — аспартатаминотрансфераза; АЛТ — аланинаминотрансфераза; ГГТ — гамма-глутамил-транспептидаза.
Таким образом, малотренированный спортсмен, тем более выходя на марафонскую дистанцию в неблагоприятных климатических условиях, подвергает себя риску развития критического состояния и даже смерти, что может быть следствием физического перенапряжения и сочетания указанных выше патологических состояний.
Приводим клиническое наблюдение.
Пациент С., 46 лет, нормостеник, 07.08.16 был доставлен бригадой скорой медицинской помощи в реанимационный зал ГКБСМП №1 с 40-го километра марафонской дистанции в крайне тяжелом состоянии, обусловленном комой, судорожным синдромом, острой почечно-печеночной дисфункцией, острой дыхательной недостаточностью, гиповолемическим шоком и гипертермическим синдромом.
Из анамнеза заболевания известно, что на 40-м километре дистанции пациент потерял сознание, упал, после чего развились клонико-тонический судорожный приступ и расстройства дыхания. Окружающая температура воздуха в период марафона была в диапазоне 28,5—30,2°C (по данным Омского гидрометцентра). Бригадой скорой медицинской помощи констатирована кома (7—8 баллов по шкале комы Глазго), артериальное давление (АД) 100/50 мм рт. ст., частота сердечных сокращений (ЧСС) 134 в минуту, частота дыхания 10— 12 в минуту, после чего произведены интубация трахеи и перевод на искусственную вентиляцию легких (ИВЛ) с FiO2 50%, купирование судорог (сибазон 20 мг) и на фоне инфузионной терапии (стерофундин 500 мл) пациент доставлен в клинику.
Из анамнеза жизни известно, что пациент ведет здоровый образ жизни, любительским бегом занимается давно, имеет собственный рекорд 15 км, вредных привычек нет. В анамнезе травм и операций нет, пациент практически не болеет, последний контроль массы тела за 7 дней до марафона — 74 кг.
При поступлении общее состояние расценено как крайне тяжелое, обусловленное явлениями полиорганной недостаточности (кома, острая дыхательная недостаточность, почечно-печеночная недостаточность, гипертермический синдром, гиповолемический шок). Уровень сознания по шкале комы Глазго 8—9 баллов, зрачки одинаковые, реагируют на свет, гипертермия 39,4°C, симптом белого пятна 9—10 с, SaO2 94%. АД 90/50 мм рт. ст., ЧСС 142 в минуту, пульс слабого наполнения. На ИВЛ (аппарат Chirolog SV Basic, Словения) в режиме управляемой вентиляции дыхательный объем 540 мл, РЕЕР 6 см вод. ст., Pin 16 см вод. ст., FiO2 35%, дыхание проводится во все отделы.
Диурез снижен — 0,3 мл/кг в час. Анализ крови: Hb 169 г/л, эр. 5,8 • 1012/л, Ht 49%, л. 18,8 • 109/л, нейтрофильный сдвиг до юных (3%). Биохимический анализ крови (табл. 2): гипонатриемия, гиперкалиемия, гипергликемия, явления нефро- и гепатопатии, гемолиз, миоглобинемия (более чем в 5 раз выше нормальных значений), признаки повреждения миокарда. На ЭКГ признаки метаболических нарушений, синусовая тахикардия. Анализ газов крови: PaO2 62 мм рт. ст., PaCO2 58 мм рт. ст., SaO2 97%, pH 7,21, BE 16 ммоль/л, SavO2 65%. При исследовании системы гемостаза отмечены явления гипокоагуляции (фибриноген 1,23, протромбиновый индекс 55%. Анализ мочи: реакция кислая, плотность 1014, гемоглобинурия (0,88 г/л), миоглобинурия (качественная реакция).
Таблица 2
Биохимические показатели крови пациента С. в динамике
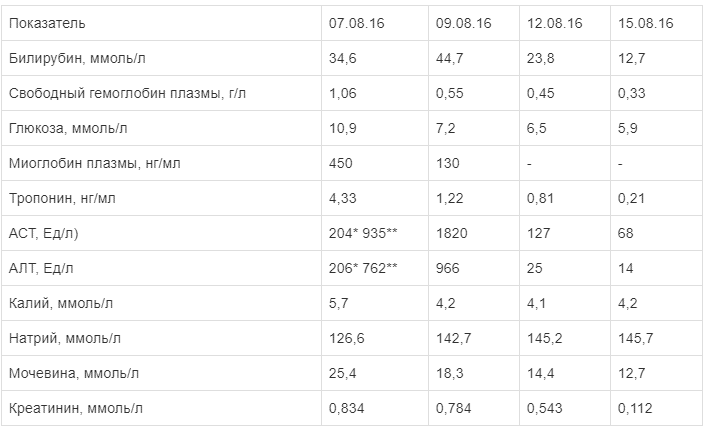
Примечание. Показатели АСТ и АЛТ: * — на момент поступления; **— через 18 ч интенсивной терапии (08.08.16).
При магнитно-резонансной томографии головного мозга патологии не выявлено. Пациент осмотрен хирургом, нейрохирургом, невропатологом, токсикологом (для исключения отравления амфетамином, имеющего сходную клиническую картину), кардиологом и терапевтом. Диагноз: тепловой удар на фоне физического перенапряжения; гиповолемический шок; острый гемолиз, рабдомиолиз; синдром полиорганной недостаточности (острая дыхательная, церебральная, печеночная, почечная недостаточность); синдром водно-электролитных нарушений. Пациент госпитализирован в отделение реанимации и интенсивной терапии.
Учитывая тяжесть общего состояния, наличие комы, системного воспаления, выраженность гиповолемии и гиперосмолярный тип дегидратации, гипертермический синдром и явления полиорганной недостаточности, выполнили катетеризацию правой подключичной вены; центральное венозное давление (ЦВД) не определяется. Проведена антибактериальная, седативная (с целью синхронизации с аппаратом ИВЛ), инфузионая терапия в режиме умеренной регидратации из расчета 30—40 мл/кг в сутки с включением сбалансированных полиионных растворов (стерофундин), 10% раствора глюкозы и антоксидантных инфузионных сред (ремаксол) в объеме 800 мл в сутки, дофамин в дозе 10—12 мкг/кг в 1 мин. Общий объем инфузионной терапии в первые сутки (за 19 ч) составил 2800 мл (ремаксол 400 мл 2 раза, 10% раствор глюкозы 500 мл, стерофундин 1500 мл). К утру 8.08.2016 г. диурез составил 1100 мл (0,8 мл/кг в час) водный баланс (с учетом перспирации и гипертермии) — 150 мл.
К утру 08.08.16 сознание на уровне 10—11 баллов по шкале комы Глазго, продолжается ИВЛ, дыхание проводится во все отделы. Респираторный индекс 280%. Нормотермия (36,7°C). Анализы газов крови удовлетворительные. Рентгенограмма органов грудной клетки без видимой патологии. Кожа чистая, умеренной влажности, подмышечные впадины сухие, симптом белого пятна 2—3 с, SaO2 98%. АД 130/70 мм рт. ст., ЧСС 100 в минуту без вазопрессорной поддержки, ЦВД 3 см вод. ст. Анализ крови: Hb 135 г/л, Ht 41%, эр. 4,1 • 10-12/л, л. 12,2 *109/л, нейтрофильный сдвиг отсутствует. Биохимический анализ крови (см. табл. 2): существенная динамика повышения активности ферментов (АЛТ в 3 раза, АСТ в 4 раза), незначительное снижение уровня свободного гемоглобина, содержание которого в плазме крови уменьшилось на 39% от исходного уровня и двукратное по сравнению с нормой повышение концентрации миоглобина (130 нг/мл). Анализ мочи: сохраняется гемоглобинурия (0,45 г/л), миоглобинурия. Учитывая наличие энцефалопатии и сопорозного сознания, приняли решение о продолжении ИВЛ в режиме вспомогательной вентиляции (PS с давлением поддержки 10—12 см вод. ст.), а также о сохранении прежнего объема и характера сред для инфузионной терапии. Объем инфузионной терапии за сутки (08.08.16) составил 1300 мл (ремаксол 400 мл 2 раза, 10% раствор глюкозы 500 мл, стерофундин 500 мл) + энтеральное питание 1000 мл. Диурез 1200 мл. Анализ мочи: реакция кислая, плотность 1024, гемоглобин и миоглобин отсутствуют. Водный баланс с учетом перспирации составил 400 мл.
Утром 09.08.16 пациент экстубирован при удовлетворительных анализах газов крови и уровне сознания 13—14 баллов по шкале комы Глазго. Функция дыхания не страдает, SaO2 98% при дыхании атмосферным воздухом. Нормотермия (36,7°C). Гемодинамика устойчивая, АД 135/70 мм рт. ст., ЧСС 88 в минуту, ЦВД 7 см вод. ст. Клинических признаков дегидратации нет. Биохимический анализ крови: произошла нормализация параметров гемостаза, но сохраняются признаки гепато- и нефропатии. Лабораторных признаков гемолиза и рабдомиолиза нет. Отмечается динамичный рост активности трансаминаз (АЛТ незначительно, а АСТ в 9 раз от исходного). Концентрации электролитов (Na+, K+) в пределах нормальных параметров. Продолжено энтеральное питание в объеме 1000 мл через зонд. В программе инфузионной терапии сохранялось только введение ремаксола 800 мл в сутки дробно по 400 мл через 12 ч. Диурез составил 1300 мл. Водный баланс 600 мл.
В период с 10.08 по 12.08.16 отмечаются стабилизация и положительная динамика общего состояния и существенное уменьшение тяжести гепато- и нефропатии. В удовлетворительном состоянии 15.08.16 пациент переведен в профильное отделение на 8-е сутки пребывания в отделении реанимации и интенсивной терапии с умеренными признаками гепатопатии. Пациент выписан из клиники 21.08.16 без признаков гепато- и нефропатии.
Обсуждение
Как следует из данных литературы, тепловой удар и физическое перенапряжение во время марафона могут привести к развитию критического состояния с вовлечением центральной нервной системы в виде коматозного состояния, печеночно-почечной дисфункции, гемолиза и рабдомиолиза, аритмии, синдрома диссеминированного внутрисосудистого свертывания [6], что нередко заканчивается смертью.
Механизм подобного патофизиологического сценария полиорганной недостаточности по-прежнему неясен, но большинство авторов склонны считать, что первопричиной развития критического инцидента в приведенном наблюдении следует считать гипоксию, последующее истощение метаболических ресурсов процессов тканевого дыхания, что влечет повреждение клеток головного мозга, сердца, печени и почек [5, 7].
Развитие выраженного гемолиза в условиях марафона связано с тем, что эритроциты становятся гораздо более уязвимыми для окислительного повреждения во время интенсивной физической нагрузки из-за постоянного воздействия высокой концентрации кислорода, потребление которого в мышцах спортсмена прогрессивно уменьшается с длительностью дистанции [5, 7]. Окислительный стресс усугубляется на фоне появления в плазме крови свободного гемоглобина и железа гема [8]. Эритроциты, имеющие изменения, полученные в результате окислительного повреждения, в настоящее время рассматриваются как мощный индуктор многих болезней и патофизиологических состояний [9—11].
Таким образом, тяжесть описанного критического инцидента обусловлена гипоксией многих органов вследствие сочетания гипертермии, недостаточного поступления кислорода, повреждения эритроцитов как его носителей и окислительного стресса на уровне митохондрий, что обеспечивает процессы тканевого дыхания с максимальным проявлением патологического процесса в печени.
Сегодня общепризнано, что тканевое дыхание тесно связано с сукцинатом, который является энергетическим ресурсом, обеспечивающим всю дыхательную цепь митохондрий во всех органах, и печень не является исключением [12]. Напротив, тяжесть наиболее выраженного у пациента синдрома — печеночной недостаточности — обусловлена, на наш взгляд, расстройством механизмов переаминирования, что подтверждается повышением активности АЛТ и АСТ. Янтарная кислота (сукцинат) является наиболее важным субстратом, используемым организмом при гипоксии, которая синтезируется из а-глутаровой кислоты, поставщиком которого является глутамин (глутамат). Кроме того, синтез янтарной кислоты может происходить и путем переаминирования аспартата и аланина, так как они являются в свою очередь поставщиками глутамата. Аспартат метаболизируется в оксалацетат, который превращается (через фумарат и малат) в сукцинат с выделением 1 моль АТФ на 1 моль сукцината в анаэробных условиях.
Также известно, что поддержание анаэробного образования сукцината благотворно сказывается на функции митохондрий, сохраняя превращение субстратов и дыхательных переносчиков, что в свою очередь обеспечивает интенсивное функционирование ферментных систем цикла Кребса и связанных с ним трансаминаз [13]. Все это способствует динамической стабилизации митохондрий во время анаэробиоза, который, безусловно, имеет место у марафонца.
Таким образом, механизм переаминирования субстратов азотистого и углеводного обмена тесно связан с процессом тканевого дыхания и энергообмена за счет синтеза сукцината при гипоксии, когда исходными субстратами являются оксалацетат, а-кетоглутарат и продукты переаминирования аминокислот (аланин и глутамин) [14].
Повышение активности АСТ и АЛТ в сыворотке крови пациента не является только следствием цитолиза гепатоцита ввиду «агрессии» свободного гемоглобина и миоглобина [11]. Высокий уровень ферментов указывает в первую очередь на перенапряжение обменных процессов в клетках печени, так как гепатоциты вынуждены усиленно работать для обеспечения адекватного термогенеза. Уже давно известен факт, что нас «греет» печень, которая предпочитает использовать для энергообмена белковое сырье, т. е. переаминирование аминокислот. Поэтому рост активности АСТ и АЛТ — это не печеночная или сердечная патология, а показатель интенсификации механизмов для поддержания энергообмена, и чем выше активность ферментов, тем глубже гипоксия не только в печени, но и в других тканях, например в мышцах, что подтверждается высоким уровнем и миоглобина, и тропонина у пациента как при поступлении, так и в течение первых 2—3 сут интенсивной терапии.
Назначение ремаксола, как в приведенном клиническом наблюдении, привело к динамичному снижению активности АСТ и АЛТ за счет введения экзогенного сукцината и уменьшения «затрат» ферментов на синтез сукцината при гипоксии из аминокислот аспартата и аланина. В данном случае использование у пациента ремаксола продиктовано его патогенетической необходимостью и носит заместительный характер. Интенсификация физической нагрузки всегда сопровождается изменениями функционирования дыхательной (в первую очередь), сердечно-сосудистой, вегетативной и костно-мышечной систем, что приводит к нарушениям тканевой перфузии и тканевой гипоксии, переходу метаболических процессов на анаэробный путь и большим «затратам» сукцината (синтезированного за счет переаминирования) на обеспечение тканевого дыхания [1, 2, 12, 14].
Приведенное клиническое наблюдение является подтверждением не столько гепатопротекторного эффекта ремаксола [13], сколько его антигипоксантного и органопротекторного действия, обеспечивающего восстановление механизмов адекватного переаминирования и окислительного фосфорилирования гепатоцитов, пострадавших в условиях гипоксии, окислительного стресса и гипертермии [15].
В недавнем экспериментальном исследовании J. Ehinger и соавт. выявлено, что экзогенно введенный сукцинат обходит участок I дыхательной цепи и поддерживает не только электронный транспорт участка II (как наиболее востребованного в условиях гипоксии), но и мембранный потенциал и синтез АТФ. Эта стратегия предлагается авторами как потенциальное будущее терапии метаболической декомпенсации различных органов из-за митохондриальной дисфункции [16].
Клинический пример еще раз подтверждает необходимость использования препаратов янтарной кислоты в медицине критических состояний, так как гипоксия при указанных состояниях присутствует всегда и именно она определяет степень повреждения многих органов. Использование ремаксола в приведенном клиническом наблюдении является вариантом активации субстратного фосфорилирования за счет введения экзогенного сукцината, что позволяет затормозить энергетический дефицит в митохондриях в условиях недостаточного содержания кислорода. Приведенное клиническое наблюдение может быть рассмотрено как вариант коррекции митохондриальной дисфункции с помощью митохондриально-адресованного препарата, каковым является ремаксол, содержащий в своей структуре сукцинат — наиболее востребованный субстрат в условиях гипоксии.
ЛИТЕРАТУРА (остальные источники см. в REFERENCES)
1. Sherman W.M., Costill D.L., Fink W.J., Hagerman F.C., Armstrong L.E. et al. Effect of a 42.2-km footrace and subsequent rest or exercise on muscle glycogen and enzymes. J. Appl. Physiol. 1983; 55: 1219—24.
2. Callow M., Morton A., Guppy M. Marathon fatigue: the role of plasma fatty acids, muscle glycogen and blood glucose. Eur. J. Appl. Physio.l Occup. Physiol. 1986; 55: 654—61.
3. Coso J.D., Gonzalez-Millan C., Salinero J.J., Abian-Vicen J., Soriano L. et al. Muscle damage and its relationship with muscle fatigue during a halfiron triathlon. PLoS One. 2012; 7(8):.e43280.
4. Nybo L. CNS fatigue and prolonged exercise: effect of glucose supplementation. Med. Sci. Sports Exerc. 2003; 35: 589—94.
5. Westerblad H., Allen D.G. Emerging roles of ROS/RNS in muscle function and fatigue. Antioxid. Redox. Signal. 2011; 15: 2487—99.
6. Sawka M.N., Cheuvront S.N., Kenefick R.W. Hypohydration and Human Performance: Impact of Environment and Physiological Mechanisms. Sports Med. 2015; 45(Suppl. 1): 51—60.
7. Coso J.D. Running pace decrease during a marathon is positively related to blood markers of muscle damage. PLoS One. 2013; 8(2): e57602.
8. Weigand K., Riediger C., Stremmel W., Flechtenmacher C., Encke J. Are heat stroke and physical exhaustion underestimated causes of acute hepatic failure? World J. Gastroenterol. 2007; 13(2): 306—9.
9. Smith J.A. Exercise, training and red blood cell turnover. Sports Med.. 1995; 19(1): 9—31.
10. Rifkind J.M., Mohanty J.G., Nagababu E. The pathophysiology of extracellular hemoglobin associated with enhanced oxidative reactions. Front. Physiol. 2015: 5; article 500.
11. Orlov Yu.P. Intravascular hemolysis in the development of organ dysfunction in critical conditions. Obshchaya reanimatologiya. 2008; 4(2): 88. (in Russian)
11. Орлов Ю.П. Внутрисосудистый гемолиз эритроцитов в развитии органных дисфункций при критических состояниях. Общая реаниматология. 2008; 4(2): 88.
12. Luk'yanova L.D. Modern problems of adaptation to hypoxia. Signal mechanisms and their role in system regulation. Pat. fiziol. 2011; (1): 3—19. (in Russian)
12. Лукьянова Л.Д. Современные проблемы адаптации к гипоксии. Сигнальные механизмы и их роль в системной регуляции. Пат. физиол. 2011; (1): 3—19.
13. Mazina N.K., Mazin P.V. Metaanalytical approach to assessing the clinical effectiveness of infusion succinaldehyde drug remaxol in liver pathology of different genesis. Antibiotiki i khimioter. 2015; 60(11—12): 43—9.(in Russian)
13. Мазина Н.К., Мазин П.В. Метааналитический подход к оценке клинической эффективности инфузионного сукцинатсодержащего препарата ремаксол при патологии печени разного генеза. Антибиотики и химиотер. 2015; 60(11—22): 43—9.
14. Braunshtein A.E., Kritsman M.G. the Formation of amino acids by intermolecular transfer of an amino group. Message I. the Transformation of glutamic acid in muscle tissue. Biokhimiya. 1937: 2(2); @. (in Russian)
14. Браунштейн А.Е., Крицман М.Г.Образование аминокислот путем интрамолекулярного переноса аминогруппы. Сообщение I. Превращения глутаминовой кислоты в мышечной ткани. Биохимия. 1937; 2(2): @.
15. Shidlovskiy A.S., Saltanov A.I. alteration of transaminases: in clinical interpretation. Vestnik intensivnoy terapii. 2015; (1): 22—32. (in Russian)
15. Шидловский А.С., Салтанов А.И. Варианты изменения активности трансаминаз: клиническая интерпретация. Вестник интенсивной терапии 2015; (1): 22—32.
16. Ehinger J.K., Piel S., Ford R., Karlsson M. Cell-permeable succinate prodrugs bypass mitochondrial complex I deficiency. Nat. Commun. 2016; 7: 12317.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
 www.polysan.ru
www.polysan.ru www.polysan.ru
www.polysan.ru