Железодефицитная анемия при заболеваниях желудочно-кишечного тракта
СтатьиОпубликовано в журнале:
«ФАРМАТЕКА»; Актуальные обзоры; № 13; 2012; стр. 9-14.
Д.Т. Абдурахманов
Кафедра терапии и профболезней ГБОУ ВПО "Первый МГМУ им. И.М. Сеченова" Минздравсоцразвития РФ, Москва
Обсуждается проблема железодефицитной анемии (ЖДА), развивающейся в т. ч. при заболеваниях желудочно-кишечного тракта. Представлены сведения, касающиеся причин возникновения ЖДА, патогенеза, симптоматики, диагностики и лечения данной патологии. Особое внимание уделено препарату Феринжект (железа карбоксимальтозат), который применяется в комплексной терапии пациентов с ЖДА, обусловленной воспалительными заболеваниями кишечника.
Ключевые слова: железодефицитная анемия, дефицит железа, ферротерапия, железа карбоксимальтозат
The article discusses the problem of iron deficiency anemia (IDA), which develops against the background of many diseases, including gastrointestinal diseases. The data on the causes of IDA, pathogenesis, symptoms, diagnosis and treatment of this disease are presented. Particular attention is paid to the drug Ferinject (ferric carboxymaltosate) used for the treatment of IDA in patients with inflammatory bowel diseases.
Key words: iron deficiency anemia, iron deficiency, ferrotherapy, ferric carboxymaltosate
Наиболее частая в популяции причина анемии — дефицит железа в организме. По данным отчета Всемирной организации здравоохранения (ВОЗ) о состоянии здоровья за 2002 г., железодефицитная анемия (ЖДА) входит в десятку глобальных факторов риска развития нетрудоспособности. Так, показано, что ЖДА встречается среди 30 % населения планеты [1]. В США ЖДА наблюдается среди 5-12 % небеременных женщин и 1-5 % мужчин [2].
Метаболизм железа в организме
Общее количество железа в организме взрослого человека составляет около 3,5-4,0 г, в среднем 50 и 40 мг/кг у мужчин и женщин соответственно. Основная часть железа входит в состав гемоглобина эритроцитов (около 2,5 г), значительная часть железа (около 0,5—1,0 г) депонируется в составе ферритина или входит в состав гемсодержащих и других ферментов (миоглобина, каталазы, цитохромов) организма (около 0,4 г) и небольшая часть железа (0,003—0,007 г) находится в связанном с трансферрином состоянии в крови.
Баланс железа в организме поддерживается соответствием количества поступающего железа его потерям. В пище железо присутствует в составе гема или как негемовое железо. Ежедневно с пищей (стандартный пищевой рацион) в организм человека поступает 10—20 мг железа, из которого в норме в кишечнике всасывается около 10 % (от 3 до 15 %), что компенсирует суточные потери железа, главным образом при слущивании эпителиальных клеток. Организм обеспечивает баланс железа в организме, регулируя процесс его всасывания в кишечнике. В случае развития дефицита железа организм увеличивает процент всасываемого железа (может достигать 25 %), при избытке — уменьшает [3]. В этом процессе ключевое значение придают гепсидину — белку, который синтезируется в печени. Поступление с пищей или выведение железа, как правило, вне контроля организма.
Около 25—30 мг железа ежедневно реутилизируется после разрушения (вследствие старения) эритроцитов в селезенке и поступает снова в костный мозг для синтеза новых эритроцитов. Железо, которое всасывается в кишечнике, предварительно на поверхности энтероцита восстанавливается с участием ферроредуктаз из трехвалентного (Fe3+) в двухвалентнтное (Fe2+), затем с помощью специфического переносчика — транспортера двухвалентных металлов (DMT1) поступает в цитоплазму [4]. Железо в составе гема (содержится в мясе, рыбе) всасывается напрямую. В дальнейшем двухвалентное железо с помощью другого переносчика, ферропортина (также мобилизует железо из ферритина), секретируется в кровь, где снова окисляется до трехвалентного (при участии белка гефестина) и связывается с плазменным белком трансферрином [5]. Трансферрин осуществляет транспорт железа в костный мозг, где оно утилизируется для синтеза эритроцитов, или преимущественно в печень, где железо депонируется в составе ферритина (рис. 1) [6].
При снижении запасов железа, гипоксии, анемии, усиленном эритропоэзе в печени снижается синтез гепсидина, что усиливает всасывание железа в кишечнике, при хроническом воспалении синтез гепсидина в печени увеличивается и, соответственно, всасывание железа в кишечнике снижается.
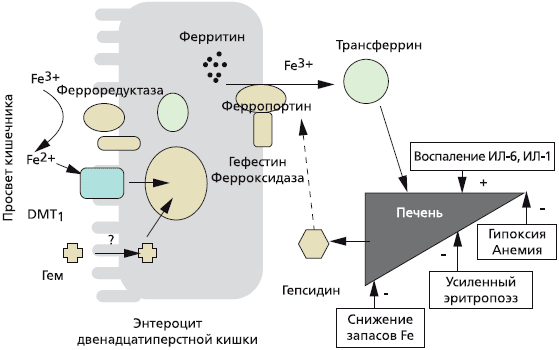
Рис 1. Регуляция всасывания железа в кишечнике [Guidi G.C., Santonastaso C.L., 2010]
Ферритин — ключевой белок, отражающий запасы железа в организме. Он депонирует железо в нетоксической форме, которое при необходимости мобилизуется. В среднем одна молекула ферритина содержит до 4500 атомов железа. Главным образом железо депонируется в печени, костном мозге и селезенке. Снижение уровня ферритина в сыворотке крови является достаточно надежным показателем дефицита железа в организме, его увеличение, как правило, указывает на перегрузку организма железом. В то же время необходимо помнить, что ферритин относится к белкам острой фазы воспаления, поэтому увеличение его содержания в крови может быть следствием активного воспалительного процесса, а не телько избытка железа. В ряде случаев некоторые злокачественные опухоли обладают способностью синтезировать и секретировать в кровь большое количество ферритина (в рамках паранеопластического синдрома). В норме содержание ферритина в сыворотке крови составляет 30-300 нг/мл.
Причины железодефицитной анемии
Выделяют три глобальные причины развития дефицита железа в организме (рис. 2):
1. Недостаточное поступление с пищей или повышенная потребность.
2. Нарушение всасывания железа в кишечнике.
3. Хронические потери крови.
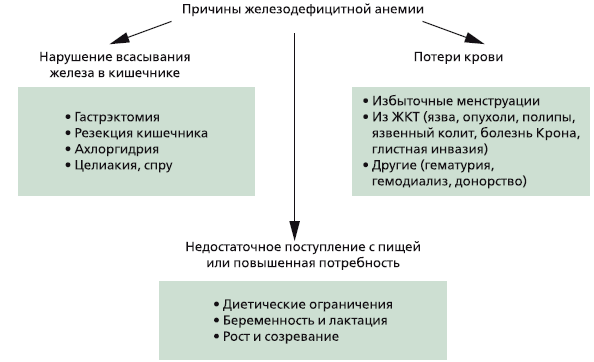
Рис 2. Основные причины железодефицитной анемии
В популяции наиболее частой причиной ЖДА является недостаточное поступление с пищей: по данным ВОЗ, от четверти до трети населения в мире хронически голодают из-за нехватки продуктов питания, особенно мясной пищи. Однако в клинической практике среди основных причин ЖДА выделяют хронические потери крови, прежде всего из желудочно-кишечного тракта.
Клиническая картина
При ЖДА наблюдаются общие для всех анемий проявления циркуляторно-гипоксического синдрома:
Кроме того могут встречаться специфические признаки тканевого дефицита железа:
Диагностика
Лабораторная диагностика ЖДА основана на изучении обмена железа и выявлении его дефицита. Выделяют ряд признаков, указывающих на железодефицитный характер анемии (табл. 1).
Таблица 1
Лабораторные признаки дефицита железа и ЖДА
| Параметры | Значения при ЖДА | Норма |
| Железо сыворотки, мкг/дл | < 50 | 50-180 |
| Насыщение трансферрина железом, % | < 20 | 20-50 |
| Ферритин сыворотки, нг/мл | <15-30 | 30-300 |
| Средний объем эритроцита (MCV), мкм3 | < 80 | 80-100 |
| Гипохромные эритроциты, % | > 5 | < 5 |
| Ретикулоциты, тыс/мкл | < 40 | 40-100 |
| Растворимые рецепторы к трансферрину (sTfR), мг/л | Повышены | 0,76-1,76 |
ЖДА представляет собой классическую гипорегенераторную, микроцитарную и гипохромную анемию, но на ранних стадиях заболевания микроцитоз и гипохромия эритроцитов не выражены. ЖДА может иногда сопровождаться реактивным тромбоцитозом. Наиболее рутинными лабораторными признаками ЖДА являются снижение насыщения трансферрина железом (< 20 %) и уменьшение содержания железа (< 50 мкг/дл), а также ферритина (< 15 нг/мл) сыворотки. Поскольку ЖДА не развивается, пока запасы железа в костном мозге не исчерпаны, его наличие в костном мозге исключает дефицит железа как причину анемии. Исследование проводят с помощью железоспецифической окраски (берлинской лазурью) аспирата или биоптата костного мозга. Однако в клинической практике к этому методу верификации ЖДА прибегают редко, т. к. исследование костного мозга — болезненная и дорогостоящая процедура. Кроме того, часто встречаются ложноположительные и ложноотрицательные результаты.
Как правило, клинико-лабораторные проявления анемии (главным образом снижение гемоглобина) развиваются при потере организмом не менее 20— 30 % запасов железа.
Дифференциальный диагноз
ЖДА наиболее часто необходимо дифференцировать с анемией хронических заболеваний и талассемией. Кроме того, могут наблюдаться смешанные формы анемии (сочетание дефицита железа с дефицитом фолиевой кислоты и/или витамина В12, сочетание ЖДА и анемии хронических заболеваний и др.).
Выявление анемии, а также установление ее железодефицитного характера, как правило, в большинстве случаев не представляет сложностей. Наиболее трудным может оказаться установление причины дефицита железа, которое часто требует длительного дифференциально-диагностического поиска, но является необходимым условием успешного лечения и улучшения прогноза заболевания. Сам по себе дефицит железа и вызванная им анемия, как правило, не угрожают жизни больного (за исключением анемической комы, которая, впрочем, в настоящее время встречается достаточно редко). Организм достаточно хорошо адаптируется к развитию дефицита железа, и клинические проявления анемии обычно развиваются только при повышенных функциональных потребностях организма (стрессе, повышенной физической нагрузке, беременности, у девушек в период становления менструального цикла и др.). Поэтому очень часто анемия протекает бессимптомно и в большинстве случаев выявляется при случайном или профилактическом обследовании. Однако заболевания, которые обусловливают развитие ЖДА, в частности злокачественные опухоли, могут быть опасными, угрожающими здоровью и жизни пациента. Поэтому независимо от выраженности клинических проявлений и тяжести ЖДА выявление причины дефицита железа является обязательным условием полноценного обследования пациента.
ЖДА при заболеваниях желудочно-кишечного тракта
Заболевания желудочно-кишечного тракта (ЖКТ) являются одной из основных причин развития ЖДА, что обусловлено нарушением всасывания железа в кишечнике или его потерями вследствие эрозивно-язвенных, опухолевых или аутоиммунных воспалительных поражений слизистой оболочки кишечника (табл. 2) [7].
Таблица 2
Заболевания ЖКТ, сопровождающиеся развитием ЖДА [Zhu A. и соавт., 2010]
| Верхние отделы ЖКТ | Нижние отделы ЖКТ | Весь ЖКТ |
| Язва желудка Язва 12-перстной кишки Рак желудка Грыжа пищеводного отверстия Эрозивный эзофагит Эрозивный гастрит Целиакия Атрофический гастрит Хронический гастрит, ассоциированный с Helicobacter pylori Операции на желудке |
Аденома толстой кишки Рак толстой кишки Язвенный колит Идиопатическая язва слепой кишки |
Болезнь Крона Телеангиэктазии сосудов ЖКТ Застойная гастро- и колонопатия при портальной гипертензии Паразитарные инфекции НПВС-ассоциированные гастропатия и энтеропатия |
Среди причин ЖДА (почти 30-50 % всех случаев) прежде всего рассматривают острые или хронические кровопотери из ЖКТ. Основной причиной ЖДА у женщин до менопаузы являются беременность и менструации, у женщин после менопаузы и у мужчин — хронические (латентные) потери крови из ЖКТ. Анализ кала на скрытую кровь — основной скрининговый метод выявления скрытого желудочно-кишечного кровотечения (тест положительный при выделении не менее 10 мл крови в сутки). При потере не менее 30 мл крови в сутки тест на скрытую кровь бывает положительным в 93 % случаев [8]. Наиболее часто при хронической ЖДА и особенно в случаях положительного результата кала на скрытую кровь выполняют эзофагогастродуодено- (ЭФГДС) и колоноскопию. В 5-10 % случаев анемий, связанных с заболеваниями ЖКТ, при ЭФГДС и колоноскопии не удается выявить очага поражения [9]. В 25 % случаев это обусловлено небольшим размером пораженного участка, который обнаруживается при повторном осмотре, в остальных случаях необходимо обследование тонкой кишки. В последние годы наиболее часто для выявления источника кровотечения из тонкой кишки используется беспроводная капсульная эндоскопия.
В 10-17 % случаев причиной ЖДА у мужчин и женщин старше 40 лет являются онкологические заболевания ЖКТ; прежде всего колоректальный рак. ЖДА в течение длительного времени может быть единственным проявлением рака толстой кишки правосторонней локализации, при этом размер опухоли обычно превышает 3 см. Другая наиболее частая причина ЖДА -язвенная болезнь желудка и двенадцатиперстной кишки.
При скрытых кровопотерях, обусловленных поражением тонкой кишки, наиболее часто в возрасте до 40 лет выявляют опухоли (лимфому, карциноид, аденокарциному, полипоз), ангиоэктазию артерий (Dieulafoy’s поражение), целиакию и болезнь Крона, в возрасте старше 40 лет -патологию сосудов различной природы и прием НПВС.
У трети больных воспалительными заболеваниями кишечника (болезнь Крона, язвенный колит) выявляется анемия, имеющая сложный генез (сочетание ЖДА и анемии хронических заболеваний).
При этом дефицит железа становится следствием нескольких причин:
Лечение
Лечение ЖДА включает прежде всего устранение причины дефицита железа (если это возможно) и прием препаратов железа (ферротерапия). Существует более 100 различных препаратов железа, в РФ наиболее часто используют около 10-15 лекарственных форм.
Суточная терапевтическая доза элементарного железа при лечении ЖДА для взрослых составляет в среднем 100— 200 мг в 2—3 приема. Поливитаминные комплексы, содержащие железо, не рекомендуют в качестве лечения ЖДА, т. к. они содержат недостаточное количество железа либо оно плохо всасывается в кишечнике.
При адекватном лечении уже в течение первых 3 суток наблюдается увеличение числа ретикулоцитов в крови, на 7—10-й день отмечается ретикулоцитарный криз (пик ретикулоцитоза). К 3—4-й неделе лечения имеет место увеличение уровня гемоглобина на 20 г/л. Прием препаратов железа необходимо продолжать еще в течение 3—6 месяцев после нормализации уровня гемоглобина — пока насыщение трансферрина железом не превысит 30 % и концентрация ферритина не достигнет 50 нг/мл (показатель восстановления тканевых запасов железа).
Среди 20—30 % пациентов в результате приема препаратов железа отмечаются различные диспептические расстройства (тошнота, дискомфорт в эпигастрии, диарея или запор). Риск развития желудочно-кишечных расстройств можно снизить, принимая препарат во время еды или на ночь, а также при постепенном увеличении дозы.
Среди причин неэффективности пероральных форм железа рассматривают целый ряд факторов [10]:
недостаточное поступление железа;
нерегулярный прием препаратов железа;
недостаточное содержание железа в принимаемом препарате.
Нарушение всасывания железа:
Продолжающиеся потери крови или повышенная потребность в железе:
Сопутствующие заболевания или состояния:
Неправильный диагноз или наличие других причин анемии:
Выделяют следующие показания к парентеральному введению, преимущественно внутривенному, препаратов железа:
Основная опасность при парентеральном введении железа — развитие тяжелых аллергических реакций, включая анафилактических шок с летальным исходом, которые наблюдаются в 0,6—1,0 % случаев. Данные реакции, в основном, характерны для препаратов железа, содержащих декстран.
Среди парентеральных препаратов железа широкое распространение, особенно в комплексной терапии воспалительных заболеваний кишечника, получили сахарат железа и железа карбоксимальтозат (Феринжект), которые в отличие от декстрана железа ассоциируются с минимальным риском развития анафилактических и других аллергических реакций [11—13]. Так, в 2011 г. были опубликованы результаты рандомизированного контролируемого исследования применения железа карбоксимальтозата пациентами с железодефицитной анемией, обусловленной воспалительными заболеваниями кишечника (FERGIcor — a Randomized Controlled Trial on Ferric Carboxymaltose for Iron Deficiency Anemia in Inflammatory Bowel Disease) [14]. В исследовании сравнивали эффективность и безопасность нового режима фиксированной дозы железа карбоксимальтозата (Феринжекта) и индивидуально рассчитываемых доз сахарата железа (СЖ) для пациентов с воспалительными заболеваниями кишечника и ЖДА. В исследование были включены 485 пациентов с ЖДА (уровень ферритина < 100 мкг/л; гемоглобина [Hb] 7—12 г/дл [женщины] или 7—13 г/дл [мужчины]; легкая/умеренная или скрытая ЖДА) из 88 больниц и клиник 14 стран. Пациенты получали либо Феринжект максимально 3 инфузии по 1000 или 500 мг железа, либо СЖ в дозах, рассчитанных по формуле Ганзони (Ganzoni), до 11 инфузий по 200 мг железа. Первичной конечной точкой считали изменение уровня Hb на 2 г/дл и более; вторичными конечными точками были анемия и уровень железа к 12-й неделе исследования. Проанализированы результаты 240 пациентов, получавших Феринжект, и 235 пациентов, получавших СЖ. Среди больных группы Феринжект по сравнению с лицами, получавшими СЖ, был более выражен ответ на терапию по уровню гемоглобина: 150 (65,8 %) по сравнению со 118 (53,6 %); процентное различие — 12,2 (р = 0,004), или нормализации уровня гемоглобина: 166 (72,8 %) по сравнению со 136 (61,8 %); процентное различие — 11,0 (р = 0,015). Оба препарата к 12-й неделе исследования улучшали качество жизни пациентов. Исследуемые препараты хорошо переносились. Нежелательные явления, связанные с приемом препарата, согласовывались с уже имеющимися сведениями. Таким образом, более простой режим дозирования Феринжекта был наиболее эффективным и безопасным, он способствовал большей приверженности пациентов лечению.
Эффективность и безопасность Феринжекта при внутривенном введении были продемонстрированы при лечении ЖДА и в ряде других клинических ситуаций (у больных на гемодиализе, в послеродовом периоде, при тяжелом маточном кровотечении) [15-18].
Переливание компонентов крови (эритроцитарной массы) для лечения ЖДА применяется только при угрожающей жизни (анемической коме) или тяжелой анемии (Hb < 60 г/л), сопровождающейся признаками декомпенсации.
ЛИТЕРАТУРА
1. Gasche C, Lomer MC, Cavill I, Weiss G. Iron, anaemia, and inflammatory bowel diseases. Gut 2004;53:1190-97.
2. Clark SF. Iron deficiency anemia. Nutr Clin Pract 2008;23:128-41.
3. Alleyne M, Horne MK, Miller JL. Individualized treatment for iron-deficiency anemia in adults. Am J Med 2008;121:94348.
4. Simovich M, Hainsworth LN, Fields PA, et al. Localization of the iron transport proteins Mobilferrin and DMT-1 in the duodenum: the surprising role of mucin. Am J Hematol 2003;74:32-45.
5. Umbreit J. Iron deficiency: a concise review. Am J Hematol 2005;78:225-31.
6. Guidi GC, Santonastaso CL. Advancements in anemias related to chronic conditions. Clin Chem Lab Med 2010;48(9):1217-26.
7. Zhu A, Kaneshiro M, Kaunitz JD. Evaluation and Treatment of Iron Deficiency Anemia: A Gastroenterological Perspective. Dig Dis Sci 2010;55:548-59.
8. Stroehlein JR, Fairbanks VF, McGill DB, Go VL. Hemoccult detection of fecal occult blood quantitated by radioassay. Am J Dig Dis 1976;21;841-44.
9. Raju GS, Gerson L, Das A, Lewis B. American Gastroenterological Association (AGA) Institute technical review on obscure gastrointestinal bleeding. Gastroenterology 2007; 133:1697-717.
10. Pasricha SS, Flecknoe-Brown SC, Allen KJ, et al. Diagnosis and management of iron deficiency anaemia: a clinical update. MJA 2010; 193:525-32.
11. Kulnigg S, Stoinov S, Simanenkov V, et al. A novel intravenous iron formulation for treatment of anemia in inflammatory bowel disease: the ferric carboxymaltose (FERINJECT) randomized controlled trial. Am J Gastroenterol 2008;103:1182-92.
12. Erichsen K, Ulvik RJ, Nysaeter G, et al. Oral ferrous fumarate or intravenous iron sucrose for patients with inflammatory bowel disease. Scand J Gastroenterol 2005;40:1058-65.
13. Schroder O, Mickisch O, Seidler U, et al. Intravenous iron sucrose versus oral iron supplementation for the treatment of iron deficiency anemia in patients with inflammatory bowel diseaseea randomized, controlled, open-label, multicenter study. Am J Gastroenterol 2005;100:2503-509.
14. Evstatiev R, Marteau F, Iqbal T, et al. FERGIcor, a Randomized Controlled Trial on Ferric Carboxymaltose for Iron Deficiency Anemia in Inflammatory Bowel Disease. Gastroenterology 2011;141:846-53.
15. Van Wyck DB, Martens MG, Seid MH, et al. Intravenous ferric carboxymaltose compared with oral iron in the treatment of postpartum anemia: a randomized controlled trial. Obstet Gynecol 2007;110:267-78.
16. Van Wyck DB, Mangione A, Morrison J, et al. Large-dose intravenous ferric carboxymaltose injection for iron deficiency anemia in heavy uterine bleeding: a randomized, controlled trial. Transfusion 2009;49:2719-28.
17. Bailie GR. Efficacy and safety of ferric carboxymaltose in correcting iron-deficiency anemia: a review of randomized controlled trials across different indications. Arzneimittelforschung 2010;60:386-98.
18. Evenepoel P, Bako GC, Toma C. Intravenous (i.v.) ferric carboxymaltose (FCM) versus i.v. iron sucrose (ISC) in the treatment of iron deficiency anemia (IDA) in patients undergoing maintenance haemodialysis (HD). J Am Soc Nephrol Abstracts Issue 2009;20:665A.
Комментарии
ПРАКТИКА ПЕДИАТРА
