Диагностика рака предстательной железы
Статьи| »» Содержание | Б.П. Матвеев, Б.В. Бухаркин, В.Б. Матвеев |
Глава 4. Диагностика рака предстательной железы
Тщательно собранный анамнез помогает установить некоторые особенности заболевания. Симптомы рака предстательной железы, особенно дизурия, развиваются быстро. Иногда постепенно ухудшается общее состояние, больной жалуется на слабость, похудание. Внешний вид пациента изменяется только при далеко зашедшем опухолевом процессе. Истощение и выраженная бледность кожи наблюдаются редко. При осмотре следует обращать внимание на состояние лимфатических узлов, печени, почек, мочевого пузыря, определять количество остаточной мочи. При возникновении подозрения на рак предстательной железы в первую очередь принято проводить три необходимых исследования:
I. Пальцевое исследование простаты.
II. Определение уровня простато-специфического антигена (ПСА).
III. Ультразвуковое исследование (УЗИ) простаты, при показаниях -одновременно с биопсией.
Пальцевое исследование прямой кишки. Пальцевое исследование прямой кишки - самый простой, дешевый и безопасный метод диагностики рака предстательной железы. Однако результаты исследования во многом определяются размерами опухоли и ее локализацией. Пальпация железы осуществляется в коленно-локтевом положении больного, либо при лежании на правом боку. В результате пальпации врач может выявить следующие симптомы опухоли предстательной железы.
1. Ассиметричная предстательная железа.
2. Плотной или деревянистой консистенции части предстательной железы. Плотность может определяться в виде отдельных узлов, либо различной величины инфильтратов, вплоть до перехода их на стенки таза.
3. Неподвижность железы вследствие сращения ее с окружающими тканями.
4. Пальпируемые семенные пузырьки.
Данные, полученные при пальпации, не всегда легко интерпретировать, так как ложно положительный диагноз рака предстательной железы возможно поставить при следующих обстоятельствах:
1. Доброкачественная гиперплазия предстательной железы.
2. Камни предстательной железы.
3. Простатит.
4. Флеболиты стенки прямой кишки.
5. Полипы или рак прямой кишки.
6. Аномалии семенных пузырьков.
Результаты пальпации безусловно очень трудно дифференцировать от перечисленных заболеваний, но зато они являются вескими основаниями для дальнейшего обследования больного. В среднем только у одной трети случаев пальпируемых узлов предстательной железы впоследствии гистологически верифицируют рак простаты.
Определение уровня простато-специфического антигена (ПСА). Поскольку простато-специфический антиген имеет большое значение не только для диагностики, но и для лечения и прогноза рака предстательной железы, более подробно остановимся на этом маркере.
В скрининговых программах традиционно используют пороговый уровень в 4 нг/мл для всех возрастных групп. Использование предложенного уровня снижает количество ложно-положительных определений при гиперплазии предстательной железы.
Уровень ПСА в сыворотке крови может быть повышен по следующим причинам:
- рак простаты,
- доброкачественная гиперплазия простаты,
- наличие воспаления или инфекции в простате,
- ишемия или инфаркт простаты,
- эякуляция накануне исследования.
Диагностическая значимость почти всех опухолевых маркеров ограничена из-за ложно-положительных значений, наблюдаемых при некоторых незлокачественных патологиях. Длительно ведутся споры о том, оказывает ли пальпаторное обследование предстательной железы влияние на уровень ПСА в сыворотке. Некоторые авторы (Brawer et аl., 1988) считают, что такого влияния практически нет, другие наблюдали значительные изменения в уровне маркера после массажа простаты, хотя и не во всех случаях (Stamey et аl., 1987). С другой стороны, несомненно, инвазивные методы (трансуретральная биопсия или трансуретральная резекция простаты) приводят к значительному повышению сывороточного уровня ПСА. Stamey с соавторами (1987) в детальном исследовании показали, что при массаже простаты концентрация ПСА в сыворотке крови через 5 минут увеличивалась в 1.5-2 раза, и наиболее высокой была у больных с клиническими признаками гипертрофии. У больных, у которых массаж комбинировался с цистоскопией, ПСА увеличивался в 4 раза, а сразу же после биопсии перинеальных лимфоузлов и трансуретральной резекции - в 50-60 раз.
Из незлокачественной патологии предстательной железы простатиты острые или хронические могут приводить к значительному повышению ПСА (Dalton et аl., 1989). Доброкачественные гиперплазии могут давать высокую частоту ложно-положительных результатов, причем экспрессия антигена зависит от величины железы (Eicoreetal., 1987; Hudson et аl., 1989). Так Stamey с соавторами (1987) показали, что уровень ПСА у группы больных с гиперплазией предстательной железы перед операцией варьировал от 0.3 до 37 нг/мл и превышал уровень в 2.5 нг/мл у 86% тех больных, у которых вес резицированной ткани был от 6 до 36 грамм. Подсчитано, что концентрация ПСА в сыворотке больных с гиперплазией предстательной железы составляет 0.31 -0.2 нг/г гипертрофированной ткани. Частота ложноположительных значений при гиперплазии предстательной железы при пороговом уровне 4нг/мл по данным литературы колеблется от 20 до 55%.(Armitage et аl., 1988; Lange et аl., 1986; Hudson et аl., 1989). Другие авторы утверждают, что высокие значения ПСА при доброкачественных новообразованиях предстательной железы не так уж и редки.
Однако наибольшее значение определения ПСА безусловно имеет для диагностики рака предстательной железы. Следует отметить, что из трех основных исследований: определения ПСА, ректального и ультразвукового исследования предстательной железы - определение простато-специфического антигена имеет наименьшее количество ложноoтрицательных результатов и наибольшую специфичность. Серийный скрининг с применением ПСА в 2 раза увеличивает долю диагностики рака простаты в стадии Т1-Т2, в то время как пальцевое ректальное исследование выявляет лишь 30% гистологически подтвержденного рака той же стадии. До 90% рака простаты, выявляемого с помощью определения ПСА, приходится на поздние стадии заболевания. Чувствительность метода недостаточна для определения латентного, фокального, высокодифференцированного рака простаты. Так, Oesterling J. (1993) установил, что 20-40% всех злокачественных новообразований предстательной железы сопровождаются нормальной концентрацией ПСА в сыворотке крови. В то же время этот показатель при Т3-Т4 стадиях заболевания бывает положительным почти в 100% случаев.
При сравнении предоперационных уровней ПСА с результатами, полученными после простатэктомии, многие авторы отмечают высокую чувствительность и четкую корреляцию со стадией заболевания. Так из ряда работ (Stamey et аl., 1987, 1989), создается впечатление, что концентрация ПСА в сыворотке нелеченных больных пропорциональна объему опухоли в ткани простаты. Несмотря на определенную вариабильность предоперационных уровней ПСА у больных с клиническими стадиями А и В, показано, что его уровни ниже 15 нг/мл и выше 40 нг/мл являются достаточно четкими признаками отсутствия или наличия пенетрации капсулы, инвазии в семенные пузырьки и метастазов в тазовые лимфоузлы, хотя и при уровнях ПСА 15 нг/мл иногда возможна инвазия в капсулу железы.
Увеличение уровня ПСА до больших значений (около 20 нг/мл и выше) является высокоспецифичным даже при нормальных показателях ректального пальцевого исследования простаты. Поэтому при высоких цифрах ПСА биопсия предстательной железы должна проводится обязательно. Уровень ПСА более 50 нг/мл указывает на экстракапсулярную инвазию в 80% случаев и поражение регионарных лимфатических узлов у 66% больных (Stanley et аl., 1990). Исследования Rana et аl. (1992) показали, что результаты ПСА более 100 нг/мл указывают на 100% метастазирование (регионарное или отдаленное).
Наибольшие трудности возникают при интерпретации значений ПСА в диапазоне от 4 нг/мл до 20 нг/мл. Проведенные исследования свидетельствуют о том, что частота рака простаты у пациентов с концентрацией общего ПСА от 4 до 15 нг/мл и нормальными данными при пальцевом ректальном исследовании простаты достигает по разным данным от 27 до 37%.
Основным для клиницистов является осознание возможности выявления с помощью ПСА субклинических форм рака простаты без признаков экстра-капсулярной инвазии (стадии Т1 и Т2), когда возможно выполнение радикальной простатэктомии. По данным Myrtle et аl. (1986) показатели ПСА в сыворотке более 4 нг/мл наблюдались у 63% больных раком простаты стадии Т1 и у 71% - стадии Т2. В то же время, при экстракапсулярных поражениях (стадии Т3 и Т4) повышение ПСА наблюдалось в 88% случаев. В данной ситуации с целью более точной интерпретации повышенных значений общего ПСА весьма желательно исследование концентрации свободного ПСА и расчет соотношения "свободный ПСА/общий ПСА".
Помимо первичной диагностики рака простаты, определение ПСА широко применятся в следующих случаях:
1. После радикальной простатэктомии через несколько недель ПСА перестает определяться. Регулярные контрольные исследования (каждые 3 месяца) позволяют своевременно выявить рецидив заболевания в случае повышения ПСА. Если же показатели ПСА нормальны и нет клинических симптомов болезни, то исключаются другие исследования.
2. У больных, получавших лучевую терапию, отмечается значительное снижение уровня ПСА в сыворотке крови, что свидетельствует об эффективном лечении. В то же время, повышение ПСА говорит о малой чувствительности опухоли к проводимому лечению, либо о рецидиве заболевания. Следует отметить, что снижение ПСА до нормальных цифр коррелирует с уровнем антигена до лечения. Пациенты с показателями ПСА до лечения неболее 20 нг/мл имели нормальные показатели ПСА после лечения в 82% случаев. В то же время, у больных с более высокими цифрами ПСА до лечения этот процент составлял лишь 30%. Большинство пациентов со стабильным снижением ПСА оставались в ремиссии в течение последующих 3-5 лет.
3. Целесообразно определять ПСА у больных, получающих терапию антиандрогенами. Повышение уровня ПСА говорит о прогрессировании заболевания и о необходимости сменить характер лечения.
При антиандрогенном лечении уровень ПСА в сыворотке крови является точным индикатором успеха или неуспеха терапии. После начала терапии уровень ПСА быстро снижается у 50% больных (от 85 до 2.1 нг/мл), в то время как в отсутствие ответа величина ПСА не изменяется (Hudson et аl., 1989). Прогрессирование болезни наблюдалось в 50% случаев, когда уровень ПСА не снижался ниже 10 нг/мл. Это означает, что уровень ПСА не играет прогностического значения до начала терапии, в то время как в процессе лечения ПСА является хорошим индикатором эффективности терапии и хорошо коррелируется, как с выживаемостью, так и с длительностью ремиссии. Согласно Stainey (1989), повышение уровня ПСА через 6 месяцев после начала терапии может служить в качестве оценки чувствительности к проводимой терапии.
Ультразвуковая диагностика рака предстательной железы. Ультразвуковое исследование нашло очень широкое применение в диагностике многих заболеваний предстательной железы, в том числе и рака. Особенно интерес к исследованию проявился с введением трансректальной ультразвуковой томографии. Современные трансректальные ультразвуковые датчики обеспечивают очень высокое качество изображения и позволяют детально визуализировать структуру простаты, окружающих ее органов и тканей, а также прицельно взять биопсию из измененного участка железы. В норме неизмененная предстательная железа при ультразвуковом исследовании имеет треугольную форму. Основание железы обращено к прямой кишке, а верхушка - к шейке мочевого пузыря. Наибольший размер железы в поперечном направлении составляет 40-45 мм, в передне-заднем направлений он равен 20-27 мм, в продольном - 35-45 мм. На ультразвуковых томограммах различаются центральная и периферическая зоны простаты, которые обычно занимают большую часть предстательной железы. При ультразвуковом исследовании периферическая зона имеет однородную структуру и характеризуется отражениями средней интенсивности. Центральная зона расположена вокруг простатического отдела уретры, имеет ячеистую структуру, а по эхогенности ниже периферической зоны. При осмотре области шейки мочевого пузыря выделяется гипоэхогенная фибро-маскулярная строма, не содержащая желез, которая формирует переднюю часть простаты. Как считает В.Н. Шолохов (1997), с возрастом при развитии доброкачественной гиперплазии или при воспалительных заболеваниях центральная и периферическая зоны железы могут не дифференцироваться. Простатический отдел уретры выглядит в виде гипоэхогенного тяжа, проходящего в черную центральную зону железы.
Простата окружена перипростатической жировой клетчаткой и фасцией, которые формируют гиперэхогенный пограничный слой, который часто описывается как капсула железы. Истинная капсула простаты, если ее удается визуализировать, определяется в виде очень тонкой гипоэхогенной прерывистой линии по поверхности железы.
Семенные пузырьки визуализируются в виде симметричных гипоэхогенных тяжей, расположенных между простатой и мочевым пузырем размерами 2 х 7 см.
Как уже отмечалось выше, рак чаще всего развивается в периферической зоне простаты. Учитывая эту особенность, проще проводить дифференциальную диагностику с другими заболеваниями. Выявляемые структурные изменения, локализирующиеся в пределах центральной зоны, с большей вероятностью могут быть отнесены к проявлению доброкачественного процесса, в то время как обнаружение структурной перестройки, локализующейся в периферической зоне, чаще соответствует злокачественной опухоли.
Периферическая зона занимает 75% объема простаты, и в этой части железы рак возникает в 80% случаев. Большей частью опухоль располагается на глубине 3-4 мм от пограничною слоя. Центральная зона занимает около 20% объема железы. В этой части простаты развивается только 5% злокачественных новообразований. Вокруг простатического отдела уретры располагается тонкий участок железистой ткани - так называемая переходная зона. В норме она практически не дифференцируется от центральной зоны и занимает всего 5% объема простаты. В переходной зоне рак развивается в 20% случаев (Шолохов В.Н., 1997).
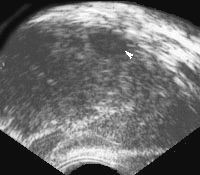
Наиболее характерными признаками рака простаты, локализующегося в периферической зоне, является наличие одного или нескольких узлов неправильной формы и пониженной эхогенности (рис. 4).
Рис. 4. Трансректальное исследование предстательной железы (продольная плоскость на границе периферической и переходной зоны), опухолевый узел (указан стрелкой) не выходящий за пределы органа. Признаков пенетрации капсулы нет.
Диагноз: рак предстательной железы.
Нередко узел окружен гиперэхогенным ободком, что объясняется фиброзной реакцией соединительной ткани предстательной железы, окружающей опухолевый очаг. По мере роста опухоли появляются бугристые контуры железы с признаками пенетрации пограничного слоя (рис. 5 и рис. 6).
Рис. 5. Рак предстательной железы. Опухолевый узел в периферической зоне левой доли, инфильтрирует заднебоковую поверхность железы и перипростатической клетчатки.
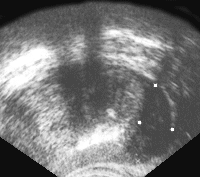
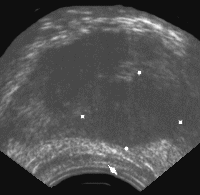
Рис. 6. Трансректальное исследование предстательной железы (поперечная плоскость). Опухолевый узел в периферической зоне левой доли. Отмечается деформация наружного контура железы, признаки пенетрации собственной капсулы. (Т3) Диагноз: рак предстательной железы.
Особенно большое значение имеет выявление инфильтрации по передне-боковой поверхности железы, которая недоступна пальцевому исследованию.
Наиболее сложными для диагностики являются опухоли, которые локализуются в центральной и переходной зонах железы. Зачастую, развиваясь на фоне доброкачественной гиперплазии, рак по эхогенности практически не отличается от окружающих тканей, в связи с чем нередко возникают диагностические ошибки, а диагноз устанавливается при гистологическом исследовании удаленного материала во время операции.
По мере увеличения опухолевой инфильтрации стромы железы меняется ее ультразвуковая структура. Ткань железы становится неоднородной, с беспорядочными отражениями низкой интенсивности. Ультразвуковая томография позволяет выявить инфильтрацию капсулы простаты, семенных пузырьков мочевого пузыря, стенки прямой кишки, лимфатических узлов, что, естественно, позволяет уточнить стадию заболевания.
В отличие от рака, гиперплазия предстательной железы обычно развивается в переходной зоне по направлению к внутренней части железы. При этом переходная зона начинает сдавливать центральную и периферическую зону, вызывая их постепенную атрофию. Из центральной и периферической зон и фибромышечных слоев формируется "хирургическая капсула", по которой происходит "вылущивание" гиперплазированных узлов при операции. По мере роста доброкачественной гиперплазии железа приобретает шаровидную форму; при преимущественном росте периуретральных желез отмечается выбухание контура железы в просвет мочевого пузыря и формируется средняя доля, которая растет, оттесняя кпереди и деформируя заднюю стенку мочевого пузыря, сдавливая в значительной степени простатическую уретру и шейку мочевого пузыря. Поскольку доброкачественная гиперплазия предстательной железы не характеризуется инфильтративным ростом, то капсула железы обычно четко прослеживается по периферии среза. Частыми находками при доброкачественной гиперплазии являются мелкие ретенционные кисты и кальцинаты, генез которых связан со сдавлением протоков железы гиперплазированной тканью; располагаются они чаще всего по т.н. хирургической капсуле. При ультразвуковом исследовании простаты порой возникает необходимость проводить дифференциальную диагностику с простатитом. Это вызвано тем, что пальпация предстательной железы при простатите иногда дает результаты, очень похожие на рак. Ультразвуковое исследование в стадии отека и инфильтрации железы выявляет: увеличение железы (рис. 7 и рис. 8), изменение ее формы (чаще шаровидная) и структуры. Снижается эхогенность железы, теряется эхографическая дифференциация железистых и фибромышечных зон.
Рис. 7. Трансректальное исследование предстательной железы (поперечная плоскость). Хронический простатит с участками кальцификации в железе.
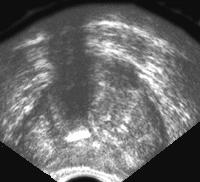
Рис. 8. Хронический простатит; усиление кровотока в ткани железы (режим энергетического Доплера).
При абсцедировании простатита - на фоне гипоэхогенной отечной ткани железы появляются анэхогенные зоны, соответствующие зонам некротических изменений. Постепенно происходит формирование стенки абсцесса в виде кистозной структуры с толстой стенкой и жидкостным неоднородным содержимым . При хроническом простатите эхоструктура железы может быть практически не изменена, либо выявляются диффузные повышенной эхогенности структуры в результате клеточной инфильтрации и склеротических изменений. Определяются кальцинаты и мелкие ретенционные кисты.
Описанные три основных метода диагностики в дальнейшем требуют обязательного морфологического подтверждения заболевания. С этой целью выполняется пункционная биопсия, которая наиболее достоверна при выполнении ее под контролем ультразвука. Особенно это касается обследования больных с малыми образованиями.
Биопсию предстательной железы можно производить через промежность, трансректально или трансуретральным доступом. Открытая биопсия применяется крайне редко. Трансуретральная резекция предстательной железы не только позволяет уточнить диагноз, но и обеспечивает восстановление мочеиспускания.
Трансвезикальная биопсия предстательной железы - вынужденная манипуляция у больных с подозреваемым раком предстательной железы, у которых в связи с острой задержкой мочеиспускания, обострением хронического пиелонефрита и высокой азотемией возникает срочная необходимость в проведении цистостомии.
В диагностике рака предстательной железы частота ложноотрицательных результатов гистологического анализа кусочков ткани при промежностном и трансректальном доступе не превышает 20%.
Осложнения пункционной биопсии встречаются крайне редко и могут быть связаны с повреждением мочевого пузыря и мочеиспускательного канала. Возможна гематурия, гематоспермия, промежностная и позадилобковая гематома. Для профилактики инфекционных осложнений, которые составляют около 2%, за сутки до биопсии и после нее назначают антибиотики.
В некоторых сложных случаях дифференциальной диагностики с успехом применяют цитологическую диагностику рака предстательной железы. Для цитологического исследования используют аспират из предстательной железы.
Цистоскопия является вспомогательным методом диагностики. При проведении цистоскопа может отмечаться девиация мочеиспускательного канала опухолевыми узлами. При цистоскопии удается обнаружить асимметричную деформацию шейки мочевого пузыря. В месте прорастания опухолью предстательной железы стенки мочевого пузыря определяется разрыхленность слизистой оболочки, фибриновые налеты, язвы или опухолевые разрастания, при этом трудно решить - прорастает ли опухоль из предстательной железы в мочевой пузырь или опухоль пузыря в железу.
Из методов диагностики рака предстательной железы заслуживает внимания рентгеновская компьютерная и магнитно-резонансная томография. Получаемая при этом информация соответствует таковой при ультразвуковом исследовании. На томограммах также видны структура предстательной железы, опухолевые узлы, их величина, степень прорастания капсулы, инфильтрация мочевого пузыря, семенных пузырьков, окружающей клетчатки. Эти методы, однако, оказались не более точными, чем трансректальное УЗИ при определении стадии ограниченного местного роста рака предстательной железы, и, более того, есть данные, что трансректальное ультразвуковое исследование дает более надежные результаты при оценке стадии заболевания.
Экскреторная урография позволяет оценить функцию почек и уродинамику верхних мочевых путей. Уретероэктазия и уретерогидронефроз являются следствием сдавления тазовых отделов мочеточников опухолью. Такие изменения часто бывают односторонними. При полной обструкции мочеточника происходит выключение почки, при этом тень рентгеноконтрастного вещества на стороне сдавления отсутствует.
Определение стадии заболевания. За установлением диагноза рака предстательной железы одновременно встает вопрос об установлении стадии заболевания, что в конце концов определяет характер будущего лечения. Кратко остановимся на возможностях применяемых методов исследования в установлении стадии заболевания.
Пальцевое исследование прямой кишки. Точность диагностики рака предстательной железы при пальцевом исследовании прямой кишки составляет 30-50%. Часто наблюдается недооценка стадии, поскольку небольшие, расположенные в передних отделах железы опухоли, как правило, не пальпируются; ложноположительные результаты наблюдаются у больных с гиперплазией предстательной железы и простатитом. Этот метод однако позволяет выявить рак предстательной железы, когда уровни ПСА остаются в пределах нормы, и предоставляют хотя не точные, но полезные данные о стадии заболевания. Пальпируемый неподвижный опухолевый инфильтрат или прорастание в кишку говорят о далеко зашедшем опухолевом процессе (Т4).
Определение простатического специфического антигена. При оценке отмечается достаточно четкая корреляция между уровнями ПСА и гистологической (и в меньшей степени клинической) стадией рака предстательной железы. У каждого конкретного больного корреляция не столь сильна из-за значительного перекрывания пределов различных возрастных норм. Уровни 10-20 нг/мл часто являются показателем опухоли, прорастающей за пределы капсулы предстательной железы, уровни выше 40 нг/мл свидетельствуют о наличии метастазов.
Хотя сывороточные уровни ПСА сами по себе не являются надежным показателем стадии заболевания, их можно использовать, чтобы избежать некоторых исследований. Выдвинуто предположение, что больным с вновь выявленным раком предстательной железы без симптомов поражения костей и при уровнях ПСА не выше 10 нг/мл не требуется проводить сцинтиграфию костей для определения стадии. У таких больных вероятность метастазов в костях приближается к нулю, хотя многие практические врачи считают этот метод исследования основным, так как при его помощи можно диагностировать "горячие точки", как например, остеоартроз позвоночника, который позже может создать путаницу в оценке симптомов. По данным Walsh et Partin (1994) при предоперационном ПСА < 4нг/мл и при сроке наблюдения 4 года у 92% больных не наблюдалось биохимического рецидива. При ПСА 4-10 нг/мл рецидива не было у 83% больных. При ПСА 10-20 нг/мл биохимического рецидива не было у 56%. И при ПСА > 20нг/мл рецидива не было только у 45%.
Казалось бы приведенные цифры убедительно показывают значимость ПСА для прогноза заболевания, но тем не менее надо принимать во внимание и другие исследования. По данным Элиса (1994) у 21% больных с ПСА < 4нг/мл был обнаружен рак, т.е., ПСА не является надежным критерием для установления стадии заболевания. На настоящий момент можно ориентироваться на следующие показатели ПСА. При ПСА свыше 40 нг/мл вероятность наличия метастазов в лимфатических узлах достигает 50%, поэтому выполнение тазовой лимфаденэктомии становиться необходимым. При ПСА < 10 нг/мл у нелеченных больных и показателе Глисона < 7 тазовая лимфаденэктомия может не выполняться.
Последнее время все чаще стали говорить об использовании ПСА в совокупности с показателем Глисона и пальцевого исследования простаты для диагностики лимфогенных метастазов. Например, если у больного определена клиническая стадия Т2а и число баллов Глисона - 3, при уровне ПСА 6 нг/мл ему не показана двусторонняя биопсия тазовых лимфоузлов для определения стадии, поскольку в этом случае вероятность метастазов в тазовых лимфоузлах приближается к нулю. Таким образом, ПСА - это ценный метод, который используется для оценки стадии в случаях вновь выявленного рака предстательной железы.
Ультразвуковое исследование предстательной железы. Возможности обычной трансабдоминальной эхографии ограничены: можно определить размеры железы, состояние капсулы, симметрию железы, объем остаточной мочи, однако выявление тонких изменений внутренней структуры железы и характера патологических изменений возможно только при поведении трасректального ультразвукового исследования.
При УЗИ основным диагностическим параметром является снижение эхогенности, но то же самое наблюдается и при других заболеваниях. Поэтому вероятность ошибки в установлении диагноза и соответственно стадии заболевания велика, особенно при небольших опухолях. Специфичность при диагностике рака предстательной железы составляет в среднем 20-30%.
Поиск метастазов при раке предстательной железы направлен на исследование регионарных лимфатических узлов и костей, где в первую очередь определяются метастазы. Диагностика лимфогенных метастазов в малом тазу сложна и имеется большая вероятность допущения ошибки (50-60%) даже при применении всех современных методов диагностики. Ультразвуковое исследование, рентгеновская компьютерная томография, магнитно-резонансовая томография - могут выявить метастазы, когда размер их превышает 2 см в диаметре, однако эти методы диагностики не позволяют обнаружить мелкие и микроскопические метастазы. Следует при этом отметить и то, что выявляемые увеличенные лимфатические узлы далеко не всегда поражены метастазами и при гистологическом исследовании находят только их гиперплазию.
Самая надежная информация получается после тазовой лимфаденэктомии, которая выполняется либо во время операции простатэктомии, либо как самостоятельное вмешательство.
Согласно Щуберту Е. и Венерту Е. (1985), путем тазовой лимфаденэктомии авторы выявили высокую частоту микрометастазов в тазовые лимфоузлы, которые не выявляются традиционными методами исследования. При этом гистологическое строение метастазов в лимфоузлах не всегда соответствовало строению первичной опухоли. Этим обуславливается необходимость лимфаденэктомии с гистологическим исследованием лимфоузлов методом ступенчатых срезов.
В последние годы тазовая лимфаденэктомия выполняется эндоскопически.
Сцинтиграфию костей, как правило, выполняют в случае вновь выявленного рака предстательной железы для оценки исходного состояния. Однако это метод при стандартном обследовании стали использовать реже, так как было доказано, что уровни ПСА являются более надежным диагностическим критерием при метастазах в кости; кроме того, последний метод дешевле. Таким образом, в 50% случаев рака предстательной железы при уровнях ПСА ниже 20 нг/мл сцинтиграфия костей считается не показанной.
Характерные изменения определяют при рентгенографии костей таза и поясничного отдела позвоночника, при их местатическом поражении, которые носят чаще остеобластический, реже остеолитический или смешанный характер. Вследствие чередования остеобластических и остеолитических участков, кости таза имеют пятнистый, мраморный вид.
Несмотря на применение всех современных методов диагностики рака предстательной железы все же допускается большой процент ошибок в установлении стадии заболевания. Как видно из приведенной таблицы 15 (данные Цинке, 1994), из 3170 больных правильное стадирование было только у 1497 больных (47%), после операции установлена стадия рТ3 у 1339 больных (42%) , метастазы в лимфатические узлы у 334 больных (11%), и опухоль по линии разреза была выявлена у 770 (24%) больных. В основном ошибки допускались в клиническх стадиях Т2b и с. Хотя ошибки были и при опухоли размерами Т1а и б. В большом проценте случаев клинически имеется занижение стадии болезни. Необходимо тщательное и полное предоперационное обследование. Тем не менее:
1) точное стадирование рака предстательной железы до операции ограничено;
2) у 20% больных с дооперационной стадией Т1а при гистологическом исследовании обнаруживают опухоль более 1 см3;
3) у 26% больных с дооперационным стадированием Т1б выявлена пенетрация капсулы, у 10% - инвазия семенных пузырьков;
4) у 37% больных с дооперационной стадией T1c найден распространенный рак (пенетрация капсулы), или опухоль по краю резекции, или инвазия семенных пузырьков, или наличие метастазов в регионарные лимфатические узлы).
Таблица 15. Ошибки клинического стадирования 3170 больных, подвергнутых радикальной простатэктомии по поводу клинически локализованного РПЖ (стадии Т2с и меньше) (Zincke et аl., 1994).
| Клиническая стадия | Число больных (%) | Паталогоанатомическая стадия | |||
| Ограничена предстательной железой | рТ3 | PN+ | Опухоль по линии резекции | ||
| Т1а | 49 (1.5%) | 44 (88%) | 4 (8%) | 1 (2%) | 2 (4%) |
| T1b | 177 (5,6%) | 120 (68%) | 46 (16%) | 11 (6%) | 35 (20%) |
| Т2а | 897 (28%) | 512 (57%) | 330 (37%) | 55 (6%) | 140 (16%) |
| T2b,с | 2047 (65%) | 82 (40%) | 959 (47%) | 267 (13%) | 593 (29%) |
| Всего: | 3170 (100%) | 1497 (47%) | 1339 (42%) | 334 (11%) | 770 (24%) |
Остановимся на значении степени дифференцировки опухоли и показателя Глисона. Каково их значение для решения вопроса о выборе метода лечения больного. Понятно, что целесообразность простатэктомии определяется:
1) наличие или отсутствие пенетрации опухолью капсулы простаты;
2) наличие опухоли по краю разреза;
3) по объему опухоли;
4) инвазия семенных пузырьков;
5) метастазы в лимфатических узлах.
При просмотре этих показателей у больных после простатэктомии в зависимости от показателей Глисона выяснилась прямая закономерность: чем меньше показатель Глисона, тем меньше вероятность большого распространения опухоли. И наоборот, чем больше показатель Глисона, тем больше вероятность распространения опухоли за пределы капсулы, тем больше вероятность рецидива опухоли (таб. 16).
Таблица 16. Корреляция между показателями Gleason и гистологическими данными простатэктомии.
| Гистологические данные | Gleason | |||
| 5 | 6 | 7 | 8-10 | |
| Пенетрация капсулы | 16% | 24% | 62% | 85% |
| Опухоль по краю разреза | 20% | 29% | 48% | 59% |
| Инвазия семенных пузырьков | 1% | 4% | 17% | 48% |
| Метастазы в лимфоузлы | 1% | 2% | 12% | 24% |
| Средний объем опухоли (см3) | 2.2 | 2.7 | 5.1 | 4 |
Так при показателе Глисона 8-10 пенетрация капсулы встречается чаще в 4 раза, чем при показателе 5, опухоль по краю разреза в 3 раза, объем опухоли больше в 2 раза, инвазия семенных пузырьков в 48 раз и метастазы в лимфатических узлах в 24 раза.
Исходя из приведенных данных можно сделать следующие выводы:
1. У больных с показателями Глисона 8-10 и метастазами в лимфатические узлы операция не целесообразна. Тем не менее, если больной все же оперируется с показателем Глисона 8-10 необходимо перед простатэктомией произвести срочное гистологическое исследование всех лимфатических узлов удаляемых во время тазовой лимфаденэктомии. При подтверждении метастазов простатэктомия не выполняется.
2. При показателе Глисона менее 8 лимфатические узлы можно исследовать в плановом порядке.
3. При показателе Глисона 7 больного следует оперировать.
4. При показателе Глисона менее 7 в зависимости от возраста, общего состояния больного можно наблюдать.
С целью подтверждения сказанного, в качестве примера, приведем данные Walsh (1993). Из 185 больных в стадии Т2, которым произведена простатэктомия - через 5 лет у 13% возникли рецидивы опухоли, а показатель Глисона у них был менее 7, в то время как у больных с показателем Глисона 7 прогрессирование опухоли отмечено у 59% больных.
Комментарии
ПРАКТИКА ПЕДИАТРА
