Эффективность применения Мексидола при констриктивно-стенотической артериопатии
Статьи Опубликовано в журнале:Стандарты лечения, №3,июнь, 2010 Н.Е. Иванова
Российский нейрохирургический институт им. проф. А.Л. Поленова
Ишемия головного мозга является одной из актуальных проблем современной ангиологии и нейрохирургии, так как к развитию как очаговой, так и диффузной ишемии могут приводить не только хорошо изученные цереброваскулярные заболевания, но и объемные процессы головного мозга, осложнения хирургических вмешательств (1,2).
Хроническая ишемия мозга - особая форма сосудистой церебральной патологии, обусловленная медленно прогрессирующей диффузной недостаточностью кровоснабжения мозговой ткани, приводящая к прогрессирующему ухудшению функционирования головного мозга. В отечественной литературе принято выделять три стадии хронической сосудистой мозговой недостаточности. В клинической практике мы, как правило, сталкиваемся со стадиями болезни (2, 3, 4).
При наличии хронической ишемии головного мозга особое внимание в настоящее время уделяется контролируемым и неконтролируемым факторам риска. Существенное значение имеют и те и другие факторы, особенно возраст и наследственность (неконтролируемые факторы). Контролируемые факторы риска - это артериальная гипертензия, болезни сердца, сахарный диабет, курение, метаболический синдром, прием оральных контрацептивов (5). Терапевтическая стратегия при лечении хронической ишемии мозга должна учитывать как наличие неконтролируемых факторов, так и значение и структуру контролируемых факторов риска. Выбор препаратов для лечения хронической ишемии мозга прежде всего должен быть ориентирован на определенные звенья патогенеза формирования ишемических изменений в головном мозге.
Большой арсенал медикаментов, которыми в настоящее время располагает врач-невролог, приводит к сложностям выбора именно тех, применение которых будет необходимо и достаточно для каждого конкретного пациента с учетом пола, возраста, стадии заболевания, а также наличия и выраженности контролируемых факторов риска (5, 6, 7, 8).
Ишемия головного мозга также гетерогенна по своей природе, как и ишемический инсульт. Но если механизмы формирования и перспективы лечения хронической ишемии мозга в достаточной степени изучены, то особенности развития и методы профилактики и борьбы с одной из форм острой ишемии, обусловленной констрикторно-стенотической артериопатией (КСА) при разрыве аневризмы головного мозга, требуют дальнейшего совершенствования.
Очаговая ишемия, которая развивается при внутричерепных кровоизлияниях из аневризм головного мозга, имеет свои закономерности развития и чаще всего возникает в бассейне "донорского" сосуда, т.е. сосуда, несущего аневризму. В дальнейшем вазоспазм КСА распространяется при полушарной локализации процесса на противоположный сосудистый бассейн, а затем - на вертебробазилярный.
Не существует прямых корреляций между степенью вазоспазма КСА и размерами очага церебральной ишемии, но чем более выражен вазоспазм, тем больше риск развития инфаркта мозга, хотя во многих случаях даже при III степени вазоспазма допплерографически и ангиографически верифицированной очаговой ишемии по данным КТ и МРТ не определяется.
В лечении нарушений мозгового кровообращения целесообразно использовать препараты, имеющие многофункциональные свойства, так как ишемический инсульт в анамнезе (4-5 лет до поступления в стационар). В большинстве наблюдений (89 человек) имелся стенозирующий процесс в бассейне внутренних сонных артерий (ВСА) в виде гладких и гетерогенных бляшек с сужением просвета сосуда менее 75% диаметра. В остальных наблюдениях (36 больных) имелась патология сосудов вертебробазилярного бассейна в виде сочетания стенозирующего процесса (степень стеноза - у 49 пациентов < 50% диаметра сосуда и у 76 < 75%) с патологической извитостью и гипоплазией позвоночных артерий. Следует отметить, что именно в группе пациентов с патологией вертебробазилярного бассейна отмечались дополнительные факторы риска в виде разомкнутости большого артериального круга мозга как в передних (n = 15, 12%), так и в задних отделах (n= 6, 4,9%), а также наличие аномалии Киммерли (n = 6, 4,9%).
По данным КТ и МРТ у 84 пациентов, имевших инсульт в анамнезе, отмечались рубцово-атрофические изменения в зоне, соответствующей перенесенному инсульту. У остальных пациентов (36 человек) выявлялись признаки умеренной заместительной гидроцефалии, множественные точечные очаги демиелинизации и нерезко выраженные кистозно-спаечные изменения субарахноидальных пространств головного мозга (у этих 36 больных). По данным ЭЭГ, имелось нерезко выраженная полушарная асимметрия (n = 88, 79,6%), ирритация диэнцефальных структур (n = 76, 60,8%) и заостренные формы биопотенциалов (n = 44, 35,7%). Грубых изменений биоэлектрической активности мозга не выявлялось.
Неврологическая симптоматика была представлена у пациентов с постинсультными нарушениями моно- и гемипарезами в пределах 3-4 баллов (n = 84, 100%), нарушением функций черепных нервов в виде асимметрии мимической мускулатуры по центральному типу (n = 84, 100%), в 15 наблюдениях имелось гомонимная гемианопсия и в 32 наблюдениях - умеренно выраженная смешанная форма афазии. Выявлялись также цефалгический и вестибуло-атаксический синдромы у 42 и 29 пациентов, соответственно. Во всех наблюдениях отмечалось умеренное снижение когнитивных функций на уровне 24-27 баллов по шкале MMSE. В контрольной группе было 29 наблюдений с последствиями перенесенного инсульта и хронической недостаточностью мозгового кровообращения. Основная и контрольная группы были сопоставимы по полу и возрасту, стадии и тяжести заболевания и характеру неврологической симптоматики, что позволило в дальнейшем проводить сравнительную оценку результатов лечения.
Препарат Мексидол применяли в I группе пациентов внутривенно капельно 1 раз в день по 500 мг (10 мл 5%-раствора) в течение 7-10 дней, затем препарат вводили внутримышечно по 250 мг 2 раза в день в течение 15 дней, после чего пациентов переводили на пероральный прием Мексидола по 125 мг 3 раза в день в течение месяца. Лечение проводили на фоне стандартизованной терапии (в том числе Нимодипин для лечения и профилактики вазоспазма) для пациентов с субарахноидальными кровоизлияниями.
Контрольная группа пациентов (15 наблюдений) получала только стандартизированную терапию.
Во II группе пациентов с хронической ишемией головного мозга, на фоне стандартной ноотропной и сердечно-сосудистой терапии Мексидол вводили внутривенно капельно в дозе 250 мг (5 мл 5%-раствора) в течение 7дней, затем осуществлялся переход на внутримышечное введение препарата в дозе 100 мг (2 мл 5%-раствора) 1 раз в сутки в течение 15 дней. Далее переходили на длительный пероральный прием препарата: 125 мг 3 раза в день в течение 2-х месяцев с перерывом на 1 месяц и повторным двухмесячным курсом.
Эффективность применения препарата оценивали с помощью шкалы MMSE и индекса Бартеля.
Как следует из рисунка 1, при оценке динамики когнитивных нарушений в 1 группе больных с отсроченной церебральной ишемией вследствие КСА в остром периоде разрыва аневризм головного мозга отмечена существенная динамика по сравнению с контрольной группой (p < 0,01) не только по степени регресса когнитивных нарушений, но и по темпу регресса.
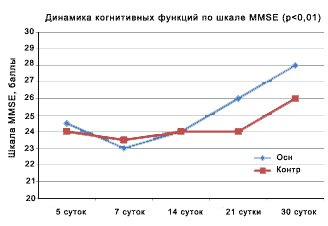
Рисунок 1. Динамика нарушений когнитивных функций по шкале MMSE после применения Мексидола при констрикторно-стенотической артериопатии в остром периоде разрыва аневризм головного мозга
