Алоглиптин в лечении пациентов с сахарным диабетом 2 типа
Статьи Опубликовано в журнале:
"Клинические обзоры в эндокринологии" № 4, декабрь 2014г.
Расширенный реферат статьи Seino Y., Yabe D. Alogliptin benzoate for the treatment of type 2 diabetes.
Expert Opin Pharmacother, 2014, 15 (6), 851-63.
Реферат подготовлен Т.Б. Моргуновой
Сахарный диабет 2 типа остается глобальной проблемой, требующей огромных затрат. Достижение целевых показателей гликемического контроля на фоне прима многих сахароснижающих препаратов сопровождается риском развития нежелательных явлений, таких как гипогликемия, прибавка веса или дискомфорт со стороны желудочно-кишечного тракта. Ингибиторы дипептидилпептидазы-4 (ингибиторы ДПП-4) являются новым классом пероральных сахароснижающих средств, а алоглиптин — новый препарат в этом классе. В статье описаны фармакокинетические и фармакодинамические свойства алоглиптина, представлены результаты клинической оценки его эффективности при назначении пациентам с сахарным диабетом 2 типа как в виде монотерапии, так и в комбинации с другими сахароснижающими препаратами. Также приведены сведения о его переносимости и безопасности.
1. Введение
Количество пациентов с сахарным диабетом (СД) 2 типа практически достигло масштабов эпидемии, и заболеваемость во всем мире продолжает расти [1, 2]. Микро- и макрососудистые осложнения СД 2 типа оказывают неблагоприятное воздействие на качество и продолжительность жизни пациентов [3, 4] и сопряжены со значительными затратами на здравоохранение [5-8].
В настоящее время, помимо модификации образа жизни, для снижения уровня глюкозы в крови используются разные классы сахаро-снижающих препаратов. В США и странах Европы в качестве препарата первой линии для лечения пациентов с СД 2 типа рекомендован метформин, что обусловлено его эффективностью и низкой стоимостью [9].
Однако СД — это прогрессирующее заболевание, и со временем большинству пациентов для достижения адекватного гликемического контроля потребуется назначение нескольких препаратов [10]. Возможно использование разных комбинаций сахароснижающих средств, и выбор в значительной степени будет определяться такими факторами, как предпочтения пациента, переносимость, кратность приема и стоимость препаратов [9, 11]. Так, применение ряда сахароснижающих средств сопряжено с риском развития нежелательных явлений, в частности гипогликемии, прибавки веса, дискомфорта со стороны желудочно-кишечного тракта и задержки жидкости, что может ограничить их использование в долгосрочной перспективе [9, 11]. Следует отметить, что применение ряда сахароснижающих препаратов ограничено при снижении функции почек [12]. Кроме того, патофизиологический процесс, лежащий в основе развития сахарного диабета, — нарушение секреции инсулина, и инсулинорезистентность может отличаться у пациентов [13–15]. Понимание особенностей заболевания у конкретного больного поможет выбрать оптимальную схему лечения сахарного диабета.
Одним из современных подходов к лечению сахарного диабета является применение ингибиторов дипептидилпептидазы-4 (ДПП-4), воздействующих через систему инкретинов [16–18]. Механизм действия ингибиторов ДПП-4 дополняет действие других сахароснижающих препаратов, что объясняет их широкое использование в комбинированной терапии [16, 17, 19]. Кроме того, переносимость препаратов этого класса, как правило, хорошая [20]. Они редко приводят к развитию гипогликемии, не влияют на вес и могут способствовать улучшению функции β-клеток поджелудочной железы [16, 17, 19, 21, 22]. Этот обзор посвящен препарату алоглиптину, одному из ингибиторов ДПП-4, его фармакодинамическим и фармакокинетическим свойствам, а также эффективности и безопасности его применения у пациентов с СД 2 типа.
1.1. Алоглиптин
Алоглиптина бензоат является сильнодействующим и высокоселективным ингибитором ДПП-4. Впервые он был зарегистрирован в Японии в 2010 г. для лечения взрослых с СД 2 типа, не достигших адекватного гликемического контроля на фоне диеты и физической нагрузки в качестве монотерапии или в сочетании с препаратом из класса ингибиторов α-глюкозидаз, тиазо-лидиндионов, препаратов сульфонилмочевины или метформина.
Позже, в 2013 г., препарат был зарегистрирован в США в монотерапии при неэффективности диеты и физических нагрузок, а также в Европе для применения в комбинированной терапии у пациентов с неадекватным ответом на терапию другими сахароснижающими препарами, диетой и физическими нагрузками. В США и Европе одобрены к применению две фиксированные комбинации: алоглиптин с метформином и алоглиптин с пиоглитазоном; фиксированная комбинация алоглиптина и пиоглитазона также применяется в Японии.
2. Фармакодинамика и фармакокинетика
2.1. Механизм действия и фармакодинамика
У пациентов с СД 2 типа сахароснижающее действие глюкагоноподобного пептида-1 (ГПП-1) — инкретина, секретируемого в желудочно-кишечном тракте, снижено [23]. Эндогенный ГПП-1 инактивируется ферментом ДПП-4, и ингибирование ДПП-4 замедляет деградацию эндогенного ГПП-1, тем самым пролонгируя его действие [23]. Алоглиптина бензоат — нековалентный ингибитор ДПП-4, он является мощным, высокоселективным препаратом; его селективность в отношении фермента ДПП-4 более чем в 10 тыс. раз выше, чем к ДПП-2, ДПП-8 и ДПП-9 [24, 25].
В доклинических исследованиях было показано, что алоглиптин за счет подавления активности ДПП-4 повышает и пролонгирует действие ГПП-1. На животных моделях диабета установлено, что алоглиптин дозозависимо ингибирует активность ДПП на 28–82 % и повышает уровень ГПП-1 в плазме в 3,2–6,4 раза после двух дней применения, а также снижает уровень глюкагона на 23–26 % спустя 4 недели [26]. Это приводило к улучшению толерантности к глюкозе, повышению секреции инсулина в первую фазу после пероральной нагрузки глюкозой, снижению уровня гликированного гемоглобина (HbA1c) и улучшению функции β-клеток [24, 26, 27]. Улучшение гликемического контроля зависело от степени ингибирования ДПП-4 [26]. Кроме того, алоглиптин улучшал толерантность к глюкозе у животных с резистентностью к производным сульфонилмочевины [28].
В исследованиях на животных установлено, что алоглиптин может оказывать антиатерогенное действие. На модели атеросклероза и инсулинорезистентности было показано, что применение алоглиптина приводит к уменьшению воспаления жировой ткани и сосудистой стенки, атеросклероза за счет подавления активации моноцитов и хемотаксиса [29]. Также на модели сахарного диабета было показано, что применение алоглиптина приводит к снижению экспрессии IL-6 и IL-1b в зоне атеросклеротических повреждений [30]. Кроме того, алоглиптин ингибирует экспрессию провоспалительных цитокинов мононуклеарами [30] и ослабляет внеклеточную киназо-опосредованную экспрессию металлопротеиназ-1 и 12, что может оказывать ингибирующее действие на воспаление, модулируемое макрофагами и ре-моделирование тканей [31].
2.2. Фармакокинетика и фармакодинамика
у человека После перорального приема алоглиптин быстро всасывается, достигая пиковых концентраций в плазме в среднем через 1–2 часа [25, 32]. Увеличение пиковой концентрации в плазме и площади под кривой «концентрация-время» происходит в диапазоне доз от 25 до 100 мг [25]. Прием пищи не оказывает существенного влияния на биодоступность алоглиптина [33]. После всасывания алоглиптин хорошо распределяется в тканях, средний объем распределения составляет 60,9 литра [34]. Алоглиптин медленно выводится; период полувыведения составляет 12–21 час. Препарат выводится преимущественно с мочой в неизмененном виде [25,32]. Средний клиренс составляет 165–254 мл/мин — это позволяет предположить, что препарат частично выводится за счет активной почечной экскреции [34]. Алоглиптин подвергается незначительному метаболизму с образованием двух метаболитов — M1, являющегося N-деметилированным, и М2, являющегося N-ацетилированным. Эти метаболиты составляют менее 2 и 6% от исходного вещества соответственно [25]. Возраст, расовая принадлежность и пол не оказывают значимого влияния на фармакокинетику препарата [35].
После однократного приема алоглиптина в дозе 25–800 мг у здоровых и применения препарата в течение 2 недель в дозах 25–400 мг/сут у пациентов с СД 2 типа в среднем ингибирование фермента ДПП-4 составляло 93–99 % [25, 32], и при применении любых доз препарата уровень ГПП-1 возрастал в 2–4 раза [35]. Ингибирование ДПП-4 не зависело от возраста, расовой принадлежности или пола пациента [35].
Фармакокинетический профиль алоглиптина и тот факт, что активность фермента ДПП-4 ингибируется более чем на 80 % в течение 24 часов после приема препарата [25, 32], позволяет рекомендовать прием алоглиптина один раз в сутки.
2.3. Взаимодействие с другими лекарственными средствами
В исследованиях клинически значимых взаимодействий между алоглиптином и другими сахароснижающими препаратами, такими как метформин [33], глибенкламид [36] и пиоглитазон [36], выявлено не было. Также не было выявлено значимого взаимодействия с ингибиторами CYP, такими как флуконазол, кетоконазол и гемфиброзил [37], или другими лекарственными средствами, в том числе с дигоксином [38], циклоспорином [39], норэтиндроном и этинилэстрадиолом [40], аторвастатином [41], варфарином [42] или циметидином [33].
3. Эффективность
Применение алоглиптина как в монотерапии (табл. 1), так и при добавлении к другим сахароснижающим препаратам (табл. 2) приводит к клинически значимому улучшению гликемического контроля у пациентов с СД 2 типа. По данным метаанализа рандомизированных контролируемых исследований, стандартизованная разность средних (SMD) снижения уровня HbA1c по сравнению с контрольной группой (с применением плацебо или препарата сравнения) составила -0,81 (95 % ДИ -1,11…–0,51) для алоглиптина 12,5 мг и -0,98 (95 % ДИ -1,30… -0,66) для алоглиптина 25 мг, в то время как отличия для глюкозы плазмы натощак (ГПН) составили -0,43 (95 % ДИ -0,68...– 0,34) [43].
Таблица 1.
Эффективность монотерапии алоглиптином у пациентов с СД 2 типа
| Исследование* (длительность) | Терапия (мг в день) | N | HbA1c, среднее (%) | Ответившие по уровню HbA1c (пациентов, %) | Глюкоза плазмы натощак, среднее (ммоль/л) | |||
|---|---|---|---|---|---|---|---|---|
| Исходно | Изменение среднего | Исходно | Изменение среднего | |||||
| Пациенты, США | ||||||||
| (26 недель); неудовлетворительный гликемический контроль на диете/физических нагрузках [45] | Алоглиптин 12,5 Алоглиптин 25 Плацебо | 133 131 65 | 7,9§ 7,9§ 7,9§ | -0,56** -0,59** -0,02 | 44,3# 47,4** 23,4 | 17,3 20,6 10,9 | NR NR NR | -0,57** -0,91** +0,63 |
| (1 год); пожилые, неудовлетворительный гликемический контроль на диете/физических нагрузках/монотерапии [46] | Алоглиптин 25 Глипизид 5 | 222 219 | 7,50 7,45 | -0,14§§ -0,09 | 49 45 | 22 18 | 8,21 7,99 | -0,11 -0,22 |
| Пациенты, Япония | ||||||||
| (12 недель); неудовлетворительный гликемический контроль на диете/физических нагрузках [44] | Алоглиптин 6,25 Алоглиптин 12,5 Алоглиптин 25 Алоглиптин 50 Воглибоза 0,6 Плацебо | 79 84 80 79 83 75 | 7,85 7,99 7,88 8,01 7,99 7,85 | -0,51Zz,{{ -0,70Zz,{{ -0,76Zz,{{ -0,82Zz,{{ -0,16 +0,06 | 29,1 35,7#,{{ 44,3#,{{ 38,0#,{{ 19,3 8,0 | NR NR NR NR NR NR | NR NR NR NR NR NR | -0,52# -0,81#,{{ -0,97#,{{ -1,25#,{{ -0,17 +0,31 |
| (3 месяца); впервые выявленный СД* [47] | Алоглиптин 12,5 — 25 Низкокалорийная диета{ | 25 26 | 10,51 10,01 | -1,77 -1,62 | NR NR | NR NR | 12,63 12,24 | -2,21 -9,95 |
| * Рандомизированные контролируемые исследования; все, кроме одного [47], были двойными слепыми. Z Первичная конечная точка. § Средний уровень исходно для всей когорты пациентов. { Традиционная японская диета со строгим ограничением калорийности. # p ** p Zz p §§ Исследование не меньшей эффективности исследуемого препарата по сравнению с контролем. {{ p HbA1c — гликированный гемоглобин; NR — не отмечено. | ||||||||
3.1. Монотерапия
По данным рандомизированных, плацебо-контролируемых исследований у пациентов с СД 2 типа, не достигших целевых значений гликемии на диете и физических нагрузках и не получавших ранее сахароснижающей терапии, назначение алоглиптина в дозе 6,25-50 мг приводит к значимому снижению уровня HbA1c по сравнению с плацебо через 12 [44] или 26 [45] недель лечения (табл. 1), при этом выраженное снижение уровня HbA1c отмечено уже после 4 недель терапии [45]. При применении алоглиптина в дозе 25 мг разница HbA1c по сравнению с группой плацебо составляла -0,57 и -0,76 % [44, 45]. Алоглиптин также приводит к значимому снижению уровня ГПН по сравнению с плацебо (табл. 1) [44, 45], причем отличия были значимыми уже через неделю после начала лечения [45].
В контролируемых исследованиях с применением препарата сравнения назначение алоглиптина через 12 недель приводило к значимому снижению уровней HbA1c и ГПН по сравнению с терапией воглибозой у пациентов с СД 2 типа, не достигших целевых значений гликемии на диете и физических нагрузках (табл. 1) [44]. Терапия алоглиптином была не менее эффективной по сравнению с глипизидом в отношении снижения HbA1c через год у пациентов пожилого возраста, не достигших целевых значений гликемического контроля на диете и физических нагрузках или монотерапии другими сахароснижающими препаратами (табл. 1) [46].
Наконец, в небольшом исследовании с участием пациентов с впервые выявленным сахарным диабетом было показано, что алоглиптин в дозе 12–25 мг также эффективно снижает уровень HbA1c, как и ранее доказавшая свою эффективность при СД 2 типа традиционная низкокалорийная японская диета (табл. 1) [47].
3.2. Комбинированная терапия
Пациентам, не достигшим целевых значений гликемии на предшествующей терапии, был добавлен алоглиптин к инсулину [48], метформину [49, 50], производным сульфонил-мочевины [51, 52], пиоглитазону [53, 54] или воглибозе [55]. У этих пациентов улучшение показателей гликемического контроля было более выраженным по сравнению с плацебо (т.е. при продолжении монотерапии) (табл. 2). В целом, с учетом динамики на плацебо, при добавлении алоглиптина в дозе 25 мг снижение уровня HbA1c составило от –0,4 до –1,0 %. В западной популяции пациентов при добавлении алоглиптина в дозе 25 мг уровень HbA1c1c 1c была значимо выше на фоне терапии алоглиптином по сравнению с плацебо. На рисунке представлены результаты одного из самых крупных 26-недельных исследований, в котором алоглиптин 25 мг был добавлен к терапии метформином [49].
По данным работ, выполненных в Японии, при использовании целевого уровня HbA1c1c, составила 7,7–50,6 % (на обеих дозировках показатели были значимо выше по сравнению с плацебо). В этих же исследованиях только 10 % пациентов достигли уровня HbA1c Помимо плацебо-контролируемых, были проведены исследования по комбинированной терапии с использованием препарата сравнения. В двухлетнем исследовании было показано, что пациентам, не достигшим адекватного гликемического контроля на монотерапии метформином, сахароснижающий эффект при добавлении алоглиптина в дозе 12,5 или 25 мг был не хуже, чем при назначении глипизида. Кроме того, большее число пациентов достигли целевого уровня HbA1cУ пациентов, не достигших адекватного гликемического контроля на терапии ингибитором α-глюкозидазы три раза в день, добавление алоглиптина к той же или меньшей дозировке ингибитора α-глюкозидазы приводило к значимому снижению уровня HbA1c по сравнению с исходным через 3 месяца (табл. 2) [57]. У пациентов с ожирением, не достигших целевых значений гликемии на фоне инсулинотерапии (с метформином или без него), добавление aлоглиптина без коррекции дозы инсулина привело к значимому по сравнению с добавлением плацебо снижению уровня HbA1c (табл. 2) [48].
В двух проведенных исследованиях оценивали тройную комбинацию пероральных сахароснижающих препаратов. При добавлении одновременно алоглиптина и пиоглитазона к монотерапии метформином через 26 недель было отмечено более выраженное улучшение гли-кемического контроля по сравнению с присоединением одного из этих препаратов [58]. Кроме того, добавление алоглиптина к комбинации метформина и пиоглитазона сопровождалось более выраженным улучшением гликемии через 52 недели, чем титрование дозы пиоглитазона [59].
Наконец, в исследовании по оценке эффективности комбинированной терапии в качестве стартовой у пациентов, ранее не получавших сахароснижающих препаратов и не достигших адекватного гликемического контроля на диете / физических нагрузках, было показано, что одновременное назначение алоглиптина 25 мг и пиоглитазона приводит к значимому снижению уровней HbA1c и ГПН по сравнению с монотерапией каждым из препаратов (табл. 2) [60].
Таблица 2.
Эффективность алоглиптина в комбинации с другими сахароснижающими препаратами
| Исследование* (длительность) | Терапия (мг в день) | N | HbA1c, среднее (%) | Ответившие по уровню HbA1c (пациентов, %) | Глюкоза плазмы натощак, среднее (ммоль/л) | |||
|---|---|---|---|---|---|---|---|---|
| Исходно | Изменение среднего | Исходно | Изменение среднего | |||||
| США/Европа | ||||||||
| 26 недель [49] | Алоглиптин 12,5 + метформин Алоглиптин 25 + метформин Плацебо + метформин | 213 210 104 | 7,9 7,9 8,0 | -0,6§§ -0,6§§ -0,1 | 52§§ 44§§ 18 | 20zz 17zz 4 | 9,3 9,5 10,0 | -1,0§§ -1,0§§ 0,0 |
| 104 недели§ [56] | Алоглиптин 12,5 + метформин Алоглиптин 25 + метформин Глипизид + метформин | 880 885 874 | 7,6 7,6 7,6 | -0,68zzz, § -0,68zzz, § -0,59 | 45,6 48,5zz 42,8 | NR NR NR | NR NR NR | -0,05§§§ -0,18§§§ +0,30 |
| 26 недель [51] | Алоглиптин 12,5 + глибенкламид Алоглиптин 25 + глибенкламид Плацебо + глибенкламид | 203 198 99 | 8,08 8,09 8,15 | -0,39§§ -0,53§§ +0,01 | 29,6 34,8zz 18,2 | 9,4 14,1 7,1 | NR NR NR | -0,26 -0,47 +0,12 |
| 26 недель [53] | Алоглиптин 12,5 + пиоглитазон ± метформин ± сульфонилмочевина Алоглиптин 25 + пиоглитазон ± метформин ± сульфонилмочевина Плацебо + пиоглитазон ± метформин ± сульфонилмочевина | 197 199 97 | 8,1 8,0 8,0 | -0,66§§ -0,80§§ -0,19 | 44,2zz 49,2zz 34,0 | NR NR NR | 9,4{ 9,4{ 9,5{ | -1,09zz -1,10zz -0,32 |
| 26 недель* [60] | Алоглиптин 12,5 + пиоглитазон Алоглиптин 25 + пиоглитазон Алоглиптин 25 Пиоглитазон | 163 164 164 163 | 8,8{ 8,8{ 8,8{ 8,8{ | -1,56## -1,71##,*** -0,96 -1,15 | 53,4## 62,8##,*** 24,4 33,7 | 26,4## 27,4*** 11,6 16,6 | 10,6* 10,6* 10,6* 10,6* | -0,27** -2,8##,*** -1,4 -2,1 |
| 26 недель [48] | Алоглиптин 12,5 + инсулин ± метформин Алоглиптин 25 + инсулин ± метформин Плацебо + инсулин ± метформин | 131 129 130 | 9,3 9,3 9,3 | -0,63{{ -0,71{{ -0,31 | NR NR NR | NR NR NR | 10,3 10,5 10,9 | -0,1 -0,6zz +0,3 |
| Япония | ||||||||
| 12 недель [50] | Алоглиптин 12,5 + метформин Алоглиптин 25 + метформин Плацебо + метформин | 92 96 100 | 7,89 8,02 8,00 | -0,55zz -0,64zz +0,21 | 28,3zz 27,1zz 2,0 | NR NR | NR NR NR | -1,05zz -1,28zz -0,04 |
| 12 недель [52] | Алоглиптин 12,5 + глимепирид Алоглиптин 25 + глимепирид Плацебо + глимепирид | 105 104 103 | 8,54 8,54 8,62 | -0,59{{ -0,65{{ +0,35 | 29,8zz 34,6zz 3,9 | 9,6zz 7,7zz 0,0 | NR NR NR | -1,24zz -0,88zz +0,33 |
| 12 недель [54] | Алоглиптин 12,5 + пиоглитазон Алоглиптин 25 + пиоглитазон Плацебо + пиоглитазон | 111 113 115 | 7,91 7,89 7,92 | -0,91{{ -0,97{{ -0,19 | 49,5zz 49,6zz 20,0 | zz 4,4zz 0,0 | NR NR NR | -0,83zz -1,05zz -0,13 |
| 12 недель [55] | Алоглиптин 12,5 + воглибоза Алоглиптин 25 + воглибоза Плацебо + воглибоза | 76 79 75 | 8,02 7,91 8,12 | -0,96{{ -0,91{{ +0,04 | 46,1zz 50,6zz 12,2 | 5,3zz 10,1zz 0,0 | NR NR NR | -1,06zz -1,03zz -0,31 |
| 3 месяца**[57] | Алоглиптин + ингибитор α-глюкозидаз t.i.d. Алоглиптин + ингибитор α-глюкозидаз b.i.d. Алоглиптин + ингибитор α-глюкозидаз o.d. Алоглиптин | 10 11 11 12 | 8,0 8,1 7,6 7,5 | -1/1 -1,15*** -0,7 -0,3 | 80,0 54,5 63,6 50,0 |
20,0 27,3 36,4 0,0 | - - - - | - - - - |
| * Рандомизированные двойные слепые контролируемые исследования. Z Первичная конечная точка. § Исследование не меньшей эффективности исследуемого препарата по сравнению с контролем: алоглиптин расценивался как не хуже по сравнению с глипизидом при верхней границе одностороннего ДИ 98,75 % для динамики по сравнению с исходным { Оценено по графику. # Исходно среднее значение для всей когорты пациентов. ** Пациенты не достигли адекватного гликемического контроля на ингибиторе a-глюкозидаз (акарбоза, воглибоза, миглитол) при приеме три раза в день. Динамика по сравнению с исходными значениями оценена по графику. Zz p §§ p {{ p ## p *** По сравнению с монотерапией алоглиптином. Zzz Исследование не меньшей эффективности исследуемого препарата по сравнению с контролем. §§§ p b.i.d. — два раза в день; HbA1c — гликированный гемоглобин; NR — не указано; o.d. — один раз в день; t.i.d. — три раза в день. | ||||||||
3.3. Устойчивость эффекта
В исследованиях продолжительностью 1–2 года было показано, что эффективность алоглиптина сохраняется на протяжении длительного времени. В ряде исследований по комбинированной терапии, помимо основного исследования продолжительностью 12–26 недель (см. раздел 3.2), была открытая продленная фаза до года [50, 52, 54, 55, 59].
Достигнутое исходно, на фоне назначения алоглиптина, улучшение гликемического контроля сохранялось; уровни HbA1c и ГПН на протяжении всего исследования были значимо ниже по сравнению с исходными показателями. Динамика уровня HbA1c через год после присоединения алоглиптина 25 мг в среднем составила от –0,58 до –0,89 % [50, 52, 54, 55]. В группе пациентов пожилого возраста было показано, что монотерапия алоглиптином через год лечения не уступает по эффективности глипизиду (см. раздел 3.1) [46]. Кроме того, в исследовании, сравнивающем эффективность алоглиптина и глипизида при добавлении к монотерапии метформином, было отмечено, что сахароснижающее действие алоглиптина сохраняется на протяжении двух лет терапии и не уступает глипизиду (см. раздел 3.2) [56].
3.4. Отдельные группы пациентов
3.4.1. Пациенты пожилого возраста
В обобщенном анализе результатов шести рандомизированных, двойных слепых, плацебо-контролируемых исследований сравнивали показатели, полученные в группах пожилых (средний возраст 70 лет; n = 455) и более молодых пациентов (средний возраст 52 лет; n = 1911) [61]. Продолжительность исследований составляла 26 недель, за исключением одного — длительностью 12 недель, и во всех работах изучали монотерапию алоглиптином или комбинацию алоглиптина с метформином, пиоглитазоном, глибенкламидом или инсулином. Снижение уровней HbA1c и ГПН было сопоставимым в обеих возрастных группах. Динамика HbA1c на фоне терапии алоглиптином 12,5 и 25 мг в среднем составила –0,7 и –0,8 % соответственно в старшей возрастной группе и –0,5 и –0,6 % соответственно в группе более молодого возраста [61].
По результатам исследования, проведенного в группе пациентов 65–90 лет (средний возраст 70 лет) с умеренной гипергликемией, было показано, что монотерапия алоглип-тином 25 мг не уступает терапии глипизидом в отношении снижения уровня HbA1c (табл. 1) [46].
3.5. Функция b-клеток поджелудочной железы
По данным клинических исследований, терапия алоглиптином, как правило, приводила к значимому снижению соотношения проинсулина к инсулину и увеличению HOMA-b по сравнению с плацебо [44, 45, 50, 54, 55, 58, 59]. Полученные результаты позволяют предположить, что алоглиптин способствует улучшению функции р-клеток поджелудочной железы. И напротив, алоглиптин не оказывал существенного влияния по сравнению с плацебо на HOMA-R, что свидетельствует об отсутствии влияния на резистентность к инсулину.
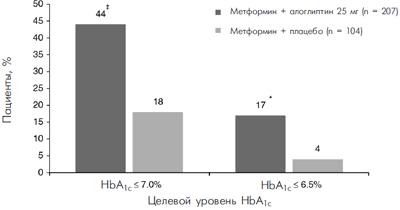
Рисунок. Эффект добавления алоглиптина пациентам, не достигшим
целевых показателей гликемического контроля на монотерапии метформином [49]
*p=0,013.
z p
3.6. Влияние на липиды
ГПП-1 участвует в метаболизме липидов, поэтому терапия, основанная на инкретинах, может улучшать показатели липидного спектра и снижать постпрандиальный уровень липопротеинов, насыщенных триглицеридами [64-66]. В большинстве исследований [45, 46, 67], но не во всех [44], было отмечено снижение уровня триглицеридов на фоне терапии алоглиптином у пациентов с сахарным диабетом. Так, по данным 16-недельного рандомизированного двойного слепого, плацебо-контролируемого исследования, монотерапия алоглиптином в дозе 25 мг сопровождалась снижением уровня триглицеридов постпрандиально (возрастающая площадь под кривой «концентрация-время») на -3,5 ммоль/л•ч по сравнению с плацебо (р В целом алоглиптин не оказывает существенного влияния на другие показатели липидного спектра, однако его применение сопровождалось положительной динамикой общего холестерина и липопротеинов низкой плотности по сравнению с воглибозой [44, 55]. Кроме того, в исследовании с участием здоровых добровольцев было показано, что при приеме алоглиптина происходит не только снижение постпрандиального уровня липопротеинов, богатых триглицеридами, но и уменьшение эндотелиальной дисфункции, ассоциированной с постпрандиальной липемией [69].
Таблица 3.
Нежелательные явления, возникшие после начала лечения в исследованиях II и III фаз с применением алоглиптина [70]
| Нежелательное явление | Доля пациентов | ||
|---|---|---|---|
| Алоглиптин 12,5 или 25 мг (n = 6354) | Препарат сравнения (n = 2257) | Плацебо (n=793) | |
| Любые нежелательные явления | 66,6 | 68,6 | 64,8 |
| Смерть | 0,1 | 0,2 | 0 |
| Серьезные нежелательные явления | 4,4 | 5,2 | 3,2 |
| Нежелательные явления, приведшие к досрочному прекращению участия в исследовании | 3,9 | 5,8 | 2,3 |
4. Безопасность и переносимость
4.1. Переносимость
По данным исследований продолжительностью до двух лет, алоглип-тин в целом характеризуется хорошим профилем безопасности как в монотерапии, так и в комбинации с другими сахароснижающими препаратами у пациентов с СД 2 типа [43–45,47–56,58–60], в том числе старшего возраста [46, 61]. Развитие нежелательных явлений не было до-зозависимым [44, 70], и большинство побочных эффектов были легкой или умеренной интенсивности [70].
В проведенных плацебо-контролируемых исследованиях частота возникновения нежелательных явлений, а также число пациентов, досрочно выбывших из исследования из-за развития нежелательных явлений, была сопоставима в группе терапии алоглиптином и плацебо [44, 45]. По данным объединенного анализа, включавшего результаты 13 плацебоконтролируемых исследований с препаратом сравнения II и III фазы, частота возникновения нежелательных явлений в ходе лечения была сопоставима между группами как на монотерапии алоглиптином, так и на комбинации препаратов [70]. Частота серьезных нежелательных явлений и число пациентов, досрочно прекративших лечение вследствие развития побочного явления, на фоне терапии алоглиптином была несколько выше по сравнению с группой плацебо, однако ниже, чем в группах с использованием препарата сравнения (табл. 3) [70].
По результатам мета-анализа 10 двойных слепых контролируемых исследований не было выявлено отличий по числу пациентов, досрочно прекративших лечение из-за развития нежелательных явлений, в группах терапии алоглиптином и сравнения (включая плацебо или препараты сравнения) (отношение шансов [ОШ] = 0,83; 95 % ДИ 0,61–1,58 для алоглиптина 12,5 мг; ОШ = 0,98; 95 % ДИ 0,44–1,58 для алоглиптина 25 мг) [43]. В проведенном обобщенном анализе 13 исследований были выделены наиболее распространенные побочные эффекты при применении алоглиптина (возникали у > 5 % пациентов, получавших алоглиптин 25 мг, или чаще, чем на терапии плацебо / препаратом сравнения): головная боль, назофарингит, инфекции верхних дыхательных путей (табл. 4) [70].
По данным мета-анализа 10 исследований не было выявлено значимых отличий между группами, получавшими алоглиптин 12,5 или 25 мг, и контрольной (включая плацебо и препараты сравнения) по частоте возникновения отдельных нежелательных явлений, в том числе гипогликемии, головной боли, назофарингита, инфекций верхних дыхательных путей, поражений кожи / подкожной клетчатки, диареи или других явлений со стороны желудочно-кишечного тракта, артралгий, периферических отеков, артериальной гипертензии, инфекций/инвазий, инфекций мочевыводящих путей, гриппа и бронхита [43].
Таблица 4.
Наиболее часто встречающиеся нежелательные явления исследований II и III фаз с применением алоглиптина (> 3 % пациентов в любой из групп) [70]
| Нежелательное явление | Доля пациентов | ||
|---|---|---|---|
| Алоглиптин 12,5 или 25 мг (n = 6354) | Препарат сравнения (n = 2257) | Плацебо (n = 793) | |
| Головная боль | 5,1 | 5,0 | 3,8 |
| Инфекции верхних дыхательных путей | 5,0 | 4,2 | 4,5 |
| Назофарингит | 5,3 | 4,4 | 4,4 |
| Инфекции мочевых путей | 4,2 | 4,1 | 4,4 |
| Артериальная гипертензия | 3,7 | 4,5 | 3,3 |
| Диарея | 3,7 | 5,4 | 4,0 |
| Боль в спине | 3,4 | 3,8 | 2,4 |
| Грипп | 2,7 | 3,8 | 2,1 |
| Артралгия | 2,7 | 3,2 | 2,5 |
| Дислипидемия | 2,0 | 3,9 | 1,5 |
| Головокружение | 2,4 | 3,0 | 2,4 |
| Гипергликемия | 1,0 | 1,9 | 4,0 |
| Гипогликемия | 0,4 | 3,5 | 0,0 |
4.1.1. Гипогликемии
При применении иДПП-4 стимуляция секреции инсулина происходит глюкозозависимо, поэтому риск гипогликемии на фоне терапии препаратами этого класса минимальный [71]. С учетом механизма действия, риск возникновения гипогликемии на фоне терапии алоглиптином низкий [44, 45, 72], в том числе у пациентов старшего возраста [46, 61]. По данным 12-недельного исследования, монотерапия алоглиптином в дозе 12,5 и 25 мг не сопровождалась возникновением гипогликемий [44] и, по результатам 26-недельно-го исследования, приводила к возникновению гипогликемий легкой/ средней тяжести только у 1,5–3,0 % больных [45].
В среднем частота гипогликемии в разных исследованиях с применением алоглиптина в монотерапии или комбинации с другими препаратами составляла 3,57 % (СО = 4,76) [72]. Чаще всего гипогликемии развивались при назначении алоглип-тина в комбинации с производными сульфонилмочевины [51]. Добавление алоглиптина к инсулинотерапии не сопровождалось повышением риска гипогликемий [48]. В клинических исследованиях на фоне терапии алоглиптином тяжелые гипогликемии развивались крайне редко и преимущественно у пациентов, получавших алоглиптин в составе тройной терапии с метформином и пиоглитазоном (3 больных) [58, 59]. Согласно результатам двухлетнего исследования, эпизоды гипогликемии возникали значительно реже на фоне терапии алоглиптином 12,5 или 25 мг по сравнению с глипизи-дом при добавлении к предшествующей монотерапии метформином (2,5, 1,4 и 23,2 % соответственно) [56].
По данным мета-анализа 10 исследований, существенных отличий по частоте возникновения гипогли-кемий между группами терапии алоглиптином и контрольной (терапия плацебо или препаратом сравнения) не отмечено: для алоглипти-на 12,5 мг ОШ составило 0,87 (95 % ДИ 0,20–3,69), для алоглиптина 25 мг — 0,97 (95 % ДИ 0,23–4,01) [43]. Значимых отличий по частоте гипогликемий между пациентами молодого и пожилого возраста не было [61]. В одном из исследований с участием только пациентов старшего возраста частота гипоглике-мий, зафиксированных измерениями на глюкометре, на терапии ало-глиптином была ниже по сравнению с терапией глипизидом (5,4 по сравнению с 26,0 %) [46].
4.1.2. Масса тела
Терапия алоглиптином в дозе 25 мг как в монотерапии, так и в комбинации с другими препаратами не оказывает существенного влияния на вес [43, 45, 48–50, 53, 56, 58, 59], в том числе у пациентов старшего возраста [46, 61]. Динамика массы тела на фоне терапии алоглипти-ном 25 мг составляла от –0,7 до 1,1 кг [58, 59]. В отдельных работах была отмечена статистически значимая прибавка веса на терапии алоглип-тином в отличие от снижения веса в группе сравнения (р 4.2. Кардиоваскулярная безопасность
Кардиоваскулярную безопасность терапии алоглиптином при СД 2 типа оценивали в объединенном анализе 11 клинических исследований II и III фаз [73]. В исследованиях продолжительностью 12-52 недели пациенты были рандомизированы в группу терапии алоглиптином 12,5 или 25 мг (n = 4168; 2023 пациенто-лет) или препаратом сравнения (n = 1860; 966 пациенто-лет). Препаратами сравнения служили метформин, производные сульфонилмочевины, пиоглитазон или инсулин (n = 1169; 793 пациенто-лет) или плацебо (n = 691; 263 пациенто-лет). Первичной конечной точкой была частота крупных сердечно-сосудистых событий (MACE), представляющая комбинацию событий: смерти от сердечнососудистых заболеваний, нефатального инфаркта миокарда (ИМ) или нефатального инсульта. По результатам анализа, не было отличий по частоте развития первичной конечной точки между пациентами, получавшими алоглиптин (13 MACE, 2023 пациенто-лет) или препарат сравнения (10 MACE, 966 пациенто-лет): отношение рисков составило 0,635 (односторонний ДИ 97,5 % 0,0–1,406). Также не было значимых отличий между группами по частоте развития некрупных сердечнососудистых событий (таких как аритмии, стенокардия, сердечная недостаточность); 10 случаев зарегистрировано в группе алоглиптина и 3 — в группе сравнения (р = 0,263) [73].
Пациенты, включенные в данный анализ, относились к группе умеренного сердечно-сосудистого риска, и частота сердечно-сосудистых событий была достаточно низкой. Для получения дополнительной информации было проведено двойное слепое исследование по оценке влияния алоглиптина по сравнению со стандартной терапией на сердечно-сосудистые исходы (EXAMINE), что позволило оценить кардиовас-кулярную безопасность алоглипти-на у пациентов с СД 2 типа и очень высоким сердечно-сосудистым риском, недавно перенесших острый коронарный синдром [68]. Пациенты с СД 2 типа, перенесшие острый ИМ или нестабильную стенокардию в течение предшествовавших 15–90 дней, были рандомизированы в группу терапии алоглиптином (n = 2701) или плацебо (n = 2679) в дополнение к имеющейся стандартной сахароснижающей и сердечно-сосудистой терапии. Длительность лечения составила до 40 месяцев (медиана 18 месяцев). Терапия алоглиптином была не хуже по сравнению с плацебо в отношении частоты возникновения крупных сердечно-сосудистых событий. Первичная конечная точка развилась у 305 пациентов в группе терапии алоглиптином (11,3 %) и у 316 пациентов (11,8 %) — в группе плацебо. Отношение рисков 0,96, а верхняя граница одностороннего ДИ составила 1,16, что соответствовало установленной границе 1c по сравнению с исходным составила –0,33 % в группе терапии алоглиптином и +0,03 % — в группе плацебо (р Дополнительные данные были получены в недавно завершившемся двухлетнем исследовании, в котором к предшествующей терапии метфор-мином пациентам добавляли ало-глиптин или метформин [56]. MACE развились у 0,7 % пациентов в группе терапии алоглиптином 12,5 мг, у 0,9 % — алоглиптином 25 мг и у 1,3 % — глипизидом [56]. В целом результаты обобщенного анализа исследований EXAMINE и двухлетнего исследования по сравнению с глипизидом свидетельствуют о кардиоваскулярной безопасности алоглиптина у пациентов с СД 2 типа.
5. Заключение
Алоглиптин является высокоселективным ингибитором ДПП-4. В клинических исследованиях продолжительностью до двух лет применение алоглиптина как в монотерапии, так и в комбинации с другими сахаро-снижающими препаратами приводило к существенному улучшению гликемического конроля у пациентов с СД 2 типа, в том числе в пожилом возрасте. Применение алоглип-тина сопровождается низким риском гипогликемий и отсутствием прибавки веса. У пациентов из группы очень высокого кардиоваскулярного риска применение алоглипти-на не сопряжено с повышением риска сердечно-сосудистых событий. Литература 1. Asian Association for the Study of Diabetes. Promoting research for better diabetes care in Asia: Kyoto Declaration on Diabetes // J Diabetes Investig 2013; 4: 222.
2. International Diabetes Federation. IDF Diabetes Atlas. 6th edition. Brussels, Belgium: International Diabetes Federation. 2013. Available from www.idf.org/ diabetesatlas [Last accessed 13 December 2013].
3. Schunk M, Reitmeir P, Schipf S, et al. Health-relat- ed quality of life in subjects with and without type 2 diabetes: pooled analysis of five population-based surveys in Germany // Diabet Med 2012; 29: 646–53.
4. Hotta N, Nakamura J, Iwamoto Y, et al. Causes of death in Japanese diabetics: a questionnaire survey of 18,385 diabetics over a 10-year period // J Diabetes Investig 2010; 1: 66–76.
5. Hex N, Bartlett C, Wright D, et al. Estimating the current and future costs of type 1 and type 2 diabetes in the UK, including direct health costs and indirect societal and productivity costs // Diabet Med 2012; 29: 855–62.
6. American Diabetes Association. Economic costs of diabetes in the U.S. in 2012. Diabetes Care 2013; 36: 1033–46.
7. Lee CM, Colagiuri R, Magliano DJ, et al. The cost of diabetes in adults in Australia // Diabetes Res Clin Pract 2013; 99: 385–90.
8. Barnett G. Economic and social impact of diabetes, what to do (abstract HE-02-3) // J Diabetes Inves-tig 2012; 3(Suppl 1): 67.
9. Bailey T. Options for combination therapy in type 2 diabetes: comparison of the ADA/EASD position statement and AACE/ACE algorithm // Am J Med 2013; 126: S10–20.
10. Turner RC, Cull CA, Frighi V, Holman RR. Glycemic control with diet, sulfonylurea, metformin, or insulin in patients with type 2 diabetes mellitus: progressive requirement for multiple therapies (UKPDS 49). UK Prospective Diabetes Study (UKPDS) Group // JAMA 1999; 281: 2005–12.
11. Inzucchi SE, Bergenstal RM, Buse JB, et al. Management of hyperglycemia in type 2 diabetes: a patient-centered approach: position statement of the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD) // Diabetes Care 2012; 35: 1364–79.
12. Chow FCC, Chan S-P, Hwu C-M, et al. Challenges in achieving optimal glycemic control in type 2 diabetes patients with declining renal function: the Southeast Asia perspective // J Diabetes Investig 2012; 3: 481–9.
13. Fukushima M, Suzuki H, Seino Y. Insulin secretion capacity in the development from normal glucose tolerance to type 2 diabetes // Diabetes Res Clin Pract 2004; 66: S37–43.
14. Fukushima M, Aoyama S, Taniguchi A, Seino Y. Clinical characteristics of Asian diabetics: in view of insulin secretory defect and insulin resistance (abstract CS-15-4) // J Diabetes Investig 2012; 3(Suppl 1): 54.
15. Iwahashi H, Okauchi Y, Ryo M, et al. Insulin-secretion capacity in normal glucose tolerance, impaired glucose tolerance, and diabetes in obese and non-obese Japanese patients // J Diabetes Investig 2012; 3: 271–5.
16. Seino Y, Fukushima M, Yabe D. GIP and GLP-1, the two incretin hormones: similarities and differences // J Diabetes Investig 2010; 1: 8–23.
17. Seino Y, Yabe D. Glucose-dependent insulinotropic polypeptide and glucagonlike peptide-1: incretin actions beyond the pancreas // J Diabetes Investig 2013; 4: 108–30.
18. Campbell JE, Drucker DJ. Pharmacology, physiology, and mechanisms of incretin hormone action // Cell Metab 2013; 17: 819–37.
19. Cox ME, Rowell J, Corsino L, Green JB. Dipeptidyl peptidase-4 inhibitors in the management of type 2 diabetes: safety, tolerability, and efficacy // Drug Healthc Patient Saf 2010; 2: 7–19.
20. Gooen K, Graber S. Longer term safety of dipep-tidyl peptidase-4 inhibitors in patients with type 2 diabetes mellitus: systematic review and meta-analysis // Diabetes Obes Metab 2012; 14: 1061–72.
21. Yabe D, Seino Y. Dipeptidyl peptidase-4 inhibitors and prevention of bone fractures: effects beyond glycemic control // J Diabetes Investig 2012; 3: 347–8.
22. Ahren B. DPP-4 inhibition and islet function // J Diabetes Investig 2012; 3: 3–10.
23. Wajchenberg BL. Beta-cell failure in diabetes and preservation by clinical treatment // Endocr Rev 2007; 28: 187–218.
24. Feng J, Zhang Z, Wallace MB, et al. Discovery of alogliptin: a potent, selective, bioavailable, and efficacious inhibitor of dipeptidyl peptidase IV // J Med Chem 2007; 50: 2297–300.
25. Christopher R, Covington P, Davenport M, et al. Phar-macokinetics, pharmacodynamics, and tolerability of single increasing doses of the dipeptidylpeptidase-4 inhibitor alogliptin in healthy male subjects // Clin Ther 2008; 30: 513–27.
26. Moritoh Y, Takeuchi K, Asakawa T, et al. Chronic administration of alogliptin, a novel, potent, and highly selective dipeptidyl peptidase-4 inhibitor, improves glycemic control and beta-cell function in obese diabetic ob/ob mice // Eur J Pharmacol 2008; 588: 325–32.
27. Lee B, Shi L, Kassel DB, et al. Pharmacokinetic, phar-macodynamic, and efficacy profiles of alogliptin, a novel inhibitor of dipeptidyl peptidase-4, in rats, dogs, and monkeys // Eur J Pharmacol 2008; 589: 306–14.
28. Asakawa T, Moritoh Y, Kataoka O, et al. A novel dipeptidyl peptidase-4 inhibitor, alogliptin (SYR-322), is effective in diabetic rats with sulfonylurea-induced secondary failure // Life Sci 2009; 85: 122–6.
29. Shah Z, Kampfrath T, Deiuliis JA, et al. Long-term dipeptidyl-peptidase 4 inhibition reduces atherosclerosis and inflammation via effects on monocyte recruitment and chemotaxis // Circulation 2011; 124: 2338–49.
30. Ta NN, Schuyler CA, Li Y, et al. DPP-4 (CD26) inhibitor alogliptin inhibits atherosclerosis in diabetic apolipoprotein E-deficient mice // J Cardiovasc Pharmacol 2011; 58: 157–66.
31. Ta NN, Li Y, Schuyler CA, et al. DPP-4 (CD26) inhibitor alogliptin inhibits TLR4-mediated ERK activation and ERK-dependent MMP-1 expression by U937 histiocytes // Atherosclerosis 2010; 213: 429–35.
32. Covington P, Christopher R, Davenport M, et al. Phar-macokinetic, pharmacodynamic, and tolerability profiles of the dipeptidyl peptidase-4 inhibitor alogliptin: a randomized, double-blind, placebo-controlled, multiple-dose study in adult patients with type 2 diabetes // Clin Ther 2008; 30: 499–512.
33. Karim A, Covington P, Christopher R, et al. Phar-macokinetics of alogliptin when administered with food, metformin, or cimetidine: a two-phase, crossover study in healthy subjects // Int J Clin Pharmacol Ther 2010; 48: 46–58.
34. Karim A, Bridson W, Fleck P, et al. Disposition of the dipeptidyl peptidase-4 inhibitor [14C] alogliptin benzoate ([14C]SYR-322) after oral administration to healthy male subjects [abstract] // AAPSJ 2007; 9: T3552.
35. Karim A, Fleck P, Harrell RE, et al. Effects of age, race and gender on the pharmacokinetics and phar-macodynamics of alogliptin, a novel and highly selective dipeptidyl peptidase-4 inhibitor in healthy subjects [abstract PI-14] // Clin Pharmacol Ther 2008; 83(Suppl): S13.
36. Karim A, Laurent A, Munsaka M, et al. Coadmin-istration of pioglitazone or glyburide and alogliptin: pharmacokinetic drug interaction assessment in healthy participants // J Clin Pharmacol 2009; 49: 1210–19.
37. Karim A, Harris S, Fleck P, et al. Effect of flucona-zole, ketoconazole, and gemfibrozil on the pharma-cokinetics of alogliptin benzoate (SYR-322) in healthy subjects [abstract 105] // J Clin Pharmacol 2007; 47: 1207.
38. Karim A, Fleck P, Harris S, et al. Lack of pharma-cokinetic interaction between multiple doses of the dipeptidylpeptidase-4 inhibitor alogliptin and digox-in in healthy subjects [abstract PI-13] // Clin Pharmacol Ther 2008; 83(Suppl): S12–13.
39. Karim A, Chiselko P, Fleck P, et al. Lack of effect of cyclosporine on the singledose pharamacokinetics of alogliptin, a novel dipeptidyl peptidase-4 inhibitor in healthy male subjects [abstract PI-15] // Clin Pharmacol Ther 2008; 83(Suppl): S13.
40. Karim A, Copa A, Fleck P, et al. Effect of alogliptin on the pharmacokinetics and pharmacodynamics of norethindrone and ethinyl estradiol (Ortho-Novum1/35) in healthy adult female subjects [abstract PI-16] // Clin Pharmacol Ther 2008; 83(Suppl): S14.
41. Karim S, Fleck P, Harris S, et al. Assessment of drug interaction between alogliptin, a highly selective dipep-tidylpeptidase-4 inhibitor, and atorvastatin in healthy subjects [abstract PI-17] // Clin Pharmacol Ther 2008; 83(Suppl): S14.
42. Karim A, Harris S, Fleck P, et al. Assessment of drug interactions between alogliptin benzoate (SYR-322), a highly selective dipeptidyl peptidase-4 inhibitor, and warfarin at steady state [abstract 106] // J Clin Pharmacol 2007; 47: 1207.
43. Berhan A, Berhan Y. Efficacy of alogliptin in type 2 diabetes treatment: a meta-analysis of randomized double-blind controlled studies // BMC Endocr Dis-ord 2013; 13: 9.
44. Seino Y, Fujita T, Hiroi S, et al. Efficacy and safety of alogliptin in Japanese patients with type 2 diabetes mellitus: a randomized, double-blind, dose-ranging comparison with placebo, followed by a long-term extension study // Curr Med Res Opin 2011; 27: 1781–92.
45. DeFronzo RA, Fleck PR, Wilson CA, Mekki Q; Alogliptin Study 010 Group. Efficacy and safety of the dipeptidyl peptidase-4 inhibitor alogliptin in patients with type 2 diabetes and inadequate glycemic control: a randomized, double-blind, place- bo-controlled study // Diabetes Care 2008; 31: 2315–17.
46. Rosenstock J, Wilson C, Fleck P. Alogliptin versus glip-izide monotherapy in elderly type 2 diabetes mellitus patients with mild hyperglycaemia: a prospective, double-blind, randomized, 1-year study // Diabetes Obes Metab 2013; 15: 906–14.
47. Kutoh E, Ukai Y. Alogliptin as an initial therapy in patients with newly diagnosed, drug na?ve type 2 diabetes: a randomized, control trial // Endocrine 2012; 41: 435–41.
48. Rosenstock J, Rendell MS, Gross JL, et al. Alogliptin added to insulin therapy in patients with type 2 diabetes reduces HbA(1C) without causing weight gain or increased hypoglycaemia // Diabetes Obes Metab 2009; 11: 1145–52.
49. Nauck MA, Ellis GC, Fleck PR, et al. Efficacy and safety of adding the dipeptidyl peptidase-4 inhibitor alogliptin to metformin therapy in patients with type 2 diabetes inadequately controlled with metformin monotherapy: a multicentre, randomised, double-blind, placebo-controlled study // Int J Clin Pract 2009; 63: 46–55.
50. Seino Y, Miyata Y, Hiroi S, et al. Efficacy and safety of alogliptin added to metformin in Japanese patients with type 2 diabetes: a randomized, double-blind, placebo-controlled trial with an open-label, long-term extension study // Diabetes Obes Metab 2012; 14: 927–36.
51. Pratley RE, Kipnes MS, Fleck PR, et al. Efficacy and safety of the dipeptidyl peptidase-4 inhibitor alogliptin in patients with type 2 diabetes inadequately controlled by glyburide monotherapy // Diabetes Obes Metab 2009; 11: 167–76.
52. Seino Y, Hiroi S, Hirayama M, Kaku K. Efficacy and safety of alogliptin added to sulfonylurea in Japanese patients with type 2 diabetes: a randomized, double-blind, placebo-controlled trial with an open-label, long-term extension study // J Diabetes Invest 2012; 3: 517–25.
53. Pratley RE, Reusch JE, Fleck PR, et al. Efficacy and safety of the dipeptidyl peptidase-4 inhibitor alogliptin added to pioglitazone in patients with type 2 diabetes: a randomized, double-blind, placebo-controlled study // Curr Med Res Opin 2009; 25: 2361–71.
54. Kaku K, Itayasu T, Hiroi S, et al. Efficacy and safety of alogliptin added to pioglitazone in Japanese patients with type 2 diabetes: a randomized, double-blind, placebo-controlled trial with an open-label long-term extension study // Diabetes Obes Metab 2011; 13: 1028–35.
55. Seino Y, Fujita T, Hiroi S, et al. Alogliptin plus vogli-bose in Japanese patients with type 2 diabetes: a randomized, double-blind, placebo-controlled trial with an open-label, long-term extension // Curr Med Res Opin 2011; 27(Suppl 3): 21–9.
56. Del Prato S, Camisasca R, Wilson C, Fleck P. Durability of the efficacy and safety of alogliptin compared to glipizide over 2 years when used in combination with metformin [poster 66–LB]. 73rd Scientific Sessions of the American Diabetes Association. 2013 Jun 21–5; Chicago, USA. Available from: http: //ada.apprisor.org/epsSearch. cfm?compid=1.
57. Masuda K, Aoki K, Kamiko K, et al. Glycemic control after addition of the dipeptidyl peptidase-4 inhibitor alogliptin in patients with type 2 diabetes showing inadequate response to thrice-a-day treatment with alpha-glucosidase inhibitors // Expert Opin Pharmacother 2013; 14: 1111–18.
58. DeFronzo RA, Burant CF, Fleck P, et al. Efficacy and tolerability of the DPP-4 inhibitor alogliptin combined with pioglitazone, in metformin-treated patients with type 2 diabetes // J Clin Endocrinol Metab 2012; 97: 1615–22.
59. Bosi E, Ellis GC, Wilson CA, Fleck PR. Alogliptin as a third oral antidiabetic drug in patients with type 2 diabetes and inadequate glycaemic control on metformin and pioglitazone: a 52-week, randomized, double-blind, activecontrolled, parallel-group study // Diabetes Obes Metab 2011; 13: 1088–96.
60. Rosenstock J, Inzucchi SE, Seufert J, et al. Initial combination therapy with alogliptin and pioglitazone in drug-nave patients with type 2 diabetes // Diabetes Care 2010; 33: 2406–8.
61. Pratley RE, McCall T, Fleck PR, et al. Alogliptin use in elderly people: a pooled analysis from phase 2 and 3 studies // J Am Geriatr Soc 2009; 57: 2011–19.
62. Fujii Y, Abe M, Higuchi T, et al. The dipeptidyl peptidase-4 inhibitor alogliptin improves glycemic control in type 2 diabetic patients undergoing hemodialysis // Expert Opin Pharmacother 2013; 14: 259–67.
63. Nakamura Y, Inagaki M, Shimizu T, et al. Long-term effects of alogliptin benzoate in hemodialysis patients with diabetes: a 2-year study // Nephron Clin Pract 2013; 123: 46–51.
64. Matikainen N, Manttari S, Schweizer A, et al. Vildagliptin therapy reduces postprandial intestinal triglyceride-rich lipoprotein particles in patients with type 2 diabetes // Diabetologia 2006; 49: 2049–57.
65. Tremblay AJ, Lamarche B, Deacon CF, et al. Effect of sitagliptin therapy on postprandial lipoprotein levels in patients with type 2 diabetes // Diabetes Obes Metab 2011; 13: 366–73.
66. Xiao C, Bandsma RH, Dash S, et al. Exenatide, a glucagon-like peptide-1 receptor agonist, acutely inhibits intestinal lipoprotein production in healthy humans // Arterioscler Thromb Vasc Biol 2012; 32: 1513–19.
67. Eliasson B, Moller-Goede D, Eeg-Olofsson K, et al. Lowering of postprandial lipids in individuals with type 2 diabetes treated with alogliptin and/or pioglitazone: a randomized double-blind placebo-controlled study // Diabetologia 2012; 55: 915–25.
68. White WB, Cannon CP, Heller SR, et al. Alogliptin after acute coronary syndrome in patients with type 2 diabetes // N Engl J Med 2013; 369: 1327–35.
69. Noda Y, Miyoshi T, Oe H, et al. Alogliptin ameliorates postprandial lipemia and postprandial endothelial dysfunction in non-diabetic subjects: a preliminary report // Cardiovasc Diabetol 2013; 12: 8.
70. Vipidia: EPAR — Public assessment report. European Medicines Agency. 2013. Available from: www.ema.europa.eu [Last accessed 22 November 2013].
71. Drucker DJ, Sherman SI, Gorelick FS, et al. Incretin-based therapies for the treatment of type 2 diabetes: evaluation of the risks and benefits // Diabetes Care 2010; 33: 428–33.
72. Capuano A, Sportiello L, Maiorino MI, et al. Dipep-tidyl peptidase-4 inhibitors in type 2 diabetes therapy-focus on alogliptin // Drug Des Devel Ther 2013; 7: 989–1001.
73. White WB, Pratley R, Fleck P, et al. Cardiovascular safety of the dipetidyl peptidase-4 inhibitor alogliptin in type 2 diabetes mel-litus // Diabetes Obes Metab 2013; 15: 668–73.
74. Esposito K, Cozzolino D, Bellastella G, et al. Dipep-tidyl peptidase-4 inhibitors and HbA1c target of 75. Kim YG, Hahn S, Oh TJ, et al. Differences in the glucose-lowering efficacy of dipeptidyl peptidase-4 inhibitors between Asians and non-Asians: a systematic review and meta-analysis // Diabetologia 2013; 56: 696–708.
76. Iwasaki M, Hoshian F, Tsuji T, et al. Predicting efficacy of dipeptidyl peptidase-4 inhibitors in patients with type 2 diabetes: association of glycated hemoglobin reduction with serum eicosapentaenoic acid and docosahexaenoic acid levels // J Diabetes Inves-tig 2012; 3: 464–7.
77. Senmaru T, Fukui M, Kobayashi K, et al. Dipeptidyl-peptidase IV inhibitor is effective in patients with type 2 diabetes with high serum eicosapentaenoic acid concentrations // J Diabetes Investig 2012; 3: 498–502.
78. Kubota A, Matsuba I, Saito T, et al. Secretory units of islets in transplantation index is a useful clinical marker to evaluate the efficacy of sitagliptin in treatment of type 2 diabetes mellitus // J Diabetes Inves-tig 2011; 2: 377–80.
79. Kubota A, Yabe D, Kanamori A, et al. Factors influencing durability of the glucose-lowering effect of sitagliptin combined with a sulfonylurea // J Diabetes Investig 2013. [Epub ahead of print].
80. Kozawa J, Kitamura T, Nishizawa H, et al. Dipep-tidyl peptidase-4 inhibitors are effective in Japanese type 2 diabetic patients with sustained endogenous insulin-secreting capacity, a higher body mass index and insulin resistance // J Diabetes Investig 2013; 4: 190–4.
