Варениклин – препарат нового поколения для лечения табачной зависимости
СтатьиОпубликовано в журнале:
«Клиническая фармакология и терапия», 2009, 18 (3), с. 1-5
В.Г.Кукес, В.Ф.Маринин, Е.В.Гаврисюк
ММА им. И.М.Сеченова
Современный курильщик располагает большим арсеналом средств, которые могут ему помочь в борьбе с этой пагубной привычкой. Варениклин – частичный агонист α4β2 никотиновых ацетилхолиновых рецепторов (н-АХР), принципиально новый препарат для лечения табачной зависимости. Он проявляет агонизм в отношении н-АХР, активируя их с более низкой внутренней силой, чем никотин, и одновременно блокирует доступ никотина к н-АХР. Клинические исследования показали высокую эффективность, хорошую переносимость и безопасность препарата для лечения никотиновой зависимости. В России варениклин (Чампикс) зарегистрирован в 2008 году.
БОРЬБА С ТАБАЧНОЙ зависимостью привлекает на свою сторону все новых и новых союзников. В настоящее время доступен широкий спектр методов лечения, начиная от гипноза и других психологических воздействий и заканчивая новейшими лекарственными средствами [1,2,9,15,17,20,27]. Современный курильщик располагает большим арсеналом средств, которые могут ему помочь в борьбе с этой пагубной привычкой. Однако, лишь небольшой процент попыток отказа от курения заканчивается успешно [15,43]. Это заставляет ученых всего мира искать новые методы воздействия на людей, зависимых от табака, и разрабатывать новые концепции ведения пациентов с табачной зависимостью [12,13].
Последней разработкой в этой области стал варениклин компании "Pfizer", выпускаемый под торговым названием Чантикс в США и Чампикс в Европе с 2006 года |25,41]. В России варениклин (Чампикс) был зарегистрирован в 2008 году [44]. Варениклин не содержит никотин и является частичным агонистом a4b2 никотиновых ацетилхолиновых рецепторов (н-АХР) головного мозга 11,3,8,14,18,24,35,40].
История создания
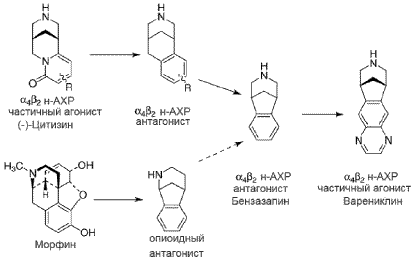
Препарат был разработан группой ученых под руководством Jotham W. Coe путем модифицирования молекулы цитизина [8,14,34,45]. Цитизин - растительный алкалоид, обладающий никотиноподобным действием. Он конкурентно связывается с теми же рецепторами, что и никотин. В настоящее время цитизин выпускается болгарскими фармацевтическими компаниями как средство для лечения табачной зависимости под торговыми названими Табекс, Циперкутен, Цититон [1].
Ученые компании "Pfizer" обнаружили, что структура цитизина очень похожа на структуру алкалоида морфина [8,14,34]. Скелеты обеих молекул, содержащие [3,3,1]-бициклы, различаются лишь положением одного атома азота (рис. 1). Путем сложных химических преобразований была получена молекула варениклина. Она оказалась способной не только частично активировать преимущественно a4b2 н-АХР, но и блокировать доступ никотина к н-АХР [5,8,14,31,34].
Риc. 1. Схема синтеза варениклина
Роль α4β2 н-АХР в формировании никотиновой зависимости и развитии абстинентного синдрома
Почему же так важно воздействие именно на а4b2 подтип н-АХР? Механизм формирования никотиновой зависимости и даже сам процесс воздействия никотина на организм очень сложен и до сих пор изучен не полностью. Согласно современной концепции, никотин, взаимодействуя с нейрональными н-АХР, вызывает ряд изменений в функционировании ацетилхолиновой системы, играющей важную роль в обеспечении когнитивных процессов в головном мозге [4,7,10]. Вызывая активацию и десенситизацию н-АХР, никотин способствует уменьшению чувствительности рецепторов к их природному активатору ацетилхолину, а также вызывает увеличение числа функционирующих рецепторов в ЦНС путем усиления их синтеза [7,10]. Помимо этого, неоднородность самой ацетилхолиновой системы мозга, основанной на разнообразии подтипов н-АХР и их локализации, определяет многочисленные эффекты никотина и обеспечивает взаимосвязь с различными нейромедиаторными системами ЦНС - дофаминергической, глутаматергической, серотонинергической и др. [4]. Другими словами, стимуляция или десенситизация н-АХР регулирует не только число и степень активности самих рецепторов, но и высвобождение важнейших нейромедиаторов головного мозга - дофамина, норадреналина, серотонина, ГАМ К. b-эндорфина и др. [4,7,10,16]. Все это ведет к тому, что для нормальной работы ЦНС организму необходим никотин, так как эндогенные стимуляторы уже не справляются со своей работой, а без никотина появляются симптомы абстиненции - вялость, раздражительность, трудность концентрации, плохое настроение, плохой сон и др.. [4,6,7, 10,16,21,22]. Эти симптомы заставляют курильщика снова и снова брать в руки сигарету.
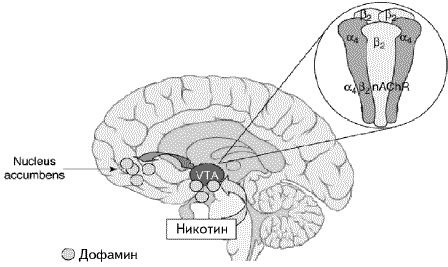
Ведущую роль в закреплении самой привычки табакокурения в ассоциативной памяти человека играет мезокортиколимбическая дофаминовая система мозга (рис. 2), включающая в себя вентральную покрышечную область (VТА), префронтальную кору, миндалевидное тело и хвостатое ядро (nucleus accumbens) [4,14, 16,34]. Высвобождение дофамина в ответ на поступление никотина в мозг играет роль подкрепляющего стимула. Как известно, дофамин — это "нейромедиатор удовольствия", а его выделение в процессе табакокурения определяет чувство удовлетворения от курения [4,16,34]. Основную роль в регуляции высвобождения дофамина играют именно а4b2 н-АХР, которые локализуются преимущественно в вентральной покрышечной области (рис. 2) [4,14,34,37]. По некоторым данным, ал субъединицы определяют высокое сродство рецепторов к никотину [4,10,37], а4b2 субъединицы - взаимодействие с дофаминовой системой [10]. Значение a4b2 рецепторов в закреплении привычки курения подтверждают и опыты, проведенные на лабораторных мышах [34,37].
Рис. 2. Воздействие стимуляции α4β2 н-АХР на мезокортиколимбическую дофаминовую систему
Механизм действия варениклина
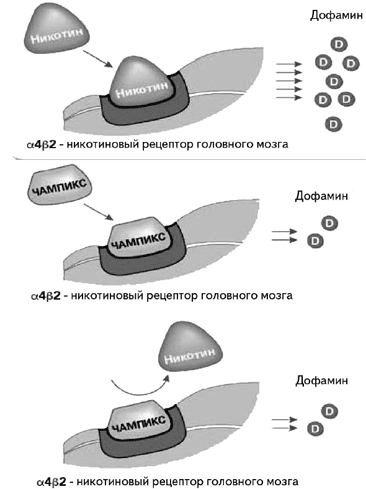
Итак, варениклин является частичным агонистом н-АХР, который обладает высокой аффинностью и селективностью в отношении а4b2 подтипов н-АХР центральной нервной системы (Ki=0,15 нМ) по сравнению с другими подтипами н-АХР (а3b4 - Ki=84 нМ, а7 - Ki-620 нМ, аiру8 - Ki-3400 нМ) или с неникотиновыми рецепторами и транспортировщиками (Ki>1 нМ) [28]. Варениклин дает двойной эффект. Он проявляет агонизм в отношении н-АХР, активируя их с более низкой внутренней силой, чем никотин. При стимуляции рецепторов варениклином высвобождается на 40-60% меньше дофамина, чем при стимуляции никотином. Эта концентрация обеспечивает чувство комфорта, подавляя симптомы абстиненции, с одной стороны, и не приводит к развитию зависимости от препарата, с другой. В присутствии же никотина варениклин проявляет антагонизм, так как обладает большим сродством к рецепторам, нежели никотин [8,9,13,14,16,20,24,28,31, 34.35]. При приеме варениклина курение уже не приводит к привычному повышению уровня дофамина, т.е. человек не получает удовольствия от курения. Таким образом, тяга к сигаретам снижается (рис. 3).
Рисунок 3. Варениклин (Чампикс) - частичный агонист рецепторов [8].
Вверху: воздействие никотина на рецепторы и выброс дофамина, вызывающего удовольствие от курения. В середине: варениклин – неполный агонист рецепторов, вызывающий меньшее выделение дофамина (40- 60% от такового при воздействии никотина); в результате уменьшаются тяга к курению и синдром отмены. Внизу: варениклин препятствует взаимодействию никотина с рецепторами и вызывает уменьшение потребности в курении и удовольствия от курения.
Результаты клинических исследований
Эффективность препарата в лечении никотиновой зависимости была подтверждена многочисленными исследованиями [3,5,6,11,18,19,23,24,29,30,33,38,40]. В этих исследованиях изучались краткосрочные результаты — доля пациентов, отказавшихся от курения в течение последних 4 недель (9-12 недель), среднесрочные результаты - сохранение воздержания через 24 недели от начала лечения и долгосрочные результаты - через 40 недель после прекращения приема препарата (через 52 недели от начала лечения). Долю пациентов, отказавшихся от курения, оценивали как долю пролеченных лиц, не куривших (даже одной затяжки сигареты) с 9-й недели по 52-й неделю, у которых концентрация СО в выдыхаемом воздухе не превышала 10 г/л [5,11,12,18,23, 29,30,38,40,42].
Эффективность и безопасность варениклина в лечении никотиновой зависимости были подтверждены в клинических исследованиях 2 и 3 фазы. В исследованиях 2 фазы были установлены оптимальная доза препарата, режим приема и длительность курса лечения, позволяющие получить оптимальный результаты и свести к минимуму нежелательные реакции [30-33].
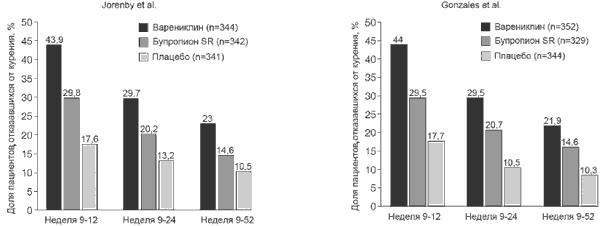
В клинических исследованиях 3 фазы эффективность варениклина сравнивали с плацебо и бупропионом [18,19]. Бупропнон SR до появления варениклина считали самым эффективным препаратом в лечении никотиновой зависимости. В исследованиях D.Gonzales и соавт. |18| и D.Jorenby и соавт. [23] пациентов ранломизировали на три группы (1:1:1) и назначали варениклин в дозе 1 мг два раза в сутки, бупропион в дозе 150 мг два раза в сутки или плацебо. На всех этапах лечения (9-12 недель, 9-24 недели, 9-52 недели) варениклин по эффективности достоверно превосходил плацебо и бупропион (рис. 4)
Рис. 4. Сравнительная эффективность варениклина, бупропиона и плацебо [18,23]
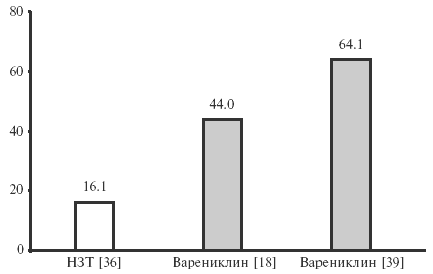
Эффективность варениклина сравнивали также с таковой никотинзаместительной терапии (НЗТ) [3,11, 36]. В 6-недельном исследовании эффективность НЗТ составила всего 16,1% (рис. 5) [36], в то время как в двух 12-недельных исследованиях эффективность варениклина достигла 44,0 и 64,1% [18,39]. В прямом сравнительном 52-недельном исследовании варениклин также превосходил НЗТ по эффективности, в том числе в отдаленные сроки наблюдения [3].
Рис. 5. Эффективность (%) НЗТ и варениклина в 3 клинических исследованиях [18,36,39]
В период активного лечения симптомы тяги и отмены у пациентов, получавших варениклин, были менее выражены, чем у пациентов группы плацебо. По сравнению с плацебо варениклин значительно уменьшал стимулирующие эффекты курения. Влияние варениклина на симптомы тяги, отмены и стимулирующие эффекты курения не изучались в период длительного наблюдения без лечения [3,6,18,19,23,42].
S.Tonstand и соавт. изучали пользу дополнительного 12-недельного лечения препаратом для сохранения воздержания от курения. В этом исследовании все пациенты принимали варениклин по 1 мг два раза в день в течение 12 недель. Пациентов, которые прекратили курение к концу этого срока, рандомизировали и продолжали лечение варениклином (1 мг два раза в день) или плацебо в течение еще 12 недель. Общая продолжительность исследования составила 52 недели [39,40].
Способ применения и дозы
Варениклин предназначен для перорального применения. Прием препарата начинают за неделю до предполагаемой даты отказа от курения. В течение первых 3 дней доза препарата составляет 0,5 мг один раз в день, в течение последующих 4 дней - 0,5 мг два раза в день. На 8-й день дозу увеличивают до 1 мг два раза в день.
Лечение продолжают в течение 12 недель [30,31,33, 38,46]. Считается, что именно в первые 10-12 недель после отказа от курения симптомы абстиненции наиболее выражены [2,21,22]. Препарат можно принимать независимо от приема пиши [32,46]. Для удобства пациентов он выпускается в дозе 0,5 мг и 1 мг в "стартовой" упаковке, рассчитанной на первые 2 недели [46]. При плохой переносимости возможен прием уменьшенной дозы в течение всего времени лечения [30,32,46].
У пациентов, прекративших курение в течение 12 недель, может быть проведен дополнительный 12-недельный курс лечения в дозе 1 мг два раза в день для "закрепления" эффекта [40,46]. Если пациенту не удалось бросить курить в течение 12 недель, или он возобновил курение после лечения, необходимо попытаться провести повторный курс после устранения факторов, которые могли быть причиной неудачного лечения [2].
Фармакокинетика и фармакодинамика варениклина
Максимальная концентрация препарата в плазме крови достигается в течение 3-4 часов после приема внутрь. Равновесная концентрация устанавливается в течение 4 дней постоянного приема. Абсорбция практически полная, системная биодоступность высокая и не зависит от приема пиши и времени приема препарата. Варениклин характеризуется линейными параметрами кинетики при однократном (в дозе от 0,1 до 3 мг/сут) или повторном применении (в дозах от 1 до 3 мг/сут) [14,24,32,34,46].
Варениклин проникает в ткани, включая головной мозг [32]. Видимый объем распределения составляет в среднем 415 л в равновесном состоянии [14,32,34,46]. Связывание варениклина с белками плазмы низкое (Варениклин подвергается минимальному метаболизму и выводится на 92% в неизмененном виде с мочой и менее чем на 10% в виде метаболитов. Период полувыведения варениклина составляет приблизительно 24 ч. Почками варениклин выводится главным образом путем клубочковой фильтрации в сочетании с активной канальцевой секрецией с помощью органического транспортировщика катионов (ОСТ2) [14,32,34].
При выраженном снижении функции почек рекомендуется однократный прием препарата в дозе 0,5 или 1 мг. Препарат выводится при гемодиализе. Заболевания печени не влияют на метаболизм препарата и не требуют коррекции дозы [32,46]. Варениклин противопоказан при индивидуальной непереносимости. Его не рекомендуется назначать при беременности и в период грудного вскармливания [19,32,46].
Варениклин (1 мг два раза в день) не изменяет фармакокинетику бупропиона (150 мг два раза в день) в стационарном состоянии. Однако варениклин не следует назначать в сочетании с НЗТ, учитывая повышение частоты нежелательных явлений, таких как тошнота, головная боль, диспепсия, головокружение, усталость и др. Безопасность и эффективность варениклина в сочетании с другими видами лечения табакозависимости не изучались [32,46]. Клинически выявленных взаимодействий с другими лекарственными средствами нет [32].
Побочные явления
У пациентов, получавших варениклин, самым частым нежелательным явлением была тошнота (табл. 1) В большинстве случаев она развивалась в начале лечения, была легкой или умеренно выраженной и редко приводила к отмене препарата [14,18,19,22,29,30,34,38,42]. Частота прекращения лечения из-за нежелательных реакций составила 11,4% в группе варениклина и 9,7% в группе плацебо [18,19,22]. Причинами прекращения лечения были тошнота (2,7% и 0,6% в группах варениклина и плацебо), головная боль (0,6% и 1,0%), бессонница (1,3% и 1,2%) и необычные сновидения (0,2% и 0,2%) [11,19].
ТАБЛИЦА 1. Частота основных нежелательных явлений при лечении варениклином, бупропионом и плацебо [19]
| Gonzales D. et al. (2006) | Jorenby D. et al. (2006) | |||||
| Варениклин 2 мг/сут (n=349) |
Бупропион 300 мг/сут n=329 |
Плацебо (n=344) |
Варениклин 2 мг/сут (n=343) |
Бупропион 300 мг/сут (n=340) |
Плацебо (n=340) |
|
| Тошнота | 98 (28,1%) | 41 (12,5%) | 29 (8,4%) | 101 (29,4%) | 25 (7,4%) | 33 (9,7%) |
| небольшая | 70 (71,4%) | 27 (65,9%) | 22 (75,9%) | 72 (71,3%) | 14 (56%) | 30 (9,0%) |
| умеренная | 26 (26,5%) | 12 (29,3%) | 5 (17,2%) | 25 (23,8%) | 10 (40%) | 3 (9,1%) |
| сильная | 2 (2%) | 2 (4,9%) | 2 (6,9%) | 5 (5%) | 1 (4%) | 0 (0) |
| Головная боль | 54 (15,5%) | 47 (14,3%) | 42 (12,2%) | 44 (12,8%) | 27 (7,9%) | 43 (12,6%) |
| Бессонница | 49 (14%) | 72 (21,9%) | 44 (12,8%) | 49 (14,3%) | 72 (21,2%) | 42 (12,4%) |
| Необычные сновидения | 36 (10,3%) | 18 (5,5%) | 19 (5,5%) | 45 (13,1%) | 20 (5,9%) | 12 (3,5%) |
| Метеоризм | 20 (5,7%) | 14 (4,3%) | 10 (2,9%) | 20 (5,8%) | 7 (2,1%) | 8 (2,4%) |
| Запоры | 19 (5,4%) | 23 (7%) | 13 (3,8%) | 31 (9%) | 22 (6,5%) | 5 (1,5%) |
Прекращение курения ассоциируется с появлением различных симптомов абстиненции. Например, у пациентов, пытавшихся бросить курить, отмечались дисфорическое или депрессивное настроение, бессонница, раздражительность, фрустрация или гнев, тревога, трудности при концентрации, беспокойство, урежение ритма сердца, повышение аппетита или массы тела. Прекращение курения ассоциировалось с обострением психического заболевания [19,46]. В клинических исследованиях попытки различить нежелательные эффекты препарата и симптомы отмены никотина не предпринимались. Следует обращать внимание врачей и пациентов на возможное появление вышеперечисленных симптомов. При их наличии пациенту следует обратиться к врачу. Нежелательные реакции обычно возникают в течение первой недели. Их частота не зависела от возраста, расы или пола [18,19,22,29,38,42]. Отмена варениклина ассоциировалась с увеличением раздражительности, тяги к курению, депрессией и/или бессонницей у 3% пациентов [18,19,22].
Заключение
Курение занимает первое место среди предотвратимых факторов риска многих заболеваний, а распространенность табакокурения в мире просто поражает! Каждые 8 секунд из жизни ухолит один курильщик табака, примерно за то же время появляется новый [43]. По прогнозам, в ближайшие 50 лет табакокурение унесет около 450 млн. жизней [26]. Поэтому так важно появление новых эффективных и безопасных методов лечения. Варениклин - высокоэффективный препарат нового поколения, предназначенный для лечения никотиновой зависимости. Активируя а4b2 н-АХР, расположенные в передней покрышечной области, он способствует высвобождению дофамина, поддерживая состояние комфорта и снижая тягу к курению. Блокируя доступ никотина к рецепторам, препарат уменьшает удовольствие, связанное с курением. Таким образом, лечение никотиновой зависимости становится более эффективным!
ЛИТЕРАТУРА
1. Кукес ВТ.. Марнннн В.Ф.. Гаврисюк Е.В. Табачная записи мое п. и ее лечение. Врач. 2009, 4, 4-7.
2. Чучалин А.Г.. Сахарова Г.М.. Антонов Н.С. н др. Комплексное лечение табачной зависимости н профилактика хронической обструктивнон болезни легких, вызванной курением. Профилактика заболевании и укрепление здоровья, 2003, 2, 44-50.
3. Aubin H., Bobak A. et al. Varenicline versus transdermal nicotine patch for smoking cessation: results from a randomised, open-label trial. Thorax, 2008, 1, 1-8.
4. Benowitz N. Clinical pharmacology of nicotine: implications for understanding, preventing, and treating tobacco addiction. Clin. Pharmacol. Ther., 2008, 83, 531.
5. Cahill K., Stead L., Lancaster T. Nicotine receptor partial agonists for smoking cessation. The Cochrane Library, 2008, Issue 3.
6. Cappelleri J., Bushmakin A., Baker C. et al. Revealing the multidimensional framework of the Minnesota nicotine withdrawal scale. Curr. Med. Res. Opin., 2005, 21 (5), 749-760.
7. Citri A., Malenka R. Synaptic plasticity: multiple forms, functions, and mechanisms. Neuropsychopharmacology, 2007, 1-24.
8. Coe J., Brooks P., Vetelino M. et al. Varenicline: an α4β2 nicotinic receptor partial agonist for smoking cessation. J. Med. Chem., 2005, 48, 3474-3477.
9. Corelli R., Hudmon K. Pharmacologic interventions for smoking cessation. Crit. Care Nurs. Clin. North Am., 2006, 18(1), 39-51.
10. Dani J., Daoyun Ji, Fu-Ming Zhou. Synaptic plasticity and nicotine addiction. Neuron, 2001, 31, 349-352.
11. Eisenberg M., Filion K., Yavin D. et al. Pharmacotherapies for smoking cessation: a meta-analysis of randomized controlled trials. CMAJ, 2008, 179, 135-144.
12. Etter J.-F. A comparison of the content-, construct- and predictive validity of the cigarette dependence scale and the Fagerstom test for nicotine dependence. Drug Alcohol Dependence, 2005, 77, 259-268.
13. Fagerstrom K., Balfour D. Neuropharmacology and potential efficacy of new treatments for tobacco dependence. Expert Opin. Investig. Drugs, 2006, 15, 107- 116.
14. Fagerstrom K., Hughes J. Varenicline in the treatment of tobacco dependence. Neuropsychiatric Disease Treatment, 2008, 4 (2), 353-363.
15. Foulds J., Steinberg M. et al. Developments in pharmacotherapy for tobacco dependence: past, present and future. Drug Alcohol Rev., 2006, 25, 59-71.
16. Foulds J. The neurobiological basis for partial agonist treatment of nicotine dependence: varenicline. Int. J. Clin. Pract., 2006, 60, 571-576.
17. Frishman W., Mitta W., Kupersmith A. et al. Nicotine and non-nicotine smoking cessation pharmacotherapies. Cardiol. Rev., 2006, 14 (2), 57-73.
18. Gonzales D., Rennard S., Nides M. et al. Varenicline, an α4β2 nicotinic acetylcholine receptor partial agonist, vs sustained-release bupropion and placebo for smoking cessation. JAMA, 2006, 296 (1), 47-55.
19. Hays J., Ebbert J., Sood A. Efficacy and safety of Varenicline for smoking cessation. Amer. J. Med., 2008, 121 (4A), 32-42.
20. Henningfield J., Fant R., Buchhalter A., Stitzer M. Pharmacotherapy for nicotine dependence. CA Cancer J. Clin., 2005, 55 (5), 281-299.
21. Hughes J., Gust S., Skoog K. et al. Symptoms of tobacco withdrawal: a replication and extension. Arch. Gen. Psychiatry, 1991, 48, 52-59.
22. Hughes J., Hatsukami D. Signs and symptoms of tobacco withdrawal. Arch. Gen. Psychiatry, 1986, 43, 289-294.
23. Jorenby D., Hays J., Rigotti N. Efficacy of Varenicline, an α4β2 nicotinic acetylcholine receptor partial agonist, vs placebo or sustained-release bupropion for smoking cessation. JAMA, 2006, 296 (1), 56-63.
24. Klesges R., Johnson K., Somes G. Varenicline for smoking cessation: definite promise, but no panacea. JAMA, 2006, 296 (1), 94-95.
25. Kuehn B. FDA speeds smoking cessation drug review. JAMA, 2006, 295 (6), 614.
26. Lancaster T., Stead L., Silagy C. et al. Effectiveness of interventions to help people stop smoking: findings form the Cochrane Library. BMJ, 2000, 321, 355-358.
27. Maseeh A., Kwatra G. A review of smoking cessation intervention. www.medscape. com. 2005.
28. Mihalak K., Carroll F., Luetje C. Varenicline is a partial agonist at α4β2 and a full agonist at α7 neuronal nicotinic receptors. Mol. Pharmacol., 2006, 70, 801-805.
29. Nakamura M., Oshima A., Fujimoto Y. et al. Efficacy and tolerability of varenicline, an α4β2 nicotinic acetylcholine receptor partial agonist, in a 12-week, randomized, placebo-controlled, dose-response study with 40-week follow-up for smoking cessation in Japanese smokers. Clin. Ther., 2007, 29 (6), 1040-1056.
30. Nides M., Glover E. et al. Varenicline versus bupropion sr or placebo for smoking cessation: a pooled analysis. Amer. J. Health Behavior, 2008, 32, 664-675.
31. Nides M., Oncken C. et al. Smoking cessation with varenicline, a selective α4β2 nicotinic receptor partial agonist. Arch. Intern. Med., 2006, 166, 1561-1568.
32. Obach R., Reed-Hagen A., Krueger S. et al. Metabolism and disposition of varenicline, a selective α4β2 acetylcholine receptor partial agonist, in vivo and in vitro. Drug Metab. Dispos., 2006, 34, 121-130.
33. Oncken C., Watsky E., Reeves K., Anziano R. Varenicline is efficacious and well tolerated in promoting smoking cessation: Results from a 7-week, randomized, placebo- and bupropion-controlled trial [POS1-047]. Society for Research on Nicotine and Tobacco 11th Annual Meeting, 20-23 March 2005; Prague.
34. Rollema H., Coe J., Chambers L. et al. Rationale, pharmacology and clinical efficacy of partial agonists of α4β2 nACh receptors for smoking cessation. Trends Pharmacol. Sci., 2007, 28, 316-325.
35. Rollema H., Guanowsky V., Mineur Y. et al. Varenicline has antidepressant-like activity in the forced swim test and augments sertraline's effect. Europ. J. Pharmacol., 2009, 605, 114-116.
36. Shiffman S., Rolf C., Hellebusch S. et el. Real world efficacy of prescription and over-the-counter nicotin replacement therapy. Society for the study of addiction to alcohol and other drugs, 2002, 95, 505-516.
37. Tapper A., McKinney S. et al. Nicotine activation of alpha4* receptors: sufficient for reward, tolerance, and sensitization. Science, 2004, 306, 1029-1032.
38. Tsai S., Cho H., Cheng H. et al. A randomized, placebo-controlled trial of varenicline, a selective α4β2 nicotinic acetylcholine receptor partial agonist, as a new therapy for smoking cessation in Asian smokers. Clin. Ther., 2007, 29, 1027-1039.
39. Tonstad S., Tonnesen P., Hajek P. et al. Effect of maintenance therapy with Varenicline on smoking cessation. JAMA, 2006, 296 (1), 64-71.
40. Tonstad S. Varenicline for smoking cessation. Neurotherapeutics, 2007, 7, 121- 127.
41. U.S. Food and Drug Administration. FDA Approves Novel Medication for Smoking Cessation. Press release. 11 May 2006.
42. West R., Baker C., Cappelleri J., Bushmakin A. Effect of varenicline and bupropion on craving, nicotine withdrawal symptoms, and rewarding effects of smoking during a quit attempt. UK National Smoking Cessation Conference Proceedings, London, June 2007. 2007.
43. World Health Organization Tobacco Free Initiative. The tobacco industry's war on public health: tobacco kills – don't be duped. http://www.who.int/tobacco.
44. www.regmrd.ru. Реестр лекарственных средств.
45. chemport.ru/datenews.php Химики не курят.
46. mednovosti.by. Чампикс — инструкция по применению.
Комментарии
ПРАКТИКА ПЕДИАТРА
