Безопасность нимесулида: эмоции или взвешенная оценка?
СтатьиКаратеев А.Е., Барскова В.Г.
Лечение болевого синдрома - наиболее тягостного проявления большинства острых и хронических заболеваний человека, относится к числу первоочередных задач лекарственной терапии. Поэтому препараты, обладающие обезболивающим эффектом, в клинической практике и повседневной жизни используются наиболее часто. Несомненно, лидирующую позицию среди них занимают нестероидные противовоспалительные препараты (НПВП). Уникальный механизм их фармакологического действия связан с блокадой циклооксигеназы (ЦОГ)-2 и подавлением синтеза простагландинов - важнейших медиаторов боли и воспаления. На сегодняшний день не вызывает сомнения, что НПВП являются необходимым средством патогенетического воздействия на боль и воспаление любого генеза, при этом их неоспоримыми достоинствами является предсказуемый эффект, удобство применения и доступность для пациентов [1].
Особое значение НПВП имеют в терапии острых и хронических заболеваний опорно-двигательной системы (ревматических заболеваний), при которых боль и воспаление являются основными клиническими проявлениями. В популяции именно больные с хронической патологией суставов и позвоночника составляют основной круг потребителей НПВП.
Мировой фармакологический рынок (в т.ч. и России), насыщен лекарственными средствами из класса НПВП, причем десятки оригинальных препаратов, существенно отличающихся по своим фармакологическим свойствам, дополняются множеством генериков. Широкий выбор НПВП предоставляет лечащему врачу прекрасную возможность индивидуального подбора лекарства, исходя из особенностей пациента и клинической ситуации [2]. С другой стороны, обилие препаратов на фармакологическом рынке приводит к жесткой конкурентной борьбе между фирмами-производителями, естественным образом заинтересованных в эффективной продаже собственных продуктов. При этом наиболее часто используемым аргументом в пользу рекламируемого препарата становится доказательство его большей, чем у конкурентов, безопасности.
Это действительно веский аргумент, поскольку со стороны общества к проблеме безопасности лечения в последнее время приковано очень большое внимание, и любой лекарственный препарат или метод терапии тщательно оценивается с позиции возможного риска развития осложнений. Число исследований и публикаций, специально посвященных изучению безопасности многих лекарственных средств (НПВП в особенности) существенно превышает число работ по оценке их эффективности. В целом это правильный подход, обоснованный стремлением защитить права пациента, снизить угрозу его жизни и здоровью из-за возможных ятрогенных осложнений, а так же повысить бдительность лечащих врачей в отношении этой патологии.
Но, к сожалению, в ряде случаев информация о нежелательных эффектах тех или иных препаратов носит порой явно тенденциозный характер, что невольно заставляет задуматься о пристрастности тех, кто данную информацию предоставляет. Примером подобной ситуации является характер освещения проблемы нежелательных эффектов некоторых селективных ЦОГ-2 ингибиторов (с-НПВП).
Этот класс лекарственных средств был специально создан для снижения риска серьезных осложнений со стороны желудочно-кишечного тракта (ЖКТ), возникающих на фоне приема «традиционных» НПВП (неселективных ЦОГ-2 ингибиторов, н-НПВП). Как известно, риск ЖКТ-осложнений при назначении н-НПВП неизбежен, поскольку он связан с их класс - специфическим нежелательным фармакологическим действием - блокадой «физиологической» изоформы циклооксигеназы (ЦОГ-1), играющей важную роль в поддержании многих параметров гомеостаза человеческого организма, в т.ч., защитного потенциала слизистой ЖКТ. Этим действием обладают все н-НПВП, поэтому их длительное использование у пациентов с факторами риска развития ЖКТ-осложнений (язвенный анамнез, возраст 65 лет и старше, сопутствующий прием препаратов, повышающих риск кровотечения - низких доз аспирина, антикоагулянтов, глюкокортикоидов), с позиции безопасности терапии нецелесообразно без сопутствующего назначения мощных гастропротекторов [1].
Появление на фармакологическом рынке с-НПВП позволило во многом решить проблему ЖКТ-осложнений и открыло возможность более широкого и эффективного проведения анальгетической и противовоспалительной терапии, что расценивается как несомненное достижение современной медицины. Но абсолютно безвредных лекарств не бывает, и с-НПВП, которые несомненно безопаснее, чем н-НПВП, все же способны в редких случаях вызывать нежелательные эффекты.
Очень широкое использование в клинической практике с-НПВП приводит к тому, что даже редкие побочные эффекты, сообщения о которых появляются в медицинской прессе, становятся доступны суммации и анализу. Выводы, которые могут делать некоторые исследователи при оценке этих данных, могут быть недостаточно взвешенными или чрезмерно эмоциональными. К сожалению, эти выводы зачастую активно преподносятся медицинской общественности, причем в явно некорректном виде.
Последствием подобного некорректного предоставления данных стал недавний «кризис коксибов», возникший после изъятия из продажи высокоселективного НПВП рофекоксиба в связи с появлением сообщений о его способности вызывать серьезные кардиоваскулярные осложнения. «Тень» от рофекоксиба упала на все высокоселективные ЦОГ-2 ингибиторы (т.н. «коксибы»), и в средствах массовой информации прессе появились высказывания, предлагавшие существенно ограничить, а то и запретить использование этих препаратов.
К счастью, анализ данных рандомизированных контролируемых исследований (РКИ), когортных исследований и исследований по типу случай-контроль, проведенный ведущими экспертами различных стран, позволил определить истинное состояние проблемы. Согласно выводам экспертов, прием НПВП действительно повышает риск кардиоваскулярных осложнений, но повышение это не столь значимо, и «коксибы» в этом плане не более опасны, чем другие препараты [1]. Так, по данным Scott P. и сотр. (2006), представивших метаанализ данных 12 наблюдательных исследований по типу случай-контроль, ОР инфаркта миокарда на фоне всех НПВП составляет 1.14 (0.88-1.49), напроксена 1.13 (0.98-1.29), целекоксиба 1.17 (0.97-1.42), ибупрофена 1.19 (1.05-1.35), диклофенака 1.42 (1.23-1.64) и рофекоксиба 1.61 (1.34-1.94) [3].
Решение проблемы кардиоваскулярных осложнений НПВП заключается не в ограничении или запрещении тех или иных препаратов, а в учете возможных факторов риска данных осложнений, и своевременной коррекции патологии сердечно-сосудистой системы у пациентов, нуждающихся в анальгетической и противовоспалительной терапии. Что касается нашей страны, то проблема с использованием коксибов заключается вовсе не в их «кардиотоксичности», а высокой стоимости, делающей их недоступными для большинства больных.
Другим примером некорректной информации, предоставляемой лечащим врачам по вопросу безопасности с-НПВП, является вопрос о гепатотоксичности нимесулида.
Нимесулид является одним из наиболее популярных НПВП в России. Этот препарат был синтезирован д-м G.Moore в биохимической лаборатории ЗМ (подразделение Riker Laboratories) и лицензирован в 1980 г. швейцарской фирмой Helsinn Healthcare SA. Нимесулид появился на фармакологическом рынке с 1985 г (впервые в Италии, где он остается наиболее популярным НПВП), и сейчас используется в 50 странах мира, в т.ч. в государствах Европейского Союза, Южной и Центральной Америки, Китае, Индии, станах Юго-Восточной Азии. С момента начала использования и по 2005 г. было проведено 450 млн. терапевтических курсов этого препарата [4]. Нимесулид зарекомендовал себя как эффективное средство при ревматических заболеваниях, причем важнейшим его достоинством является мощный и быстрый обезболивающий эффект, что было продемонстрировано в нескольких двойных слепых рандомизированных контролируемых исследованиях (РКИ) [5,6].
В работе Bianchi M. и сотр. (2003) в течение 7 дней исследовалась анальгетическая эффективность нимесулида 100 мг vs целекоксиб 200 мг и рофекоксиб 25 мг у 31 больного с ОА, испытывавших выраженный болевой синдром (ВАШ более 40 мм). В 1 день наблюдения прием нимесулида обеспечил снижение боли в среднем на 27 мм, что было достоверно больше по сравнению с целекоксибом (15 мм) и рофекоксибом (22 мм), р<0.05. К окончанию исследования обезболивающий эффект так же был недостоверно выше при использовании нимесулида: он был оценен как «хороший» или «очень хороший» 53.4% больных (на препаратах сравнения - 46.7% и 50%) [7]. В более позднем 2-х недельном РКИ, в ходе которого сравнивался анальгетический эффект целекоксиба 200 мг и целекоксиба 200 мг у 44 больных с гонартрозом, было проведено фундаментальное исследование влияния препаратов на важнейший медиатор боли (субстанцию Р). Результаты исследования показали, что нимесулид превосходил целекоксиб не только по клиническому эффекту, оцененному как «хороший» или «очень хороший» 77.3% и 50.0% больных (р<0.05), но и по влиянию на концентрацию субстанции Р (исходно/14 день, пг/мл) - 159±14/103±10 и 144±15/156±8 (р<0.05) [8].
Интересной особенностью этого препарата является его способность, помимо блокады ЦОГ-2, ингибировать фосфодиэстеразу IV и металлопротеиназы, ферменты, играющие важную роль в процессе активации нейтрофилов и фагоцитов, участвующих в развитии воспаления, что позволяет прогнозировать его высокую эффективность при поражении суставов, сопровождающегося острым синовитом [9]. Эта гипотеза была блестяще подтверждена российским опытом применения нимесулида при остром и хроническом подагрическом артрите, характеризующимся чрезвычайно активной местной воспалительной реакцией. В работе, проведенной в Институте Ревматологии РАМН группой под руководством В.А. Насоновой, было доказано, что нимесулид (Нимесил®) быстро купирует основные проявления острого подагрического артрита, в т.ч. и при полиартикулярном поражении. Следует отметить, что при затянувшемся артрите этот препарат был эффективен даже у тех больных, у которых использование других НПВП (диклофенак) не привело к значимому улучшению состояния [10].
Весьма интересен опыт применения нимесулида при ревматоидном артрите. Российское многоцентровое 4-х недельное РКИ эффективности нимесулида в дозе 200 мг и 400 мг при раннем ревматоидном артрите (n=268), показало, что этот препарат недостоверно более эффективен в отношении купирования боли и уменьшения числа воспаленных суставов, как диклофенак в дозе 100 мг и 200 мг [11].
Способность нимесулида ингибировать активность металлопротеиназ, играющий ключевую роль в процессе деградации суставного хряща, делает перспективным использование этого препарата при остеоартрозе. Так, в пилотном исследовании Kullich W. и сотр. (2002), было показано позитивное влияние приема нимесулида на деградацию хряща у больных с ОА коленных и тазобедренных суставов, оценивающейся по изменению концентрации маркеров катаболизма хрящевой ткани [12]. В настоящее время в Институте Ревматологии РАМН в рамках РКИ ДИНАМО проводится 12-ти месячное исследование эффективности и безопасности нимесулида (Нимесил®) у больных с остеоартрозом.
Новой и перспективной областью применения нимесулида может стать лечение и профилактика злокачественных новообразований (Renard J. и сотр., 2006) [13]. Известно, что селективные ЦОГ-2 ингибиторы обладают противоопухолевым действием, связанным с индукцией клеточного апаптоза и способностью подавлять неоангиогенез (Masferrel J. и сотр., 2000) [14]. В настоящее время имеется обширный экспериментальный материал, подтверждающий антипролиферативный эффект нимесулида. Так, в работе Fodera D. и сотр. (2004) было показано дозозависимое торможение роста культуры клеток гепатоцеллюлярной карциномы человека под влиянием этого препарата [15]. Данные Pan Y. и сотр. (2003) выявили ингибирующий эффект нимесулида в отношении андроген-индуцированных генов, активно экпрессируемых клетками аденокарциномы предстательной железы - простатспецифического антигена, nK2, FKBP51. Этот механизм, по мнению авторов, позволяет оценивать нимесулид как перспективный агент для химиотерапии рака данной локализации [16]. Интересные результаты были получены в исследовании Grimes K. и сотр. (2006), показавших, что нимесулид способен усиливать антипролиферативный эффект радиотерапии в отношении крупноклеточного рака легких (in vitro и in vivo). Данный эффект связывается не только с влиянием на ЦОГ-2, но в большей степени с подавлением экспрессии цитопротективного гена медиатора NF-KappaB [17]. Получены так же экспериментальные данные о положительном влиянии нимесулида при злокачественных новообразованиях молочных желез, мочевого пузыря, языка и печени [18-21].
Однако основным достоинством нимесулида, как и других препаратов из группы с-НПВП, является значительно меньший риск развития серьезных ЖКТ-осложнений (не менее чем в 2 раза), по сравнению с традиционными НПВП [1]. По данным популяционного исследования, проведенного в Северной Италии (анализ 10608 сообщений о побочных действиях НПВП, произошедших с 1988 по 2000 гг.), показали, что нимесулид был причиной осложнений со стороны ЖКТ в 10.4% случаев, в то время как диклофенак в 21.2%, кетопрофен в 21.7%, а пироксикам в 18.6% [22].
Bradbury F. (2004) проанализировал число сообщений о нежелательных эффектах со стороны ЖКТ на фоне приема нимесулида и диклофенака в клинической практике Ирландии. Анализ включал группы из 3807 и 3553 больных, принимавших соответствующие препараты. Оказалось, что нимесулид вызывал подобные осложнения в 1.5 раза реже - 8.0% и 12.1% соответственно (p<0.05) [23].
Близкие данные показала работа Минушкина О.Н. (2003), представляющая собой когортное исследование безопасности нимесулида в дозе 200 мг/сутки, который в течение 1-3 мес. принимали более чем 600 российских больных. Суммарная частота ЖКТ-осложнений составила лишь 9%, причем не было выявлено ни одного случая развития желудочно-кишечного кровотечения или перфорации язвы [24].
В 2003 г. нами было проведено РКИ безопасности нимесулида (Нимесил®) у больных, которым данный препарат назначался непосредственно после заживления НПВП - индуцированных язв и множественных эрозии слизистой желудка и/или 12-ти перстной кишки. Было показано, что у пациентов, принимавших Нимесил 200 мг/сутки, в течение 2-х месяцев наблюдения число рецидивов составило лишь 5.6%, в то время как в контрольной группе, получавших диклофенак 100 мг в свечах - 33.3% [25].
Приведенные данные подтверждают целесообразность дальнейшего широкого использования нимесулида, как препарата, выгодно сочетающего высокую эффективность и относительную безопасность в отношении риска развития серьезных осложнений со стороны ЖКТ. Ограничение использования нимесулида, несомненно, весьма негативно скажется на российских больных, страдающих ревматическими заболеваниями. Поэтому высказывания о высокой гепатотоксичности этого препарата, которые порой приходится слышать, вызывают определенное недоумение и тревогу, тем более что информация о серьезных осложнениях со стороны печени при использовании нимесулида зачастую подается неверно [26]. Так, в газете фирмы «Нижфарм» опубликована короткая заметка, содержащая следующую фразу: «Из-за риска фатального поражения печени нимесулид не разрешен (выд. авт.) к применению в США, Канаде, Австралии и большинстве стран Западной Европы» [27]. В сетевом издании «Лечащий врач», в публикации, посвященной лечению ОРЗ, педиатр д.м.н. Таточенко В.К. дает нимесулиду крайне нелесную оценку: «Недопустимо использование у детей в качестве жаропонижающего нимесулида — НПВС из группы ингибиторов ЦОГ-2. ... Из всех НПВС нимесулид является самым токсичным (выд. авт.): согласно данным швейцарских исследователей [31], установлена причинно-следственная связь между приемом нимесулида и гепатотоксическими эффектами (желтуха — 90%). ... Литература изобилует сообщениями о токсичности этого препарата» [28]. Подобная оценка не только представляется излишне эмоциональной (с учетом того факта, что некоторые генерики нимесулида разрешены к использованию у детей Фармкомитетом России), но и содержит явные неточности.
Следует сразу определиться, что серьезные гепатотоксические реакции при использовании НПВП являются редкой патологией (возникает примерно у 1 из 10 тыс. больных), несопоставимой по частоте с осложнениями со стороны ЖКТ [26]. На популяционном уровне печальное первенство среди лекарств, ответственных за тяжелые печеночные осложнения (прежде всего по числу летальных исходов), уверенно принадлежит «безопасному» парацетамолу, а вовсе не НПВП [29]. Что касается нимесулида, то с 1985 по 2000 гг. для этого препарата было зафиксировано всего 192 значимых осложнений со стороны печени, причем серьезными были признан лишь 81 эпизод. Учитывая, что к этому времени нимесулидом было пролечено 280 млн. больных, суммарная частота опасных гепатотоксических реакций составляет 0.1 на 100.000 курсов терапии [30].
EMEA (общеевропейский орган по надзору за лекарственными средствами), тщательно рассмотрев вопрос о безопасности нимесулида, в 2004 г. принял решение, что гепатотоксичность этого препарата не выше, чем других НПВП, и определил возможность продолжения использования этого препарата в странах Евросоюза [31]. В связи с этим, российские участники последних двух съездов сообщества ревматологов Европы (EULAR) могли наблюдать, как активно представлял нимесулид на сопровождавших конференции выставках его фирма-разработчик Helsinn Healthcare SA. В рамках съездов проводились специальные заседания, в которых обсуждались вопросы эффективности нимесулида - что, конечно, невозможно было бы представить для «запрещенного» препарата.
Что касается «запрещения» нимесулида в США, Великобритании, Австралии и Канаде, то там он не использовался никогда, потому что Helsinn Healthcare SA посчитала продвижение своего продукта на фармакологических рынках этих стран экономически нецелесообразным [32].
Ранее на страницах «Научно-практической ревматологии» мы сообщали, что объективная оценка имеющихся литературных данных не подтверждает гипотезу о более высокой, нежели у других НПВП, гепатотоксичности нимесулида [26]. В частности, это доказывается одним из крупнейших исследований эпидемиологии гепатотоксических реакций, возникающих на фоне приема этого препарата (Traversa G. и сотр., 2003). В этой работе была оценена частота данных осложнений у 397537 больных (за период с 1997 по 2001 гг.), получавших НПВП. Суммарная частота гепатопатий у больных, принимающих НПВП, составила 29.8 на 100.000 пациентов-лет. Относительный риск развития патологии печени составил 1.4, по сравнению с пациентами, не принимавшими НПВП более 12 месяцев. Анализ частоты инцидентов гепатопатотоксических реакций, связанных с определенными НПВП, показал, что их частота на фоне приема нимесулида составила 35.3 на 100.000 человек-лет, что было ниже, чем на фоне приема диклофенака, кеторолака и ибупрофена - 39.2, 66.8, 44.6 на 100 тыс. пациентов-лет соответственно [33].
По данным проспективных исследований эффективности и переносимости этого препарата, изменения лабораторных биохимических показателей, свидетельствующих о патологии печени, встречаются не чаще, чем при использовании других НПВП. Так, при использовании нимесулида коротким, не более 30 дней, курсом, повышение АЛТ и АСТ в 2 и более раз отмечается лишь у 0.4% больных. При длительном приеме препарата (до года) частота выявления подобных изменений не превышает 1.5% [34].
В цитированном выше исследовании эффективности высоких доз НПВП при раннем ревматоидном артрите, было показано, что повышение АЛТ более чем в 2 раза у пациентов, получавших нимесулид 400 мг в течение 4 недель (n=72), отмечалось лишь у 4.2% (4.8% при использовании диклофенака 200 мг). При этом следует учесть, что у 12.5% из этих пациентов исходно имелась сопутствующая патология гепатобилиарной системы [11].
Крайне важно отметить, что за весь период использования нимесулида в России (около 10 лет), в российской медицинской литературе не было представлено ни одного случая развития серьезных осложнений со стороны печени.
Основная сложность реальной оценки гепатотоксичности нимесулида связана с отсутствием исследований, специально посвященных изучению влияния этого препарата на печень. Из-за большой редкости подобных осложнений, весь материал по данному вопросу представляет собой ретроспективный анализ сообщений о спорадических случаях гепатотоксических реакций, возникающих у больных, принимавших нимесулид.
Представляется, что весьма ценный материал для оценки реальной гепатотоксичности нимесулида дает наш опыт использования данного препарата у больных с подагрой. Эти пациенты могут считаться группой лиц с сочетанием неблагоприятных факторов, способствующих развитию патологии печени. К ним относятся метаболические нарушения, частое сопутствующее поражение печени (жировой гепатоз) и желчного пузыря (желчно-каменная болезнь), алиментарные нарушения (прием пищи, содержащей большое количество жиров), предшествующее использование н-НПВП (в частности, достаточно гепатотоксичного диклофенака), и, естественно, прием алкоголя [10].
Суммарно мы оценили влияние нимесулида на биохимические показатели функции печени у 81 мужчины (средний возраст 53.6±17.2 года) с подагрическим артритом, находившиеся на лечении в клинике Института Ревматологии с 01.2003 по 06.2004 и получавшие в качестве обезболивающего и противовоспалительного препарата нимесулид 100 - 400 мг/сутки. Длительность непрерывного приема препарата зависела от индивидуальной клинической ситуации и составляла не менее 2-х недель. Исходный средний уровень АЛТ составил 37.3±24.7 ед. (норма до 30 ед), АСТ 25.4±22.9 ед. (норма до 30 ед), щелочной фосфатазы (ЩФ) - 169.6±60.3 ед (норма до 200 ед.). Следует отметить, что у 14 больных уровень АЛТ до назначения нимесулида более чем в 2 раза превышал норму и составлял в среднем 107.4±67.1 ед.
Анализ динамики трансаминаз и ЩФ показал, что в целом в исследуемой группе на фоне приема нимесулида не только не отмечалось повышения этих ферментов, напротив, отмечалось некоторое снижение их уровня. Так, уровень АЛТ составил 33.6±21.3 ед., АСТ 22.03±19.4 ед., а ЩФ 177.4±76.4 ед. (диаграмма 1). Наиболее важным представляется анализ динамики трансаминаз у больных, исходно имевших значительное (более чем в два раза) повышение их уровня (диаграмма 2). На фоне приема нимесулида в целом у этих пациентов отмечалось определенное снижение уровня ферментов (это, конечно, является следствием соблюдения диеты и отказа от приема алкоголя, поскольку специальная гепатопротективная терапия не проводилась). Лишь у одного пациента было отмечен эпизод значительного повышения уровня АЛТ (более чем в 5 раз), не сопровождавшегося, однако, какими-либо объективными симптомами, свидетельствовавшими о серьезной гепатотоксической реакции, или значительными изменениями в иных биохимических показателях крови. Хотя тщательный сбор анамнеза позволял предположить, что причиной этого нежелательного эффекта может быть алкогольный эксцесс, нимесулид был отменен, на фоне чего отмечалось возвращение уровня трансаминаз к исходному уровню. 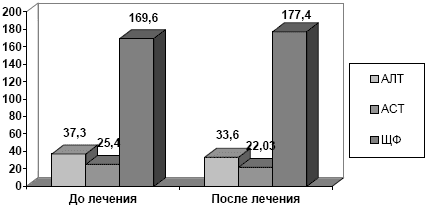
Диаграмма 1. Динамика АЛТ, АСТ, ЩФ у больных с подагрой, принимавших нимесулид (n=81) 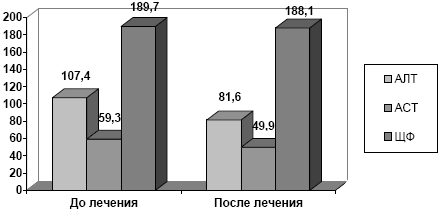
Диаграмма 2. Динамика АЛТ, АСТ и ЩФ у больных с подагрой, принимавших нимесулид и имевших исходно 2-х кратное повышение АЛТ (n=14)
Полученные нами данные показали, что у больных с подагрой при лечении нимесулидом не отмечается отрицательной динамики биохимических показателей, свидетельствующих о повреждении печеночных клеток или холестазе. Особое внимание привлекает тот факт, что практически у всех пациентов, имевших исходно существенное повышение АЛТ, т.е. имеющих повышенный риск гепатотоксических реакций, прием нимесулида не вызвал ухудшения ситуации. Эти данные могут расцениваться как свидетельство отсутствии существенной гепатотоксичности нимесулида, и позволяют говорить о возможности его безопасного использования у больных, даже при наличии признаков сопутствующей патологии печени.
Литература:
1. Насонов Е.Л., Лазебник Л.Б., Мареев В.Ю. и сотр. Применение нестероидных противовоспалительных препаратов. Клинические рекомендации. Москва, 2006.
2. Насонов Е.Л. Нестероидные противоспалительные препараты (Перспективы применения в медицине). Москва, Издательство «Анко», 2000; 142 стр.
3. Scott P., Kingsley G., Smith C. et al. Non-steroidal anti-inflammatory drugs (NSAIDs) and myocardial infarctions (MI): systematic assessment of the available evidence. Arthritis Rheu-mat., 2006, 54, 9(abstract suppl.), 109
4. Rainsford K. Nimesulide -- a multifactorial approach to inflammation and pain: scientific and clinical consensus. Curr Med Res Opin. 2006, 22(6), 1161-1170.
5. Rainsford KD. Current status of the therapeutic uses and actions of the preferential cyclo-oxygenase-2 NSAID, nimesulide. Inflammopharmacology. 2006, 14(3-4), 120-137.
6. Насонов Е.Л. Эффективность и переносимость нестероидного противовоспалительного препарата. Нимесулид: новые данные. РМЖ, 2001, 15: 6-8
7. Bianchi M., Broggini M. A randomized, double-blind, clinical trial comparing the efficacy of nimesulide, celecoxib and rofecocxib in osteoarthritis of the knee. Drag., 2003, 63, suppl. 1, .37-46.
8. Bianchi M., Broggini M., Balzarini P. et al. Effect of nimesulide on pain and synovial fluid concentrations of substance P, interleukin-6, and interleukin-8 in patients with knee osteoarthritis: comparison with celecoxib. Ann Rheum Dis., 2006, 65, 225
9. Camu F., Shi L., Vanlesberghe C. The role of COX-2 inhibitors in pain modulation. Drag., 2003, 63, suppl. 1, p.1-7.
10. Барскова В.Г., Якунина И.А., Насонова В.А. Применение нимесила при подагрическом артрите. Тер. архив 2003, 5, 60-64
11. Каратеев А.Е., Каратеев Д.Е., Лучихина Е.Л. и др. Эффективность и безопасность монотерапии высокими дозами НПВП при раннем артрите. РМЖ, 2006, 16, 24-29.
12. Kullich W., Niksic F., Klein G. Effect of nimesulide on metalloproteinases and matrix degradation in osteoarthritis: a pilot clinical study. Int. J. Clin. Pract., 2002, supl. 128, 24-30.
13. Renard J., Julemont F., de Leval X., Pirotte B. The use of nimesulide and its analogues in cancer chemoprevention. Anticancer Agents Med Chem. 2006, 6(3), 233-237.
14. Masferrer1 J., Leahy K., Koki A., et al. Antiangiogenic and Antitumor Activities of Cyclooxygenase-2 Inhibitors. Cancer Research 2000, 60, 1306-1311
15. Fodera D., D'Alessandro N., Cusimano A., et al. Induction of apoptosis and inhibition of cell growth in human hepatocellular carcinoma cells by COX-2 inhibitors. Ann N Y Acad Sci., 2004, 1028, 440-449.
16. Pan Y., Zhang J., Gazi M., Young C. The cyclooxygenase 2-specific nonsteroidal antiinflammatory drugs celecoxib and nimesulide inhibit androgen receptor activity via induction of c-Jun in prostate cancer cells. Cancer Epidemiol Biomarkers Prev., 2003, 12(8), 769-774.
17. Grimes K., Warren G., Fang F., Xu Y., St Clair W. Cyclooxygenase-2 inhibitor, nimesulide, improves radiation treatment against non-small cell lung cancer both in vitro and in vivo. Oncol Rep., 2006, 16(4), 771-776.
18. Nakatsugi S., Ohta T., Kawamori T., et al. Chemoprevention by nimesulide, a selective cyclooxygenase-2 inhibitor, of 2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine (PhIP)-induced mammary gland carcinogenesis in rats. Jpn. J. Cancer Res., 2000, 91, 886-892.
19. Okajima E., Denda A., Ozono S., et al. Chemopreventive effects of nimesulide, a selective cyclooxygenase-2 inhibitor, on the development of rat urinary bladder carcinomas initiated by N-butyl-N-4-hydroxybutyl)nitrosamine. Cancer Res., 1998, 58, 3028-3031.
20. Shiotani H., Denda A., Yamamoto K., et al. Increased expression of cyclooxygenase-2 protein in 4-nitroquinoline-1-oxide-induced rat tongue carcinomas and chemopreventive efficacy of a specific inhibitor, nimesulide. Cancer Res., 2001, 61, 1451-1456.
21. Denda A., Kitayama W., Murata A., et al. Increased expression of cyclooxygenase-2 protein during rat hepatocarcinogenesis caused by a choline-deficient, L-amino acid-defined diet and chemopreventive efficacy of a specific inhibitor, nimesulide. Carcinogenesis (Lond.), 2002, 23, 245-256.
22. Conforti A., Leone R., Moretti U., Mozzo F., Velo G. Adverse drug reactions related to the use of NSAIDs with a focus on nimesulide: results of spontaneous reporting from a Northern Italian area. Drug Saf., 2001, 24, 1081-1090.
23. Bradbury F. How important is the role of the physician in the correct use of a drug? An observational cohort study in general practice. Int. J. Clin. Pract. (Suppl). 2004, 144, 27-32.
24. Минушкин ОН. Использование препарата "Найз" у больных, страдающих сочетанной патологией суставов и поражением верхних отделов желудочно-кишечного тракта. Научо-практическая ревматология 2003; 5: 72-76.
25. Каратеев АЕ, Каратеев ДЕ, Насонов ЕЛ. Гастродуоденальная переносимость нимесулида (НИМЕСИЛ, Berlin Chemie) у больных с язвенным анамнезом: первое проспективное исследование безопасности селективных ЦОГ-2 ингибиторов у больных с высоким риском развития НПВП-индуцированных гастропатий. Научно-практическая ревматология 2003; 1: 45-48.
26. Каратеев А.Е., Насонова В.А. НПВП - ассоциированная гепатопатия: проблема нимесулида. Научн. Практ. Ревматол., 2004, 1, 34-37
27. «Коротко...» Наша газета (Нижфарм®), 2003, 12
28. Таточенко В.К. Ребенок с лихорадкой. Лечащий Врач, #01/2005.
29. McNally P. Поражения печени лекарственными препаратами. В издании: «МакНелли П.Р. Секреты гастроэнтерологии», М., «Издательство БИНОМ», 235-247.
30. Boelsterli U. Nimesulide and hepatic adverse affects: roles of reactive metabolites and host factors. Int. J. Clin. Pract., 2002, supl. 128, 30-36.
31. European Medicines Evaluation Agency, Committee for Proprietary Medicinal Products. Nimesulide containing medicinal products. CPMP/1724/04.
32. HELSINN's response. На сайте: HELSINN, 2002, 12.
33. Traversa G., Bianchi C., Da Cas R., et al. Cohort study of hepatotoxity associated with nimesulide and other non-steroidal anti-inflammatory drugs. BMJ, 2003, 327, 18-22
34. Boelsterli U. Mechanisms of NSAID-induced hepatotoxicity: focus on nimesulide. Drug Saf. 2002, 25, 633-648.
Комментарии
ПРАКТИКА ПЕДИАТРА
