Сведения о результатах доклинических исследований препарата Гексикон, раствор
СтатьиПрепарат «Гексикон® », раствор 0,05% — антисептическое средство, разработанное ОАО «Нижфарм» (Россия). Активным веществом препарата «Гексикон® », раствор 0,05% является хлоргексидина биглюконат.
Международное непатентованное наименование действующего вещества: хлоргексидин. CAS 55-56-1. Синонимы: Chlorhexidine, Chlorhexidinum, Гексикон и др.
Рис. 1. Структурная формула хлоргексидина
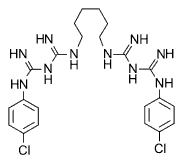
Брутто-формула хлоргексидина — C22H30Cl2N10. Молекулярная масса 505,46 Да. В препаратах часто применяются соли, например хлоргексидина биглюконат, хлоргексидина глюконат, хлоргексидина диацетат и др.
В химическом отношении хлоргексидин — это N,N''-бис(4-хлорфенил)-3,12-диимино-2,4,11,13-тетраазатетрадекандиимидамид. Является катионным антисептиком бисбигуанидового ряда. По структуре является дихлорсодержащим производным бигуанида. По структуре близок к бигумалю.
Хлоргексидин представляет собой белый кристаллический порошок с температурой плавления +137ºC, растворимый в воде (800 мг/л), раствор имеет выраженную щелочную реакцию [35].
Хлоргексидин имеет катионное строение и его антибактериальные свойства являются результатом притяжения между положительно заряженным хлоргексидином и отрицательно заряженной поверхностью бактериальной клетки. Хлоргексидин абсорбируется на поверхности клеточной мембраны чувствительных к нему микроорганизмов с сильной адсорбцией к определенным фосфатсодержащим компонентам. Это нарушает целостность мембраны и повышает ее проницаемость. В низких концентрациях хлоргексидин имеет бактериостатический эффект вследствие утечки через мембрану компонентов с низкой молекулярной массой (например, калий, фосфор) [32].
Хлоргексидин — один из наиболее активных катионных бактерицидных препаратов [1]. Хлоргексидин (хлоргексидина биглюконата раствор) считается лучшим антисептиком для наружного применения широкого спектра действия.
Растворы хлоргексидина применяются в качестве лечебно-профилактического средства при различных видах инфекционной патологии, для антисептики и дезинфекции.
Хлоргексидин применяется для обеззараживания кожи, в дерматологии и хирургии для дезинфекции гнойных ран, инфицированных ожоговых поверхностей, лечения инфекций кожи (пиодермий, импетиго, паронихия, панариция, опрелостей) и слизистых оболочек, для профилактики венерических заболеваний (сифилис, гонорея, трихомониаз, хламидиоз, уреаплазмоз), инфекционно-воспалительных осложнений в акушерстве-гинекологии, в стоматологии (полоскания и орошения) при гингивитах, стоматитах, афтах, пародонтите, альвеолите [3, 6].
Хлоргексидин распределяется местно при накожном применении и практически не участвует в метаболизме. Системное всасывание препарата при интактной коже невелико (не более 5%), однако при повреждении кожи системное всасывание может возрастать в 100 раз.
Токсичность хлоргексидина для человека и млекопитающих достаточно низка. Отмечено выраженное раздражающее действие в отношении кожи и глаз. В качестве побочных эффектов важно учитывать возможность возникновения у пациентов гиперчувствительности немедленного типа и анафилактического шока при применении препаратов хлоргексидина.
Не считается канцерогеном, отсутствуют мутагенный и генотоксический эффекты, тератогенный и эмбриотоксический эффект, хлоргексидин слабо влияет на репродуктивную функцию, слабо цитотоксичен.
Вспомогательное вещество (вода очищенная) играет роль растворителя. Не токсично.
Действующее и вспомогательное вещества имеют незначительные побочные эффекты и противопоказания, что свидетельствует о высокой безопасности и физиологической адекватности препарата «Гексикон® », раствор для наружного применения.
1.1. Вводный краткий обзор проведенных доклинических исследований
| Год | Место проведения | Исследование |
| 1974 | MRC Unit, Birmingham Accident Hospital, Birmingham, Великобритания | Влияние крови на активность антисептиков при обработке рук хирурга |
| 1974 | Institute for Cell and Molecular Science, London, Великобритания | Исследование токсичности и безопасности хлоргексидина |
| 1977 | Department of Veterinary Pathology, College of Veterinary Medicine, Iowa State University, Ames, США | Исследование токсичности и безопасности хлоргексидина |
| 1977 | Safety of Medicines Department, ICI Pharmaceuticals, Macclesfield, Cheshire, Великобритания | Исследование токсичности и безопасности хлоргексидина |
| 1978 | Bureau of Drug Research, Sir Frederick Banting Research Centre, Ottawa, Канада | Фармакокинетика хлоргексидина при местном применении на крысах |
| 1979, 1980 | Raltech Scientific Services, St. Louis, США | Исследования токсичности и безопасности хлоргексидина |
| 1980 | Biomedical Research Department, Stuart Pharmaceuticals, Division of ICI Americas Inc., Wilmington; Department of Pharmacology and Toxicology, Litton Bionetics, Inc., Kensington, США | Фармакокинетика хлоргексидина при местном применении на новорожденных макаках-резус |
| 1982, 1983, 1988 | Hazleton Laboratories America, Inc., Madison, США | Исследования токсичности и безопасности хлоргексидина |
| 1983, 1984 | Litton Bionetics, Inc., Kensington, США | Исследования токсичности и безопасности хлоргексидина |
| 1984 | Indiana University School of Medicine, Indianapolis, США | Сравнительное исследование антибактериальной активности хлоргексидина при профилактике раневых инфекций |
| 1985 | Department of Paediatrics, Vestfold County Central Hospital, Tønsberg, Норвегия | Сравнительное исследование эффективности дезинфекции кожи и пупочной ранки различными концентрациями хлоргексидина |
| 1988 | Department of Surgery, University of British Columbia, Vancouver, Канада | Сравнительное исследование эффективности на модели инфицированного ожога у крыс |
| 1989 | College of Medicine, Albert B. Chandler Medical Center, University of Kentucky, Lexington, США | Деконтаминация полости рта хлоргексидином у пациентов после трансплантации костного мозга |
| 1989 | Department of Medical Microbiology, University of Lund, University Hospital, Швеция | Фармакокинетика хлоргексидина у рожениц |
| 1989 | Food and Drug Research Laboratories, Waverly, США | Исследования токсичности и безопасности хлоргексидина |
| 1991 | St. Thomas' Hospital, United Medical School, London, Великобритания | Cравнительная активность хлоргексидина в отношении метициллин-чувствительных и метициллин-резистентных штаммов Staphylococcus aureus |
| 1991 | WIL Research Laboratories, Inc., Ashland, США | Исследование токсичности и безопасности хлоргексидина |
| 1993 | Product Safety Labs, Dayton, США | Исследование токсичности и безопасности хлоргексидина |
| 1994 | Department of Pharmaceutical Chemistry, School of Pharmacy, The University of Kansas, Lawrence, США | Исследование токсичности и безопасности хлоргексидина |
| 1996 | U. S. National Cancer Institute | Исследование токсичности и безопасности хлоргексидина |
| 1997 | Department of Oral Microbiology and Department of Periodontology School of Dentistry, Faculty of Health Sciences, University of Copenhagen, Дания | Чувствительность биопленок Streptococccus sanguis и Actinomyces naeslundii к хлоргексидину |
| 1997 | Faculté de Pharmacie, Université Claude Bernard; Département de Recherche en Bactériologie Médicale, Faculté de Médecine Laennec, Lyon, Франция | Фармакокинетика хлоргексидина при местном применении на крысах |
| 2000 | Laboratório de Bioquímica Oral; Departamento de Protese e Periodontia Faculdade de Odontologia de Piracicaba, UNICAMP, Piracicaba, Бразилия | Влияние сахарина на антибактериальную активность хлоргексидина |
| 2000 | Welsh School of Pharmacy, Cardiff University, Великобритания | Исследование перекрестной резистентности микроорганизмов к антибиотикам и катионным антисептикам |
| 2000 | GOJO Industries, Akron, США | Исследование токсичности и безопасности хлоргексидина |
| 2000 | University of Brighton, Moulsecoomb, Великобритания | Исследование токсичности и безопасности хлоргексидина |
| 2004 | University of São Paulo, Бразилия | Чувствительность микроорганизмов полости рта к хлоргексидину и парамонохлорофенолу |
| 2004 | Chris Hani Baragwanath Hospital, Soweto, ЮАР | Фармакокинетика хлоргексидина у новорожденных |
| 2004 | Instituto de Quimica de Araraquara, Universidade Estadual Paulista Julio de Mesquita Filho, Araraquara, Бразилия | Исследование токсичности и безопасности хлоргексидина |
| 2005 | Loyola Univ Med Ctr, Maywood; Rosalind Franklin University, North Chicago, США | Эффективность хлоргексидина при лечении инфекционного кератита in vitro |
| 2005 | Dermatology Department, Burnley General Hospital, Burnley, Великобритания | Антимикробная активность хлоргексидина |
| 2005 | Kumamoto University, Kumamoto, Япония | Разложение хлоргексидина бактериями Pseudomonas sp. |
| 2005 | Нижегородская государственная медицинская академия, Нижний Новгород, Россия | Исследование специфической фармакологической активности хлоргексидина на моделях инфицированной Staphylococcus aureus ожоговой раны кожи у крыс и инфицированного Staphylococcus aureus и Pseudomonas aeruginosa дерматита у кроликов |
| 2007 | Department of Oral Medicine, School of Dentistry, Shiraz Medical School, Shiraz University of Medical Sciences, Shiraz, Иран | Чувствительность полирезистентного и не-полирезистентного Streptococcus mutans к хлоргексидину и др. антибиотикам и антисептикам |
| 2007, 2008 | ФГУН «Институт токсикологии», Санкт-Петербург, Россия | Исследование токсичности и безопасности хлоргексидина |
| 2009 | Department of Internal Medicine, National Taiwan University Hospital, Taipei, Тайвань | Эпидемиология и чувствительность к хлоргексидину метициллин-резистентных Staphylococcus aureus |
1.2. Фармакология — результаты исследований, подтверждающих фармакологическую активность препарата
Хлоргексидин — противомикробный препарат, действующий на грамположительные и грамотрицательные микроорганизмы, дрожжи, дерматофиты. Активен в отношении Treponema pallidum, Chlamidia spp., Ureaplasma spp., Neisseria gonorrhoeae, Trichomonas vaginalis, Gardnerella vaginalis, Bacteroides fragilis, простейших (Trichomonas vaginalis); вирусов (Herpes-virus). К препарату слабочувствительны некоторые штаммы Pseudomonas spp., Proteus spp., а также устойчивы кислотоустойчивые формы бактерий, споры бактерий, грибы, вирусы [3, 23]. Хлоргексидин не нарушает функциональную активность лактобацилл [1]. Сохраняет активность в присутствии крови и гноя [23].
Хлоргексидин в зависимости от используемой концентрации проявляет как бактериостатическое, так и бактерицидное действие: бактериостатическое действие хлоргексидина (как водных, так и спиртовых рабочих растворов) проявляется в концентрации 0,01% и менее, бактерицидное — в концентрации более 0,01% при температуре 22°C и воздействии в течение 1 мин. Фунгицидное действие проявляется при концентрации 0,05%, температуре 22°С и воздействии в течение 10 мин., вирулицидное действие — при концентрации 0,01–1%.
Многочисленные исследования показывают выраженную противомикробную активность антисептика хлоргексидина при местном накожном применении [22, 42].
В табл. 1 приведены МПК хлоргексидина в отношении различных микроорганизмов и грибов.
Таблица 1. МПК хлоргексидина
| Микроорганизм | МПК, мкг/мл | Ссылка |
| Pseudomonas aeruginosa | 80,0 | [19] |
| Staphylococcus aureus | 4,0 | [19] |
| Candida albicans | 4,0 | [19] |
| Porphyromonas gingivalis | 3,4 | [19] |
| Porphyromonas endodontalis | 3,4 | [19] |
| Prevotella melaninogenica | 3,4 | [19] |
| Prevotella intermedia | 3,4 | [19] |
| Enterococcus faecalis | 3,33 | [19] |
| Escherichia coli | 2,67 | [19] |
| Prevotella denticola | 2,67 | [19] |
| Streptococcus mutans | 1,0–2,0 | [17] |
| Enterobacter cloacae | ≤75 – ≤150 | [10] |
| Klebsiella pneumoniae | ≤75 – ≤300 | [10] |
| Serratia marcescens | ≤150 | [10] |
| Pseudomonas maltophilia | ≤150 | [10] |
| Citoubacter diversus-levena | ≤37,5 | [10] |
| Enterobacter agglomerans | ≤75 | [10] |
| Klebsiella oxytoca | ≤300 | [10] |
| Streptococcus pneumonia | 5,0 | [18] |
| Staphylococcus aureus | 2,5 | [18] |
| Streptococcus orale | 1,25 | [18] |
| Bacillus cereus | 0,04 | [18] |
| Klebsiella pneumonia | >10 | [18] |
| Serratia marcescens | 10,0 | [18] |
| Acanthamoeba polyphaga | 6,25 | [43] |
| Полирезистентный Streptococcus mutans | 2,0–16,0 | [20] |
| Неполирезистентный Streptococcus mutans | 0,25–1,0 | [20] |
| Aspergillus spp. | 75–500 | [37] |
| Candida albicans | 7–15 | [37] |
| Microsporum spp. | 12,0–18,0 | [37] |
| Penicillium spp. | 150,0–200,0 | [37] |
| Saccharomyces spp. | 50,0–125,0 | [37] |
| Trichophyton spp. | 2,5–14,0 | [37] |
| Streptococcus sanguis | >100 | [27] |
| Actinomyces naeslundii | >100 | [27] |
| MRSA | >4 | [41] |
| Bacillus subtilis | 10 | [44] |
| Staphylococcus aureus | 10 | [44] |
| Escherichia coli | 20 | [44] |
| Proteus vulgaris | 20 | [44] |
| Pseudomonas aeruginosa | 100 | [44] |
| Serratia marcescens | 100 | [44] |
Определенный интерес представляет вопрос о резистентности микроорганизмов к хлоргексидину. Считается, что изменения наружной мембраны бактериальной клетки ведут к повышению резистентности. В связи с этим имеет значение селекция плазмидного гена qacA/B, связываемая с широким внедрением в практику катионных антисептиков, в т.ч. хлоргексидина и четвертичных аммониевых соединений [40].
В исследовании, проведенном в лондонском госпитале Св. Томаса Объединенной медицинской школы (St. Thomas' Hospital, United Medical School, London, Великобритания) изучалась in vitro сравнительная активность хлоргексидина в отношении метициллин-чувствительных (MSSA) и метициллин-резистентных (MPSA) штаммов Staphylococcus aureus. 2 штамма MRSA, не несущих плазмиды NAB, были более чувствительными (МПК 0,25 и 0,5 мкг/мл) чем 4 из 8 исследованных штамма MSSA (МПК 0,25–2 мкг/мл). МПК в отношении 7 штаммов MRSA с плазмидами GNAB (гены устойчивости к гентамицину, пропамидина изэтионату, этидия бромиду) была выше (1–3,3 мкг/мл), однако результаты киллинг-тестов не различались. В исследовании in vivo приняли участие 10 добровольцев, которым на различные участки кожи наносились штаммы GNAB-резистентные и изогенные GNAB-чувствительные штаммы MSSA. Различий в МПК и киллинг-эффекте выявлено не было. Авторы сделали вывод об эффективности хлоргексидина в отношении MRSA и MSSA с или без NAB-плазмид [16].
В Университете Кумамото (Kumamoto University, Кумамото, Япония) из канализационных сточных вод выделен штамм Pseudomonas aeruginosa, использующий хлоргексидин в качестве единственного источника азота для своего роста. Хлоргексидин разлагается бактериями до соединений CHDI-B, CHDI-BR, CHDI-D, CHADP-5 и CHDI-C, среди которых CHDI-B и CHDI-C обладают слабой антимикробной активностью (в 5–10 раз слабее хлоргексидина) [44].
В исследовании специфической фармакологической активности, выполненном в 2005 г. в Нижегородской государственной медицинской академии, изучали эффективность действия препарата Гексикон при его наружном применении в течение 7 дней у самцов крыс линии Wistar и у кроликов породы Шиншилла в сравнении с препаратами Левомеколь и Бактробан. Тестируемые вещества применяли в дозе 10 мг/см2. В качестве контрольного вещества применяли медицинское вазелиновое масло.
Эффективность хлоргексидина изучали на моделях инфицированной Staphylococcus aureus ожоговой раны кожи IIIб степени площадью 23,5 см2 у крыс (7% от общей поверхности тела) и инфицированного Staphylococcus aureus и Pseudomonas aeruginosa дерматита у кроликов. При моделировании ожоговой раны регистрировали общее состояние животных, скорость заживления раневой поверхности по данным гистологии, содержание в плазме крови общего белка, креатинина, количество колониеобразующих единиц (КОЕ) в смыве с ожоговой раны. Эффективность лечения инфицированного дерматита определялась по диаметру инфильтрата, степени покраснения кожи и наличия бактериальной флоры в инфильтрате. Содержимое инфильтратов оценивали с помощью мазков-отпечатков полуколичественным методом.
Было показано, что наружное применение хлоргексидина при лечении ожоговой раны способствует быстрой эпителизации раневого дефекта; при лечении инфицированного дерматита эффективно снижает проявления воспалительного процесса за счет выраженного антимикробного действия (особенно в отношении Pseudomonas aeruginosa) и, вероятно, за счет хорошей биодоступности хлоргексидина в очаге поражения. По эффективности действия хлоргексидин был сравним с препаратами Левомеколь и Бактробан [2].
В исследовании, проведенном в Университете Британской Колумбии (University of British Columbia, Vancouver, Канада), добавление 1% раствора хлоргексидина биглюконата к 1% раствору сульфадиазина серебра в лечении экспериментальных инфицированных ожоговых ран у крыс повышало эффективность последнего. Оценивалось противомикробное действие при 7 дневном применении 1 раз в день в отношении Staphylococcus aureus, Pseudomonas aeruginosa, Enterobacter cloacae, и Streptococcus faecalis, толщина струпа [42].
1.3. Фармакокинетика
Абсорбция, распределение
Хлоргексидин практически не всасывается из ЖКТ. После случайного проглатывания 300 мг Cmax достигается через 30 мин (tmax) и составляет 0,206 мкг/л. Через 12 ч препарат в крови не определяется. В экспериментах на животных и на здоровых добровольцах с использованием радиоактивно меченого хлоргексидина установлено, что при пероральном приеме биодоступность составляет менее 1% [32].
При применении 0,12% раствора хлоргексидина для орошения полости рта и носа, хлоргексидин связывается с фосфатными группами слизистой оболочки и затем постепенно высвобождается в течение 24 ч [32].
В исследовании, проведенном в университетском госпитале Университета г. Лунд (Швеция), изучалась фармакокинетика хлоргексидина у рожениц. При однократном применении 0,2% раствора инвагинально у 35% женщин выявлялось наличие от 10 до 83 нг/мл хлоргексидина в сыворотке крови. Повторное применение препарата через 6 ч не вело к повышению уровня хлоргексидина в сыворотке. Исследователями сделан вывод, что незначительное количество хлоргексидина способно всасываться через слизистую мочеполовых путей, не накапливаясь при этом в крови [34].
Благодаря своей катионной природе хлоргексидин хорошо связывается с кожей и слизистыми. Всасывание радиоактивно меченого хлоргексидина при местном применении исследовалось в экспериментах на новорожденных макаках-резус при ежедневном купании в течение 90 дней в моющем средстве, содержащем 8% хлоргексидина глюконата. Незначительные количества хлоргексидина выявлены в пробах жировой ткани (15–19 мкг/кг), почек (18–44 мкг/кг), в одной пробе ткани печени (14 мкг/кг). Заметные концентрации хлоргексидина (70–200 мкг/кг) обнаруживались в коже. В пробах крови хлоргексидин не определялся [14, 21].
Последнее наблюдение нашло подтверждение также при использовании 4% раствора хлоргексидина для купания детей, при однократном местном нанесении 5% раствора на участок кожи площадью 50 см2 у волонтеров и при ежедневном использовании в течение 6 месяцев 5% раствора в качестве средств предоперационной обработки [14, 33].
В исследовании, проведенном в Chris Hani Baragwanath Hospital (Soweto, ЮАР), изучались переносимость и безопасность различных концентраций хлоргексидина (0,25%, 1% и 2%) при купании новорожденных детей. Сывороточные концентрации хлоргексидина были определены у 20 детей. Хлоргексидин был выявлен в концентрации 26,7 нг/мл в сыворотке крови только одного новорожденного (10%) в группе, где использовался 2% раствор, и у 3 новорожденных (30%) в концентрациях 13,5, 20,3 и 26,2 нг/мл в группе 1% раствора. При этом никаких нежелательных явлений, связанных с применением хлоргексидина, отмечено не было [46].
На крысах изучалось трансдермальное проникновение меченого 14С хлоргексидина. Менее 5% местного хлоргексидина абсорбировалось за 5-дневный период [15].
В Университете Клода Бернара (Université Claude Bernard) в Лионе (Франция) изучалось трансдермальное проникновение хлоргексидина глюконата через лишенную волос кожу крыс. В целостной коже происходило накопление вещества, т.е. кумуляция преобладала над системным всасыванием. Однако, если кожа была повреждена (без рогового слоя), то происходила реверсия. Абсорбция повышалась примерно в 100 раз, а кумуляция в коже уменьшалась почти на 10% [26].
Метаболизм
Хлоргексидин не инактивируется белками крови и плазмы [11, 28, 29, 31].
Данных о метаболизме хлоргексидина не найдено. Хлоргексидин выводится из организма в неизменном виде.
Экскреция
При употреблении внутрь 300 мг хлоргексидина около 90% дозы экскретируется с фекалиями, с желчью, и менее 1% — с мочой [32]. В исследовании C. P. Chow и соавт. также выявлено, что экскреция хлоргексидина происходит в основном с фекалиями [15].
Взаимодействие с другими лекарственными средствами
Хлоргексидин применяется в нейтральной среде; при pH 5–8 разница в активности невелика; при pH более 8 выпадает осадок. Применение жесткой воды снижает бактерицидные свойства [6].
Фармацевтически несовместим с мылом, щелочами и др. анионными соединениями (коллоиды, гуммиарабик, сапонины, натрия лаурилсульфат, натрия карбоксиметилцеллюлоза) [3, 6]. Не рекомендуется одновременное применение с йодом [3].
Совместим с лекарственными средствами, содержащими катионную группу (бензалкония хлорид, цетримония бромид) [6].
Этанол усиливает эффективность препарата [3, 6].
Водные растворы солей хлоргексидина могут разлагаться (в особенности при нагревании и щелочном рН) с образованием следовых количеств 4-хлороанилина, обладающего канцерогенными свойствами [7, 14].
1.4. Токсикология — общая токсичность, специфическая токсичность
Данные литературы по острой токсичности характеризуют хлогексидин как малотоксичное вещество (табл. 2).
Таблица 2. Острая токсичность хлоргексидина
| Организм | Тест | Путь введения | Доза | Ссылка |
| Мыши | LD50 | в/б | 44 мг/кг | [8] |
| Мыши | LD50 | в/в | 24 мг/кг | [12] |
| Мыши-самцы линии Alderley Park | LD50 | Per os | 2515 мг/кг | [24] |
| Мыши-самки линии Alderley Park | LD50 | Per os | 2547 мг/кг | [24] |
| Мыши-самцы | LD50 | п/к | 637 мг/кг | [12] |
| Мыши-самки | LD50 | п/к | 632 мг/кг | [12] |
| Крысы-самцы линии Wistar | LD50 | п/к | 2270 мг/кг | [14] |
| Крысы-самки линии Wistar | LD50 | п/к | 2000 мг/кг | [14] |
| Крысы линии Alderley Park | LD50 | п/к | >3000 мг/кг | [14] |
| Кролики | LD | в/в | > 8 мг/кг | [8] |
| Крысы | LD50 | в/б | 60 мг/кг | [8] |
| Крысы-самцы | LD50 | в/в | 21 мг/кг | [24] |
| Крысы-самки | LD50 | в/в | 23 мг/кг | [15] |
| Крысы | LD50 | per os | 9,2 мл/кг | [47] |
| Крысы | LD50 | per os | 5000 мг/кг | [32] |
| Крысы-самцы | LD50 | в/ж | 1710 мг/кг | [39] |
| Крысы-самки | LD50 | в/ж | 1180 мг/кг | [39] |
| Крысы | LD50 | per os | 1800 мг/кг | [38] |
| Крысы | LD50 | п/к | > 1000 мг/кг | [12] |
| Кролики | LD50 | накожно | >2000 мг/кг | [39] |
| Крысы-самцы | LD50 | в/ж | 2292 мг/кг | [13] |
| Крысы-самки | LD50 | в/ж | 3055 мг/кг | [13] |
| Перепел | LC50 | с пищей | >5,62 ppm | [39] |
| Дикая утка | LC50 | с пищей | >5,62 ppm | [39] |
| Перепел | LD50 | per os | 2,013 мг/кг | [39] |
| Радужная форель (Oncorhynchus mykiss) | LC50 | — | 1,9 ppm | [39] |
| Окунь солнечный (Lepomis macrochirus) | LC50 | — | 0,6 ppm | [39] |
| Дафния (Daphnia magna) | EC50 | — | 0,06 мг/л | [39] |
NOEL рассчитана как 0,5 г/кг.
В исследовании, выполненном Food and Drug Research Laboratories в 1989 г., 0,1 г хлоргексидина ацетата (чистота 99,5%) помещали в конъюктивальный мешок новозеландских белых кроликов. Через 1, 24, 48, 72 ч, а также на 4 и 7 сутки проводили оценку состояния глаз. Возникало серьезное раздражение глаз, что потребовало умерщвления животных на 7-е сутки эксперимента из соображений гуманности [13].
В исследовании, выполненном также Food and Drug Research Laboratories в 1989 г., 0,5 г хлоргексидина ацетата в 0,5 мл физиологического раствора помещали на постриженную кожу новозеландских кроликов на 4 часа. Раздражение кожи оценивали на 0,5, 24, 48 и 72 ч после удаления повязки (4 часа экспозиции). Раздражения кожи не наблюдалось на всех сроках [13].
Через 3 часа после местного применения раствора хлоргексидина глюконата в глаза наблюдались выраженная деэпителизация рогового слоя, конъюктивальный хемоз, отек передней стромы [32].
Хлоргексидин вводили перорально однократно крысам Sprague-Dawley в дозах 2000, 2646 или 3500 мг/кг. Через 15 суток оценивали токсические эффекты, эффекты присутствовали во всех дозах [13].
При накожном применении раствора хлоргексидина ацетата в течение 24 ч (под повязкой) в дозе 2000 мг/кг отмечалось покраснение кожи в месте аппликации (эритема, отек, сухость) [13].
При применении аэрозоля с хлоргексидином 0,1, 0,46 и 5,09 мг/л в течение 4,5 ч смертельные исходы зарегистрированы в группе с самой высокой дозой за 2 ч (летальность 100%, при средней дозе — 90%, низкой — 0%). Все животные имели при вскрытии бледные легкие, трахею, заполненную слизью, помутнение роговицы, бесцветный и раздутый кишечник. LC50 для самцов была 0,30 мг/л (0,12–0,77 мг/кг), для самок — 0,43 мг/л (0,18–1,07 мг/л) [13].
Описан случай развития метгемоглобинемии и цианоза у недоношенных детей, находившихся в инкубаторе, вследствие отравления 4-хлороанилином. Инкубатор был оборудован увлажнителем с раствором хлоргексидина, который при нагревании способен разлагаться до 4-хлороанилина. Отмечена повышенная концентрация метгемоглобина в крови (от 6,5 до 45,5% при норме до 2,3% и фатальном уровне — свыше 70%) [7].
Хроническая токсичность
В 13-недельном исследовании субхронической накожной токсичности на новозеландских белых кроликах, проведенном в Hazleton Laboratories America, Inc., изучались накожные дозы хлоргексидина диацетата: 0, 250, 500 или 1000 мг/кг/сут. При использовании минимальной дозы наблюдалось минимальное раздражение кожи (покраснение, отек, слущивание и/или растрескивание). Также отмечены эффекты повышения уровня аминотрансфераз у самок, а также дегенеративные изменения или некроз гепатоцитов при микроскопии при дозе 500 мг/кг/сут [39].
С использованием 3-Н тимидина и метода авторадиографии оценивался индекс метки, темп миграции меченых клеток и толщина эпителия в слизистой рта и кожи мышей после использования 2% раствора ХГ или дистиллированной воды, которые наносились дважды в день в течение 7 суток в полость рта. Наблюдалась небольшое, но стойкое уменьшение степени регенерации эпителия в опытной группе. Предполагалось, что прямой раздражающий эффект хлоргексидина на слизистую рта повысит локальную скорость регенерации эпителия, но подобные изменения наблюдались. Не было изменения индекса метки в печени, изменения прибавки в весе у экспериментальных животных [30].
Целью работы, выполненной в 2007 г. в ФГУН «Институт токсикологии» (Санкт-Петербург), являлось доклиническое изучение общетоксического действия хлоргексидина в остром и хроническом эксперименте при интравагинальном введении. Опыты выполнены на белых крысах и кроликах (самках). В хроническом эксперименте изучено влияние препарата при интравагинальном введении крысам в дозах 4,6 и 46,0 мг/кг и кроликам в дозах 0,46 и 4,6 мг/кг (по активному началу) на общее состояние и поведение животных, интегральные параметры, характеризующие основной обмен, на функциональное состояние сердечно-сосудистой системы, печени и почек; морфологический состав и биохимические показатели периферической крови, характер миелограммы; на патоморфологические и гистологические показатели. Продемонстрировано, что хлоргексидин при интравагинальном введении во всех исследованных дозах не приводит к развитию патологических сдвигов со стороны функций изученных органов и систем, не вызывает дистрофических, деструктивных, очаговых склеротических изменений в паренхиматозных клетках и строме изучаемых органов и не обладает местно-раздражающим действием при интравагинальном введении [4].
Канцерогенность
Исследования канцерогенности хлоргексидина проводились на мышах и крысах линии Вистар в соответствии с правилами GLP. Хлоргексидин в дозе 100, 200, 400 и 800 мг/кг включался в состав корма мышей в течение 78 недель. У группы, получавшей максимальную дозу, отмечалась высокая летальность. В группах, получавших 200 и 400 мг/кг хлоргексидина, отмечалось снижение массы тела животных. В составе корма крыс доза хлоргексидина составляла 5, 25, и 50 мг/кг в течение 105 недель. Снижение массы тела отмечалось у животных, получавших 50 мг/кг хлоргексидина, и у самок, получавших 25 и 50 мг/кг хлоргексидина. Данных, указывающих на канцерогенное действие хлоргексидина, не получено [14].
В исследованиях, проведенных Национальным институтом рака США (U. S. National Cancer Institute), изучался возможный канцерогенный эффект 4-хлороанилина — продукта распада хлоргексидина при нагревании в щелочной среде. На пробах клеток мышей линии B6C3F1 и крыс линии Fischer 344 получены двусмысленные данные. Концентрация 4-хлороанилина измерялась в пище и тканях грызунов. В почках мышей до 52-й недели эксперимента 4-хлороанилин не выявлялся, однако начиная с 65-й недели измеримые концентрации (0,232 мкг/г) определялись в почках мышей, получавших 4-хлороанилин в дозе 200 и 400 мг/кг/сут. В эксперименте на крысах концентрации 4-хлороанилина были низкими (0,01 мкг/г в ткани почек через 12–15 мес. и 0,22 мкг/г в легких через 18 мес.). Животные получали с пищей максимально до 0,36 (крысы) и 0,6 мг/кг/сут. (мыши) 4-хлороанилина [14].
Генотоксичность, мутагенность
Хлоргексидин в концентрации 0,002–2% не проявляет мутагенного действия в бактериальных тестах на мутагенность in vitro [45].
Генотоксические эффекты хлоргексидина глюконата не наблюдались в 2 исследованиях на клетках млекопитающих. Самые высокие дневные дозы хлоргексидина используемые в исследованиях на доминантные летальные мутации у мыши и в цитогенетическом тесте на хомячках были 1000 и 250 мг/кг соответственно. Результаты серьезного исследования на мутагенность, включающие тест Ames in vitro, исследование хромосомных аббераций на яйцеклетках китайского хомячка, in vivo микроядерный тест не доказали потенциальной генотоксичности хлоргексидина [32].
Целый ряд тестов на мутагенность оценивал мутагенность хлоргексидина диацетата. Сформулировано, что в дозы до цитотоксических (6 мкг/мл в исследованиях без активации и 15–16 мкг/мл с активацией) на культуре клеток лимфомы мыши. Отрицательные результаты получены также in vitro в цитогенетических тестах на яйцеклетках китайских хомячков (до 10 мкг/мл не наблюдается повреждений хромосом при 30% снижении роста клеток). На культурах клеток гепатоцитов также не отмечено повреждения ДНК [39].
Многочисленные тесты на генотоксичность, проведенные в США в 1979–1983 гг. (в Raltech Scientific; Hazleton Laboratories America, Inc.; Litton Bionetics, Inc.), показали отрицательные результаты на разных тест-системах [13].
Тератогенность, эмбриотоксичность
В Университете Брингтона (University of Brighton, Moulsecoomb, Великобритания) изучались тератогенность и цитотоксичность хлоргексидина и полимеров (пустотелых нейлоновых нитей), выделяющих хлоргексидин in vitro на монослоях эндотелиоцитов и in vivo. Хлоргексидина диацетат оказался цитотоксичным в концентрации 1 мг/мл, нейлоновые нити увеличивали токсичность. На морских свинках показано, что повреждение эндометрия может наблюдаться только при высоких дозах хлоргексидина, что свидетельствует о хорошем распределении препарата in vivo. На изолированных эмбриональных клетках конечности зародыша крысы продемонстрирована высокая устойчивость фетальных клеток к хлоргексидину, показано отсутствие тератогенного эффекта [36].
Исследование тератогенного действия проводилось на крысах и кроликах, получавших хлоргексидин в составе корма (0,05%, 0,1%, 0,25% и 0,45% диеты) в течение беременности. Установлено, что у кроликов диета, содержащая 0,45% хлоргексидина, вызывает увеличение частоты прерывания беременности. У крыс в этих условиях выявлено снижение массы тела беременных животных. Диета с содержанием хлоргексидина 0,25%, ведет у кроликов к снижению веса плода. Никаких свидетельств тератогенного и фетотоксического действия в этих и других экспериментах не обнаружено [14].
В исследовании, выполненном в 2008 г. в ФГУН «Институт токсикологии» (Санкт-Петербург) на виргинных нелинейных белых крысах-самках, было показано, что введение препарата в различные периоды беременности не оказывает токсического влияния на ее течение, не вызывает эмбриотоксического и тератогенного действия, отклонений физического развития, скорости развития сенсорно-двигательных функций и эмоционально-двигательной активности потомства [5].
Репродуктивная функция
При исследовании влияния хлоргексидина на фертильность и репродуктивную функцию крыс хлоргекисдин давался с питьевой водой в концентрации, обеспечивающей дневную дозу 4,9 и 44,4 мг/кг, в течение 14 дней до спаривания с интактными самцами. В группе, получавшей высокую дозу хлоргексидина, выявлено достоверное снижение числа жизнеспособных плодов на 13-й день беременности, а также уменьшение веса тела самок и потомства. Свидетельств тератогенного действия хлоргексидина не выявлено [14].
Исследование влияния хлоргексидина на пери- и постнатальное развитие проводилось у беременных крыс, начиная с 15-го дня гестации до 21-го послеродового дня, включая период лактации. Животные получали хлоргексидин перорально в течение этого периода в дозе 10 и 50 мг/кг в день. У крыс, получавших высокую дозу препарата, выявлена повышенная возбудимость в течение первой недели исследования. Других свидетельств токсического действия препарата на организм матери и плода не выявлено [14].
В WIL Research Laboratories, Inc. в 1991 г. изучалась токсичность хлоргексидина в отношении развития в дозах 0, 15,63, 31,25 и 62,5 мг/кг/сут. перорально на крысах Sprague-Dawley в сроки 6–15 дней беременности. NOEL для токсичности матери найден как 15,63 мг/кг/сут. Высокие дозы показывали дозозависимое уменьшения прибавки веса тела, хрипы и повышенное слюноотделение (LOEL 31,25 мг/кг/сут, HDT 62,5 мг/кг/сут.). Никаких аномалий развития не отмечено при всех тестируемых дозах. NOEL для токсичность развития больше или равна самой высокой дозе, 62,5 мг/кг/сут. [39]
Цитотоксичность
Исследовалась цитотоксичность хлоргексидина глюконата на тесте in vitro в отношении культуры эпителиальных клеток щеки хомяка при экспозиции 0–0,01% хлоргексидина глюконата 5–60 мин. и затем нистатин. Хлоргексидин был цитотоксичным в концентрациях более 0,005% после 1 ч инкубации. 5-минутный контакт не вызывал значительных эффектов, если концентрация была меньше 0,01%. Линейное снижение выживаемости наблюдалось при концентрации 20 мкг/мл (0,01–0,02%) нистатина. Клетки щечного эпителия очень устойчивы к хлоргексидину [48].
На брюшинных макрофагах мыши показано, что хлоргексидин не имеет иммуностимулирующей активности, не влияет на ответ макрофагов на стимуляцию [9].
Известны случаи реакций гиперчувствительности (включая реакции немедленного и замедленного типа) в ответ на местное применение хлоргексидина на кожу и слизистые оболочки. Использование хлоргексидина в концентрации 0,05% в отношении ран и интактной кожи считается безопасным, известен только один случай анафилактической реакции. Гиперчувствительность к хлоргексидину редка, однако считаться с этим фактом необходимо [25].
Таким образом, хлоргексидин обладает слабо выраженными токсическими свойствами у млекопитающих (например, раздражающим действием), не зарегистрированы тератогенные, канцерогенные, фетотоксические, цитотоксические, мутагенные свойства хлоргексидина. Хлоргексидин нетоксичен или слаботоксичен для птиц, умеренно или высокотоксичен для рыб, очень высоко токсичен для беспозвоночных. Канцерогенным эффектом, возможно, обладает 4-хлороанилин — продукт распада хлоргексидина.
Данных об иммунотоксическом действии хлоргексидина биглюконата в доступной литературе не обнаружено.
1.5. Перечень используемой научной литературы
1. Машковский, М. Д. Лекарственные средства. В 2-х тт.— М.: Изд-во «Новая Волна», 2001.— 608 с.
2. Мухина, И. В. Изучение специфической фармакологической активности препарата Гексикон® (гель) на модели инфекционного дерматита и инфекционной ожоговой раны в сравнении с препаратами Бактробан (мазь) и Левомеколь® (мазь). Экспериментальное изучение лубрикантных свойств Гексикон® , геля.— Нижний Новгород, 2005.— 37 с.
3. Регистр лекарственных лредств России [Электронный ресурс].— Электрон. текстовые дан.— М.: Группа компаний РЛС, 2008.— Режим доступа: rlsnet.ru/, свободный.
4. Саватеева, Т. Н., Лесиовская, Е. Е., Лычаков, А. В., и др. Доклиническое изучение общетоксического действия препарата «Гексикон® », таблетки вагинальные.— Санкт-Петербург: ФГУН «Институт токсикологии» 2007.— 58 с.
5. Саватеева, Т. Н., Лесиовская, Е. Е., Стройкова, Г. С., и др. Отчет об изучении эмбриотоксического, тератогенного и местно-раздражающего действия препарата «Гексикон® » (таблетки вагинальные).— Санкт-Петербург: ФГУН «Институт токсикологии» 2008.— 18 с.
6. Хлоргексидин // Обращение лекарственных средств [Электронный ресурс] / ФГУ «Научный центр экспертизы средств медицинского применения».- Электрон. дан.- Режим доступа: regmed.ru/, свободный.
7. 4-chloroaniline: Concise International Chemical Assessment Document 48.— Geneva: World Health Organization, 2003.— 62 p.
8. Andrews, J. J., Paul, J. W. Chlorhexidine fogging: a safety study in dogs // Vet. Med. Small Anim. Clinician.— 1977.— Vol. 72.— N. 8.— P. 1330, 1332-1334.
9. Bonacorsi, C., Raddi, M. S., Carlos, I. Z. Cytotoxicity of chlorhexidine digluconate to murine macrophages and its effect on hydrogen peroxide and nitric oxide induction // Braz. J. Med. Biol. Res.— 2004.— Vol. 37.— N. 2.— P. 207-212.
10. Brown, A. T., Sims, R. E., Raybould, T. P., et al. Oral Gram-negative Bacilli in Bone Marrow Transplant Patients Given Chlorhexidine Rinses // J. Dent. Res.— 1989.— Vol. 68.— P. 1199-1204.
11. Brown, T. R., Ehrlich, C. E., Stehman, F. B., et al. A clinical evaluation of chlorhexidine gluconate spray as compared with iodophor scrub for preoperative skin preparations // Surgery, Gynecology & Obstetrics.— 1984.— Vol. 158.— P. 363-366.
12. Case, D. E. Safety of Hibitane I. Laboratory experiments // J. Clin. Periodontol.— 1977.— Vol. 4.— N. 5.— P. 66-72.
13. Chlorhexidine diacetate: Summary of toxicology data.— Sacramento, CA: California Environmental Protection Agency, 2003.— 7 p.
14. Chlorhexidine: Summary report.— London: The European Agency for the Evaluation of Medicinal Products, 1996.— 4 p.
15. Chow, C. P., Buttar, H. S., Downie, R. H. Percutaneous absorption of chlorhexidine in rats // Toxicol. Lett.— 1978.— Vol. 1.— N. 4.— P. 213-216.
16. Cookson, B. D., Bolton, M. C., Platt, J. H. Chlorhexidine resistance in methicillin-resistant Staphylococcus aureus or just an elevated MIC? An in vitro and in vivo assessment // Antimicrob. Agents Chemother.— 1991.— Vol. 35.— N. 10.— P. 1997-2002.
17. Cury, J. A., Rocha, E. P., Koo, H., et al. Effect of Saccharin on Antibacterial Activity of Chlorhexidine Gel // Braz. Dent. J.— 2000.— Vol. 11.— N. 1.— P. 29-34.
18. Delany, C. M., Yong, S., Gajjar, M., et al. In vitro Study of the Efficacy of Chlorhexidine in the Management of Infectious Keratitis // Invest. Ophthalmol. Vis. Sci.— 2005.— Vol. 46.— P. 4881.
19. do Amorim, C. V. G., Aun, C. E., Mayer, M. P. A. Susceptibilidade de alguns microrganismos orais frente à clorexidina e ao paramonoclorofenol // Braz. Oral Res.— 2004.— Vol. 18.— N. 3.— P. 242-246.
20. Fani, M. M., Kohanteb, J., Dayaghi, M. Inhibitory activity of garlic (Allium sativum) extract on multidrug-resistant Streptococcus mutans // J. Indian. Soc. Pedod. Prev. Dent.— 2007.— Vol. 25.— N. 4.— P. 164-168.
21. Gongwer, L. E., Hubben, K., Lenkiewicz, R. S., et al. The effects of daily bathing of neonatal rhesus monkeys with an antimicrobial skin cleanser containing chlorhexidine gluconate // Toxicol. Appl. Pharmacol.— 1980.— Vol. 52.— N. 2.— P. 255-261.
22. Gouin, S., Patel, H. Office management of minor wounds // Can. Fam. Physician.— 2001.— Vol. 47.— P. 769-774.
23. Henretig, F. M., King, C. Textbook of pediatric emergency procedures.— Baltimore, MD: Williams & Wilkins, 1997.— 1487 p.
24. International Congress and Symposium Series - Royal Society of Medicine Services Limited.- 1980.- Vol.23.- P.45.
25. Krautheim, A. B., Jermann, T. H. M., Bircher, A. J. Chlorhexidine anaphylaxis: case report and review of the literature // Contact Dermatitis.— 2004.— Vol. 50.— N. 3.— P. 113.
26. Lafforgue, C., Carret, L., Falson, F., et al. Percutaneous absorption of a chlorhexidine digluconate solution // Int. J. Pharm.— 1997.— Vol. 147.— N. 2.— P. 243-246.
27. Larsen, T., Stoltze, K., Fiehn, N.-E. Susceptibility of biofilms of Streptococccus sanguis and Actinomyces naeslundii to chlorhexidine // Biofilm J.— 2006.— Vol. 2.— N. 1.
28. Larson, E. Guideline for use of topical antimicrobial agents // Am. J. Infect. Control — 1988.— Vol. 16.— P. 253-266.
29. Lowbury, E. J. L., Lilly, H. A. The effect of blood on disinfection of surgeons hands // Br. J. Surg.— 1974.— Vol. 61.— P. 19-24.
30. Mackenzie, I. C. The effects of oral administration of chlorhexidine on the rate of regeneration of epithelia of the oral mucosa and skin of mice // J. Periodontal Res.— 1974.— Vol. 9.— N. 3.— P. 181-187.
31. Mayhall, C. G. Surgical infections including burns / Prevention and control of nosocomial infections. 2nd ed. . Ed. R. P. Wenzel.— Baltimore: Williams and Wilkins, 1993.— P. 614-664.
32. American Hospital Formulary Service - Drug Information 2003. / McEvoy, G. K. (ed.).— Bethesda, MD: American Society of Health-System Pharmacists, Inc., 2003.— 3749 p.
33. Meberg, A., Schoyen, R. Bacterial colonization and neonatal infections. Effects of skin and umbilical disinfection in the nursery // Acta Paediatr. Scand.— 1985.— Vol. 74.— N. 3.— P. 366-371.
34. Nilsson, G., Larsson, L., Christensen, K. K., et al. Chlorhexidine for prevention of neonatal colonization with group B streptococci. V. Chlorhexidine concentrations in blood following vaginal washing during delivery // Eur. J. Obstet. Gynecol. Reprod. Biol.— 1989.— Vol. 31.— N. 3.— P. 221-226.
35. The Merck Index - An Encyclopedia of Chemicals, Drugs, and Biologicals. / O'Neil, M. J. (ed.).— Whitehouse Station, NJ: Merck and Co., Inc., 2001.
36. Ostad, S. N., Gard, P. R. Cytotoxicity and teratogenicity of chlorhexidine diacetate released from hollow nylon fibres // J. Pharm. Pharmacol.— 2000.— Vol. 52.— N. 7.— P. 779-784.
37. Pharmaceutical Excipients [Электронный ресурс].— Электрон. текстовые дан.— London: Pharmaceutical Press; American Pharmacists Association, 2004.— Режим доступа: medicinescomplete.com/mc/excipients/current/, свободный.
38. PROVON® antimicrobal skin cleanser with 2% CHG: MSDS Form.— Akron, OH: GOJO Industries, 2000.— 2 p.
39. Reregistration Eligibility Decision (RED): Chlorhexidine diacetate.— Washington, DC: United States Environmental Protection Agency, 1996.— 108 p.
40. Russell, A. D. Do biocides select for antibiotic resistance? // J. Pharm. Pharmacol.— 2000.— Vol. 52.— N. 2.— P. 227-233.
41. Sheng, W. H., Wang, J. T., Lauderdale, T. L., et al. Epidemiology and susceptibilities of methicillin-resistant Staphylococcus aureus in Taiwan: emphasis on chlorhexidine susceptibility // Diagn. Microbiol. Infect. Dis.— 2009.— Vol. 63.— N. 3.— P. 309-313.
42. Snelling, C. F., Roberts, F. J. Comparison of 1% silver sulfadiazine with and without 1% chlorhexidine digluconate for topical antibacterial effect in the burnt infected rat // J. Burn. Care Rehabil.— 1988.— Vol. 9.— P. 35-40.
43. Syam, P. P., Narendran, R., van der Hoek, J. Persistent acanthamoeba keratitis in a non-contact lens wearer following exposure to bird seed dust // Br. J. Ophthalmol.— 2005.— Vol. 89.— N. 3.— P. 388-389.
44. Tanaka, T., Murayama, S., Tuda, N., et al. Microbial Degradation of Disinfectants. A New Chlorhexidine Degradation Intermediate (CHDI), CHDI-C, Produced by Pseudomonas sp. Strain No. A-3 // J. Health Sci.— 2005.— Vol. 51.— N. 3.— P. 357–361.
45. TOXNET - Databases on toxicology, hazardous chemicals, environmental health, and toxic releases [Электронный ресурс].— Электрон. текстовые дан.— Bethesda, MD: United States National Library of Medicine, 2009.— Режим доступа: http://toxnet.nlm.nih.gov/, свободный.
46. Wilson, C. M., Gray, G., Read, J. S., et al. Tolerance and safety of different concentrations of chlorhexidine for peripartum vaginal and infant washes: HIVNET 025 // J. Acquir. Immune Defic. Syndr.— 2004.— Vol. 35.— N. 2.— P. 138-143.
47. Yakuri to Chiryo. Pharmacology and Therapeutics.- 1978.- Vol.6.- P.2599.
48. Zheng, H., Audus, K. L. Cytotoxic effects of chlorhexidine and nystatin on cultured hamster buccal epithelial cells // Int. J. Pharm.— 1994.— Vol. 101.— P. 121-126.
Читать следующий раздел:
2. Сведения о результатах клинических исследований лекарственного средства хлоргексидин
Комментарии
ПРАКТИКА ПЕДИАТРА
