Остеоартроз: основы терапии
СтатьиН.А. Шостак
Кафедра факультетской терапии им. акад. А.И. Нестерова ГОУ ВПО РГМУ Росздрава
Остеоартроз (ОА) – гетерогенная группа заболеваний разной этиологии со сходными биологическими, морфологическими и клиническими проявлениями, а также исходом, в основе которых лежит поражение всех компонентов сустава (хряща, субхондральной части кости синовиальной оболочки, связок, капсулы, периартикулярных мышц). Широко используется также другое название этого заболевания «остеоартрит», из-за частых выявлений сопутствующих признаков воспаления.
ОА – самое распространенное заболевание суставов, поражающее как мужчин, так и женщин, и чаще развивающееся у мужчин в возрасте до 45 лет и у женщин старше 55 лет. Распространенность ОА одинакова у лиц обоего пола старше 70 лет (встречается практически у каждого в этой возрастной группе).
Различают первичный и вторичный ОА. Первичный (идиопатический) ОА развивается в периферических суставах, наиболее часто в дистальных и проксимальных межфаланговых суставах кистей (с образованием узелков Гебердена и Бушара), I запястно-пястном, I плюснефаланговом, тазобедренном и коленном суставах, межпозвоночных дисках и суставах позвоночника (особенно шейного и поясничного отделов).
В зависимости от распространенности процесса выделяют две формы первичного ОА:
- локальную (характеризующуюся поражением одного или двух суставов (ОА суставов кистей, стоп, коленного, тазобедренного суставов, ОА позвоночника);
- генерализованную, для которой характерно поражение 3 и более суставов или группы суставов (проксимальные и дистальные межфаланговые суставы оценивают как две разные группы).
Вторичный ОА развивается в результате травмы, врожденной дисплазии опорно-двигательного аппарата, эндокринных заболеваний (акромегалия, гиперпаратиреоз), метаболических нарушений (охроноз, гемохроматоз, подагра) и других заболеваний костей и суставов (ревматоидный артрит, инфекционные артриты, асептические некрозы костей).
Ведущими патогенетическими факторами при ОА являются дегенерация и деструкция суставного хряща, развивающиеся вследствие несоответствия между механической нагрузкой на суставную поверхность хряща и его способностью сопротивляться этой нагрузке.
Наиболее выраженные патоморфологические изменения при ОА происходят в хрящевом матриксе. Его основу составляет коллагеновая сеть, стабильность которой обеспечивают белково-полисахаридные комплексы – протеогликаны. Количественные и качественные изменения протеогликанов, а также вызванное ими нарушение стабильности коллагеновой сети лежат в основе изменения структуры хряща. Неблагоприятные изменения в строении макромолекул хрящевой ткани являются результатом повышенного синтеза и освобождения из хондроцитов коллагеназы, стромелизина (металлопротеаз), разрушающих протеогликаны и коллагеновую сеть. Увеличение в пораженном хряще синтеза коллагеназы и стромелизина может быть генетически обусловленным и находится под контролем цитокинов.
Таким образом, концепция ОА как дегенеративного поражения суставного хряща, дополнена новыми данными о роли хронического воспаления в его формировании и прогрессировании (см. рисунок).
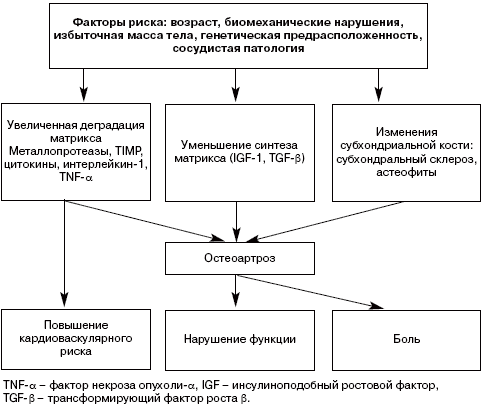
Основные звенья патогенеза ОА.
Основными клиническими проявлениями ОА являются боль, деформация и тугоподвижность суставов.
Боль в пораженных суставах является основным клиническим симптомом ОА (табл. 1).
Таблица 1. Основные типы болей при остеоартрозе.
|
При обследовании пациентов также необходимо учитывать факторы, способствующие развитию ОА:
- наличие хронической микротравматизации хряща;
- возраст пациентов;
- наличие ожирения;
- нагрузку на суставы;
- наличие врожденных или приобретенных дефектов опорно-двигательного аппарата;
- наследственную предрасположенность (узелки Гебердена встречаются в 2 раза чаще у матерей и в 3 раза чаще у сестер больного ОА).
Основными целями терапии ОА являются замедление прогрессирования дегенерации хряща и максимально возможное сохранение функции сустава. Терапевтическая тактика при ОА предполагает:
- механическую разгрузку пораженных суставов;
- купирование синовита;
- предотвращение прогрессирования заболевания.
Известные факторы прогрессирования ОА, представленные в табл. 2, указывают на то, что немедикаментозные методы являются важнейшими при лечении больных с ОА.
Таблица 2. Факторы риска прогрессирования ОА
| Фактор риска ОА | Уровень доказательности |
|---|---|
| Коленных суставов | |
| низкий уровень образования | С |
| ожирение | В |
| снижение мышечной силы | С |
| продолжительность и тяжесть симптомов ОА | В |
| рентгенологические признаки ОА, в частности ширина суставной щели | В |
| наличие варусной или вальгусной деформации | В |
| у женщин возраст 40 лет и старше | В |
| низкий уровень приема с пищей витамина D и низкий уровень акт вит D в сыворотке крови | В |
| Тазобедренных суставов | |
| низкий уровень образования | С |
| интенсивная физическая нагрузка во время работы | В |
| клинические симптомы ОА | С |
| высокий индекс массы тела (фактор риска протезирования) | В |
| старший возраст (фактор риска протезирования) | С |
| Факторы, препятствующие прогрессированию функциональной недостаточности при ОА | |
| хорошее ментальное состояние, способность обслуживать себя самостоятельно, социальная помощь и выполнение аэробных упражнений | В |
Таблица 3. Основные механизмы действия хондропротекторных препаратов
|
К немедикаментозным методам лечения относят знакомство пациента с особенностями ОА, рекомендации по снижению веса и выполнению физических упражнений. Было показано, что уменьшение массы тела у пациентов с ОА коленного сустава приводит к уменьшению боли и улучшению функции сустава, а уменьшение массы тела на 5 кг или до нормального, рекомендованного уровня позволило бы избежать 24% операций на коленном суставе. Пациентам с ОА коленного сустава необходимо выполнять программу физических упражнений, включающую упражнения на укрепление четырехглавой мышцы бедра и увеличение объема движений, а также аэробные нагрузки, занятия в бассейне. Кроме того, пациентам рекомендуется соблюдать следующие правила: ограничить длительное неподвижное стояние и частый подъем по лестнице, избегать положений с упором на колени, с пребыванием на корточках. Для разгрузки пораженных суставов рекомендуется также использовать при ходьбе трость, а при выраженной деформации и нестабильности сустава – ортезов, эластичного бандажа или адгезивной повязки.
Для уменьшения отека и увеличения функциональной активности суставов при гонартрозе рекомендуется использовать прерывистое воздействие локальным охлаждением (пакеты со льдом). Среди физиотерапевтических методов воздействия на симптомы ОА наиболее показано применение переменного магнитного поля низкой частоты, а при неэффективности нестероидных противовоспалительных препаратов (НПВП) – чрескожной электронейростимуляции.
Все медикаментозные методы лечения ОА делятся на 3 основные группы: симптомомодифицирующие средства быстрого действия (простые анальгетики, НПВП, опиоидные анальгетики, внутрисуставное введение глюкокортикостероидов, трансдермальные формы лекарств), симптомомодифицирующие средства замедленного действия (хондроитин сульфат, глюкозамин сульфат, пиаскледин, препараты гиалуроновой кислоты), структурно-модифицирующие препараты (возможно, к этой группе будут отнесены хондроити нсульфат, глюкозамин сульфат, пиаскледин, стронция ранелат, диацерин).
Лекарственные средства, относящиеся к группе структурно-модифицирующих препаратов, часто называют хондропротекторами, имеющими комплексный механизм действия. Обладая тропностью к хрящу, они способны стимулировать синтез хрящевого матрикса, угнетая его деструкцию (табл. 4).
Таблица 4. Современные рекомендации по применению симптоммодифицирующих препаратов медленного действия и структурно-модифицирующих препаратов
| Рекомендация | Уровень доказательности |
|---|---|
| Глюкозаминсульфат и хондроитинсульфат, назначаемые внутрь, эффективнее плацебо уменьшают боль и улучшают функциональную активность при ОА коленных суставов легкой или средней степени тяжести | А |
| Анальгетическое действие при использовании глюкозамина и хондроитина сопоставимо с таковым при использовании НПВП: эффект развивается медленнее, но сохраняется дольше после отмены препарата | А |
| Имеются данные о том, что при гонартрозе эти средства замедляют (приостанавливают) сужение суставной щели по рентгенографическим признакам, однако в настоящий момент доказательств хондропротективного эффекта этих препаратов недостаточно | В |
| Есть данные о симптоматическом эффекте хондроитинсульфата при коксартрозе, по глюкозаминсульфату таких сведений нет | В |
Адекватное количество хондроитин сульфата в хрящевой ткани необходимо для поддержания нормальной функции суставов и регенерации суставных поверхностей суставов при их повреждении. Являясь естественным глюкозамингликаном, расположенным в экстрацеллюлярном матриксе суставного хряща, хондроитин сульфат ингибирует свободные радикалы, способные вызывать разрушение хряща и коллагена, угнетает активность ферментов, вызывающих поражение хрящевой ткани, участвует в синтезе глюкозаминогликанов и увеличивает продукцию внутрисуставной жидкости.
Хондроитинсульфат играет важную роль в реализации эффектов других симптомомодифицирующих препаратов медленного действия и хондропротекторов. Он стимулирует синтез гиалуроновой кислоты, необходимой для подержания адекватного уровня гидратации и вязкости синовиальной жидкости, обусловливающей хорошую конгруентность суставных поверхностей костей.
На сегодняшний день имеется большое число данных о симптоммодифицирующих свойствах хондроитин-сульфата, а также о его структурно-модифицирующем действии. Так, например, результаты рандомизированного двойного слепого плацебо–контролируемого проспективного исследования хондроитин сульфата у больных ОА суставов кистей, представленного Verbruggen G., в которое было включено 119 больных (34 больных принимали хондроитин сульфат по 400 мг 3 раза в сутки, 85 больных – плацебо 3 года) показали, что за 3-летний период наблюдения выявлено не только уменьшение боли в суставах, но и достоверное уменьшение числа новых эрозий в суставах кистей по данным рентгенографии. Исследование, проведенное Michel B.A. с соавт., было первым, в котором использовалась структурная «конечная точка» (динамика изменения ширины суставной щели) в качестве главного критерия оценки действия хондроитин сульфата. В данном рандомизированном, двойном слепом, плацебо-контролируемом исследовании принимали участие 300 пациентов с остеоартрозом коленного сустава: 150 человек принимали 800 мг хондроитин сульфата и 150 человек – плацебо 1 раз в день в течение 2 лет. Было показано, что терапия хондроитин сульфатом оказывала статистически достоверное стабилизирующее влияние на ширину суставной щели у больных гонартрозом при длительном (2-х летнем) лечении.
Глюкозамин является аминомоносахаридом, в организме он используется хондроцитами как исходный материал для синтеза протеогликанов, глюкозаминогликанов и гиалуроновой кислоты. В многочисленных исследованиях фармакологических эффектов глюкозамина установлено благоприятное влияние на метаболизм хряща – усиление анаболических и ослабление катаболических процессов. Установлены стимуляция глюкозамином синтеза протеогликанов и коллагена, повышение продукции компонентов внеклеточного матрикса, при этом свойства глюкозаминогликанов и протеогликанов (по данным хроматографического анализа) были близки к физиологическим. Глюкозамин стимулировал включение маркера синтеза глюкозаминогликанов в хондроциты и усиливал синтез глюкозаминогликанов в культуре клеток. Повышение синтетической активности хондроцитов сопровождалось ингибированием хондролизиса, обусловленным торможением активности хондролитических протеиназ (коллагеназ и др.), что и является основой хондропротекторного и остеотропного эффектов.
Глюкозамин проявляет умеренное противовоспалительное действие на различных моделях воспаления, которое не связано с подавлением синтеза простагландинов, а реализуется за счет антиоксидантной активности (путем блокирования образования супероксидных радикалов) и подавления активности лизосомальных ферментов.
В большинстве сравнительных клинических исследований, установлено, что эффективность хондроитин сульфата, глюкозамин сульфата и НПВП аналогична таковой диклофенака и ибупрофена в терапевтических дозах. Эти препараты в большей степени, чем плацебо, уменьшали выраженность боли и способствовали увеличению подвижности суставов у больных ОА, т.е. реализовали выраженные симптомомодифицирующие свойства. Хотя эффекты хондроитин сульфата и глюкозамин сульфата наступали несколько позже (на 6–8-й нед лечения), чем НПВП (на 1–2-й нед лечения), после лечения они сохранялись дольше. Важным преимуществом препаратов является хорошая переносимость: побочные проявления при их приеме оказались минимальными (около 1–3% случаев), тогда как при приеме НПВП наблюдались серьезные нежелательныеявления (желудочно-кишечные кровотечения, язвы, перфорации и т.п.), встречающиеся в 30–40% случаев.
Так, в рандомизированном контролируемом сравнительном исследовании действия хондроитин сульфата и диклофенака, проведенном с участием 146 пациентов, выраженность клинических симптомов быстрее редуцировалась у больных, получавших НПВП, однако сразу после отмены терапии эти симптомы возобновлялись. Терапевтиче6ское действие хондроитин сульфата оказалось отсроченным: оно характеризовалось более медленным началом, однако до 3 мес после окончания лечения. Результаты другого рандомизированного контролируемого исследования свидетельствовали о преимуществах хондроитин сульфата перед плацебо у 130 пациентов с ОА коленных суставов и еще раз подтвердили сохранение терапевтического эффекта до 1 мес после окончания лечения.
В двух рандомизированных контролируемых исследованиях сравнивали эффект глюкозамин сульфата с ибупрофеном. В первом, продолжавшемся 8 нед, выраженность болевого синдрома в течение первых 2 нед эффективнее уменьшал ибупрофен, однако к 8-й нед преимущество перешло к глюкозамин сульфату. Во втором исследовании также наблюдалось более быстрое начало действия ибупрофена, однако к 4-й нед терапии оба препарата в одинаковой степени влияли на выраженность боли и функциональную подвижность сустава.
Таблетки Хондроксид®, содержащие хондроитин сульфат 250 мг, особенно показаны для лечения остеохондроза и генерализованной формы остеоартроза, когда требуется помощь сразу нескольким суставам. При исследовании фармакокинетических свойств препарата показано, что максимальная концентрация в плазме достигается через 3–4 часа, а в синовиальной жидкости через 4–5 часов. Хондроксид® замедляет прогрессирование остеоартроза и остеохондроза, положительно влияет на фосфорно-кальциевый обмен в хрящевой ткани, стимулирует регенерацию суставного хряща и хрящевых поверхностей суставов, замедляет процессы разрушения хрящевой и соединительной ткани, ингибирует ферменты, вызывающие ее поражение. Таблетки Хондроксид® рекомендуется применять по 500 мг (2 таблетки) 2 раза в сутки, запивая небольшим количеством воды. Начальный курс лечения должен составлять не менее 6 месяцев.
Терапию таблетками Хондроксид® целесообразно дополнять мазью для наружного применения Хондроксид®. Учитывая, что биодоступность хондроитин сульфата при наружном применении выше, чем при пероральном приеме [11], насыщение хрящевой ткани наиболее страдающих отделов позвоночника и суставов хондроитинсульфатом при комбинированном применении пероральной и местной формы Хондроксида® происходит быстрее. Кроме того, диметилсульфоксид, входящий в состав мази обладает противовоспалительным и анальгезирующим действием, улучшает проникновение хондроитин сульфата через кожу.
Обычно мазь для наружного применения Хондроксид® наносят тонким слоем над пораженным суставом и втирают 2–3 мин до полного впитывания. Процедуру повторяют 3 раза в сутки; курс лечения должен составлять не менее 2 нед.
В клинических исследованиях показано, что мазь для наружного применения Хондроксид® способствует достоверному уменьшению болей и улучшению функции суставов, уменьшению выраженности синовита и продолжительности утренней скованности, повышению качества жизни пациентов. Положительные результаты лечения зарегистрированы у 78,3–82,5% больных ОА I–II стадии.
Таким образом, результаты новейших исследований подтверждают клиническую значимость хондропротекторов при лечении ОА.
Литература
