Внешнесекреторная недостаточность поджелудочной железы у больных после оперативных вмешательств на желудке
СтатьиМаев И.В., Овлашенко Е.А., Кучерявый Ю.А.
ГОУ ВПО МГМСУ Росздрава
Несмотря на тенденцию последних лет к органосохраняющим операциям, оперативное вмешательство в объеме гастрэктомии и субтотальной резекции желудка на сегодняшний день остается «золотым» стандартом радикального лечения рака желудка, позволяющим при ранних стадиях процесса надеяться на полное выздоровление. Оперативное лечение в подобном объеме также выполняется при синдроме Золлингера-Эллисона, болезни Дьелафуа с преимущественным поражением желудка, некоторых формах лимфом желудка [13, 17, 21, 24]. Современное медикаментозное лечение, включающее эрадикационную терапию инфекции Helicobacter pylori, привело к значительному сокращению плановых оперативных вмешательств в объеме резекции желудка. Однако, в силу тех, или иных обстоятельств, медикаментозное лечение не гарантирует выздоровления от язвенной болезни и предотвращения ее осложнений. Частота ургентных оперативных вмешательств по поводу осложнений язвенной болезни в последние годы в России не снижается.
С одной стороны, отдаленные результаты радикального оперативного лечения по поводу рака желудка все еще оставляют желать лучшего, поскольку у многих пациентов отмечается прогрессирование опухолевого процесса. С другой стороны, не существует другого, более эффективного лечения, поскольку методики неоадъювантного химиотерапевтического лечения широко не внедрены в практическую работу, а сроки начала адъювантного лечения нередко не соблюдаются из-за тяжести пациентов в послеоперационном периоде и потребности в длительной реабилитации. Кроме того, противоопухолевые средства, высоко эффективные при аденокарциономе желудка, пока недоступны.
Объемное хирургическое вмешательство с последующим восстановлением целостности пищеварительной трубки влечет за собой ряд анатомических и функциональных изменений желудочно-кишечного тракта, что в ряде случаев может не вызывать заметных нарушений функции системы пищеварения благодаря ее значительным компенсаторным возможностям. Однако, в большинстве случаев после оперативных вмешательств на желудке возникают так называемые, постгастрорезекционные расстройства, значительно снижающие качество жизни пациентов и требующие адекватной медикаментозной коррекции. Исходя из известной взаимосвязи секреции желудка и гепатопанкреатодуоденальной системы, первичная патология желудка (аденокарцинома, язва и лимфома, пилородуоденальный стеноз и др.) изначально приводит к выраженным нарушениям функции гепатопанкреатодуоденальной системы, которые после оперативных вмешательств могут нарастать и приводить к дисфункции пищеварительной системы в целом. Одним из чрезвычайно важных синдромов, не входящих в спектр широко известных, является внешнесекреторная панкреатическая недостаточность, в значительной степени снижающая качество жизни больных и способствующая развитию трофологической недостаточности.
На качество отдаленных результатов хирургического лечения в значительной степени может влиять фактор функциональной адаптации, который определяется методом реконструкции после резекции желудка и восстановления непрерывности кишечной трубки. Выбор метода реконструкции определяется несколькими факторами, в первую очередь, радикальностью выполненного вмешательства, индивидуальными анатомическими особенностями у каждого пациента, навыками и компетентностью каждого хирурга. Радикальность оперативного вмешательства определяется стадией опухолевого процесса и анатомической локализацией опухоли. Так, при опухолях на ранней стадии и небольших экзофитных опухолях в пилорическом отделе методом выбора является субтотальная резекция желудка с реконструкцией по Бильрот-I [2], которая в функциональном отношении наиболее выгодна (сохраняется пассаж химуса по двенадцатиперстной кишке); в остальных случаях – тотальная гастрэктомия с реконструкцией по Бильрот-II. В Японии среди всех возможных реконструкций ЖКТ после гастрэктомии отдается предпочтение Бильрот-I, в то время как в Европе и Северной Америке предпочтение отдается методике Roux-en-Y, менее благоприятной в функциональном отношении чем Бильрот-I [27].
Краткая историческая справка. Летопись изучения постгастрэктомических расстройств ведется давно, еще с 20-х годов прошлого столетия, когда был предложен термин «Dumping-Stomach» («сбрасывающий желудок») для обозначения расстройств у лиц, перенесших резекцию желудка. Уже позднее появляются многочисленные сообщения на основании отдаленных результатов о различных расстройствах, осложняющих резекцию желудка, особенно в модификации по Бильрот-II, которые C.B.Konjetzny назвал «резекционная болезнь». А.А.Бусаловым в 1951 г. были опубликованы результаты тщательного клинического изучения отдельных резекций желудка у 120 больных: у 35% из них имелись те или иные функциональные расстройства, обусловленные не столь техникой выполнения, сколько самой сущностью оперативного вмешательства.
Эпидемиология. По данным М.Н. Окоемова и соавт., различные патологические симптомы в отдаленном периоде после гастрэктомии выявляются у 31% больных [5]. При этом, хронический панкреатит (ХП) развивался после резекции желудка Бильрот I и Бильрот II в модификации Гофмейстер-Финстерер у 18% и 17% больных, соответственно; реже встречался после стволовой ваготомии и резекции Бильрот I, стволовой ваготомии и резекции по Ру – у 6% и 7% больных, соответственно. О реальной частоте внешнесекреторной панкреатической недостаточности можно только догадываться, поскольку эпидемиологических исследований в этой области проведено не было, а потенциальная ее частота существенно выше, чем частота регистрации признаков панкреатита.
Этиопатогенез. Синдром первичной внешнесекреторной недостаточности поджелудочной железы (ПЖ) обусловлен уменьшением массы функционирующей экзокринной паренхимы ПЖ в результате атрофии и фиброза, либо нарушением оттока панкреатического секрета в двенадцатиперстную кишку (ДПК) в силу блока выводных протоков ПЖ конкрементом, опухолью, густым и вязким секретом [4]. Это характерно для муковисцидоза и поздних стадий ХП (абсолютная первичная панкреатическая недостаточность) или, как правило, патологии большого дуоденального сосочка (относительная первичная внешнесекреторная недостаточность). Вторичные механизмы развития экзокринной панкреатической недостаточности включают случаи, когда в ДПК поступает достаточное количество панкреатических ферментов, которые не принимают адекватного участия в пищеварении за счет недостаточной активации, инактивации, нарушений сегрегации. В основе развития внешнесекреторной недостаточности ПЖ у пациентов после гастрэктомии лежит несколько механизмов, как первичных, так и вторичных [15] (Рисунок 1).
Рис. 1. Основные патофизиологические механизмы развития экзокринной панкреатической недостаточности после гастрэктомии
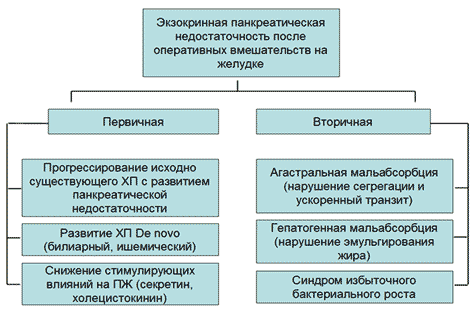
В ранний период после оперативного вмешательства, занимающий недели и месяцы, доминируют вторичные механизмы; далее могут присоединиться первичные за счет прогрессирования ХП и уменьшения стимулирующих влияний на ПЖ.
В первую очередь, особенно при модификации по Бильрот-II, нарушается адекватное перемешивание химуса с панкреатическим соком и желчью в силу чисто анатомических причин (отсутствие пассажа по ДПК при Бильрот-II или быстрый транзит по ДПК при модификации Бильрот-I). Данный факт наиболее ярко охарактеризован E.L. Bradley и соавт. и назван асинхронной панкреатической моторикой, заключающаяся в нарушении скорости продвижения химуса и экзокринного секрета по кишке [10].
Достаточно быстро присоединяется синдром избыточного бактериального роста (СИБР) в тонкой кишке за счет банального отсутствия желудочного антибактериального барьера и несостоятельности антибактериального барьера в ДПК вне зависимости от методики оперативного вмешательства. Избыточный бактериальный рост в тонкой кишке играет огромную роль в развитии синдрома экзокринной панкреатической недостаточности за счет разрушения бактериями панкреатических ферментов, развития воспаления в эпителии тонкой кишки с последующим постепенным развитием атрофии слизистой (снижение секреции кишечных ферментов и снижение выработки холецистокинина и секретина), нарушение цикла энтерогепатической циркуляции желчных кислот (Рисунок 2). Все вышеперечисленное в комплексе усугубляет имеющую место агастральную и гепатогенную мальабсорбцию, потенцирует развитие или прогрессирование хронического панкреатита по билиарному механизму, способствует прогрессированию экзокринной панкреатической недостаточности за счет уменьшения секреции энтероцитами гастринтестинальных пептидов.
Рис. 2. Значение синдрома избыточного бактериального роста в тонкой кишке в развитии экзокринной панкреатической недостаточности после гастрэктомии
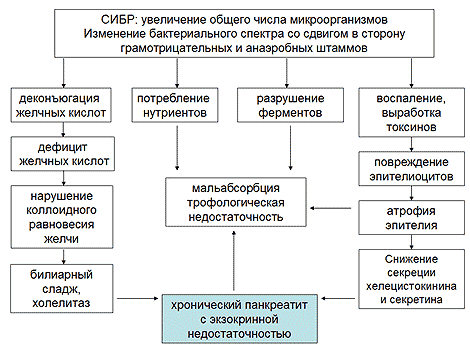
Последний механизм достаточно сложен. Исчезновение S- и I-клеток, секретирующих холецистокинин и секретин, локализованных в антруме, в результате гастрэктомии, и уменьшение их плотности в ДПК в результате атрофии ее слизистой вследствие денервации вагуса, в значительной степени влияет на панкреатическую секрецию. Дефицит секреции секретина приводит к снижению выработки бикарбонатов ацинарными клетками дуктул, что способствует образованию густого и вязкого панкреатического секрета, снижению общего объема с последующим повышением давления в панкреатических протоках. В условиях денервации вагуса и резко нарушенной анатомии желудочно-кишечного тракта, особенно в модификации Бильрот-II, у большинства больных отмечаются элементы синдрома приводящей петли снарушением ее опорожнения, что сопровождается существенным повышением давления в ДПК и спазмом сфинктера Одди, что еще больше способствует росту давления в протоковой системе ПЖ. Недостаточные стимулирующие влияния при дефиците экспрессии холецистокинина приводят к недостаточному содержанию ферментов в панкреатическом соке и уменьшению стимулирующих влияний на моторику билиарного тракта. Данные нарушения в сочетании с последствиями ваготомии усиливают нарушения моторики билиарного тракта, усугубляя поражение ПЖ по билиарному механизму. Дополнительным фактором, уменьшающим секрецию секретина и выработку бикарбонатов, является также снижение или полное отсутствие ацидификации ДПК. Безусловно, степень тяжести нарушения секреции гастроинтестинальных гормонов зависит от типа примененной реконструкции (создание резервуара, включения ДПК, без включения ДПК) [19] (Рисунок 3).
Рис. 3. Виды реконструкций после тотальной гастрэктомии: Roux-en-Y (A), создание резервуара (B) и создание резервуара без выключения двенадцатиперстной кишки (C) (по Kalmar K. и соавт., 2006 [19] ).
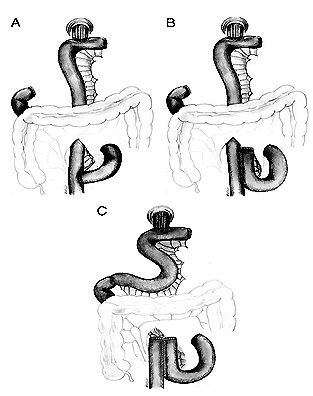
Рис. 4. Значение факторов самого оперативного вмешательства (гастрэктомии или резекции желудка) и ваготомии в развитии экзокринной панкреатической недостаточности
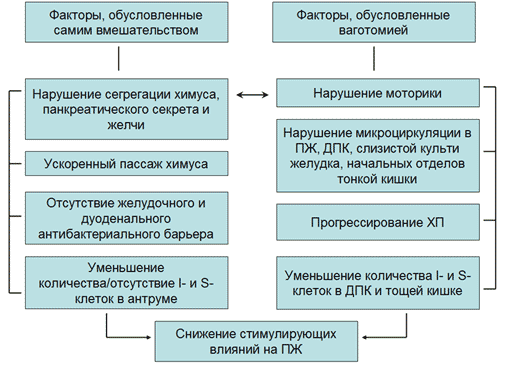
Синдром экзокринной панкреатической недостаточности помимо факторов, непосредственно связанных с удалением желудка или его большей части, также обусловлен сопутствующей гастрэктомии или резекции желудка ваготомией (Рисунок 4) из-за уменьшения стимулирующих влияний на секрецию панкреатического сока, желчи, кишечного сока, нарушений моторики билиарного тракта и начальных отделов тощей кишки, нарушений микроциркуляции в ПЖ и других органах, иннервируемых вагусом. Ваготомия оказывает прямое тормозящее действие на функцию ацинарного аппарата ПЖ и снижение реакции ПЖ на пищевые и сокогенные раздражители [3]. Следовательно, ваготомия в результате прямого (нейрогенного) и опосредованного (снижение плотности I- и S-клеток) снижения стимулирующих влияний на ПЖ и нейрогенно-обусловленных микроциркуляторных нарушений в ПЖ способствует прогрессированию ХП или развитию ХП de novo. Косвенно доказывают возможность прогрессирования ХП с экзокринной панкреатической недостаточностью у пациентов после гастрэктомии результаты экспериментальных исследований, в которых было доказано развитие нарушений толерантности к углеводам после гастрэктомии [12], то есть развитие эндокринной недостаточности ПЖ.
Таким образом, денервация органов гепатопанкреатодуоденальной зоны и нарушение их кровоснабжения в результате стволовой или селективной ваготомии и утрата функций желудка в результате гастрэктомии (резервуарной, эвакуаторной, отсутствие выработки соляной кислоты и пепсина) запускают все остальные патогенетические механизмы, приводящие к развитию функциональных осложнений. Механизмы развития панкреатической недостаточности сложны, многогранны и включают совокупность первичных и вторичных факторов, где порой сложно выделить доминирующий патофизиологический механизм. Нельзя забывать, что у больных после гастрэктомии, вторичная панкреатическая недостаточность может развиться как на фоне сохраненной экзокринной функции ПЖ, так и на фоне первичной внешнесекреторной панкреатической недостаточности, значительно усугубляя ее [3].
Синдром панкреатогенной мальабсорбции и трофологическая недостаточность. Итак, суммируя вышесказанное, можно отметить, что нарушение переваривания пищи в результате снижения синтеза панкреатических ферментов и желчи, недостаточного эмульгирования жиров, сложных нарушений моторики и синдрома избыточного бактериального роста, приводят к развитию синдрома мальабсорбции [6, 8, 10, 15, 16, 22]. Важнейшее значение при этом имеет ваготомия, которая приводит к нарушению моторики пищеварительного тракта, в частности к денервации ПЖ, тонкой кишки и печени, дискинезии желчных путей [18, 19], дистрофическим и атрофическим изменениям слизистой ДПК и тощей кишки. Поэтому можно совершенно справедливо говорить и о постваготомической мальабсорбции тоже.
Дефицит панкреатических ферментов, «асинхронная панкреатическая моторика», ускоренный пассаж химуса, воспалительные и атрофические изменения слизистой оболочки тонкой кишки, СИБР в совокупности приводят к развитию синдрома белково-энергетической недостаточности, характеризующегося прогрессирующим похуданием, нарушением всасывания ряда важнейших витаминов (особенно фолиевой кислоты и цианкобаламина) [9, 28] и микроэлементов (кальция, железа) [9], что нередко даже отражается в изменениях электролитного состава плазмы крови [20]. Снижение массы тела у больных после гастрэктомии наблюдается в 40-90% случаев [6, 22], что объясняется совокупностью факторов, включающих снижение энергетической ценности пищи, дефицит панкреатических ферментов, анорексию, неправильный режим питания, диарею у ряда больных и СИБР (расход макро- и микронутриентов). Тем не менее, в ряде работ отмечена возможность поддерживания положительного азотистого баланса у больных после тотальной гастрэктомии [10, 22], что дает серьезный повод для оптимизма.
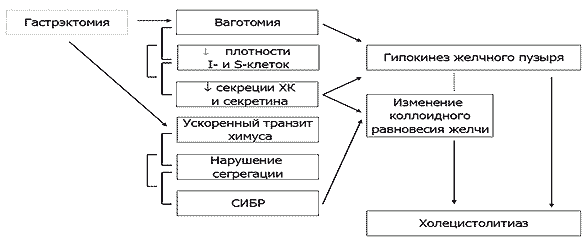
Холецистолитиаз после гастрэктомии. Еще одним не менее значимым функциональным осложнением в отдаленным периоде после гастрэктомии является холецистолитиаз [23, 29]. Как мы отмечали выше, ускоренный транзит кишечного содержимого и СИБР способствуют ранней бактериальной деконъюгации желчных кислот, нарушению механизма их энтерогепатической циркуляции, увеличению пула свободных желчных кислот в кале, нарушению всасывания жира, жирорастворимых витаминов, повышенной потери желчных кислот с калом, приводя, к изменению коллоидного состояния желчи, билиарному сладжу, микролитам и холецистолитиазу, замыкая, тем самым, порочный круг патогенеза экзокринной недостаточности ПЖ после гастрэктомии (Рисунок 5).
Рис. 5. Гастрэктомия и холецистолитиаз.
Диагностика экзокринной панкреатической недостаточности после гастрэктомии основана на клинических маркерах – выявлении диареи, стеатореи, лиентереи, метеоризма, прогрессирующей трофологической недостаточности. Сложность заключается в том, что у пациентов могут доминировать в клинической картине другие постргастрорезекционные явления – демпинга, регургитации и изжоги, а также проявления анорексии и депрессии. Нередко проявления экзокринной панкреатической недостаточности маскируются или усугубляются адъювантной химиотерапией.
Лабораторный скрининг экзокринной панкреатической недостаточности сводится к серии копрологических исследований, позволяющих выявить общую тенденцию к выявлению стеатореи и ее степени, особенно на фоне проводимого лечения. Определение фекальной эластазы-I необходимо у больных, исходно страдающих ХП (до гастрэктомии), когда функциональная недостаточность ПЖ может прогрессировать в послеоперационном периоде и мы сможем выявить сниженные цифры эластазы кала. Значимость теста также возрастает по истечении нескольких лет после гастрэктомии, когда тест может использоваться не только для диагностики, но и для оценки динамики процесса. Диагностика СИБР основана на водородном дыхательном тесте, однако у ряда больных он может иметь ложно-отрицательный результат за счет ускорения транзита реактива (обычно лактулозы). В этом случае на помощь может прийти эндоскопия с осмотром отводящей петли и забором аспирата на бактериологическое исследование. По нашему опыту диагностика СИБР у больных после гастрэктомии не нужна, поскольку этот синдром имеет место у подавляющего числа большинства больных. Скорее это удел клинических испытаний для подтверждения эффективности того или иного метода лечения, подтвержденного фактом временной редукции СИБР или уменьшения степени и качества контаминации бактериями.
Лечение. Заместительная ферментная терапия. Поскольку этиопатогенетические аспекты развития внешнесекреторной недостаточности ПЖ у больных после операций на желудке мультифакториальны, лечение этого синдрома требует комплексного подхода. Ключевым моментом коррекции внешнесекреторной недостаточности ПЖ у больных после гастрэктомии или резекции желудка является применение заместительной ферментной терапии [16]. В настоящее время принято считать, что у больных после гастрэктомии и тотально-субтотальной резекции желудка показана пожизненная заместительная терапия панкреатическими ферментами. Ранее заместительная ферментная терапия назначалась пациентам после гастрэктомии в раннем послеоперационном периоде сроком на 3-6 месяцев. Однако, исходя из изложенного выше, экзокринная панкреатическая недостаточность после гастрэктомии имеет определенную тенденцию к прогрессированию за счет сочетанного патологического влияния многих факторов. Поэтому ограничение сроков ее использования, по крайней мере, не имеет смысла.
После резекции желудка в объеме 2/3, особенно по Бильрот-1, сохраняется ряд функций желудка, поэтому показания к заместительной ферментной терапии формируются, как и в прочих случаях. Абсолютными показаниями к заместительной ферментной терапии у пациентов с внешнесекреторной недостаточностью ПЖ после резекции желудка являются: 1) диагностированная стеаторея при потере с калом > 15 г/день жира; 2) снижение массы тела; 3) стойкий диарейный синдром и диспепсические жалобы [4, 25, 26]. J.Mossner считает, что неприятные ощущения (дискомфорт) в животе следует отнести к относительным показаниям для заместительной ферментной терапии, напрямую связанными с развитием мальабсорбции у таких больных или у пациентов с ранее диагностированным ХП [28].
Таким образом, пациентам после тотальной гастрэктомии показана обязательная пожизненная заместительная ферментная терапия, а после резекции желудка заместительная ферментная терапия проводится только в случае развития клинически значимой внешнесекреторной недостаточности ПЖ [14]. Разумеется, дозы панкреатина могут варьировать не только в зависимости от клинического эффекта, уровня фекальной эластазы, но и от объема оперативного вмешательства на желудке и типа реконструкции.
Если заместительная терапия панкреатическими ферментами начата в раннем послеоперационном периоде после гастрэктомии параллельно с началом энтерального питания и у больного не было исходной (до оперативного вмешательства) трофологической недостаточности, ее можно признать достаточной и рекомендовать прием панкреатических ферментов при каждом приеме пищи. Однако, данная рекомендация может быть адекватной и не требовать коррекции только в том случае, если у пациента имеет место полноценный рацион питания и в силу отсутствия других постгастрорезекционных расстройств имеется достаточный объем потребляемой пищи, обеспечивающий адекватный энергетическим потерям калораж. В противном случаев только препаратами панкреатина не удастся компенсировать синдромы мальабсорбции и трофологической недостаточности. Потребуется коррекция питания назначением элементных или полуэлементных смесей для энтерального питания в качестве добавки к пищи. Ограничением к использованию смесей являются далекие от совершенства органолептические свойства и высокая осмолярность смесей, способная усилить диарею. Отчасти из-за этого крайне редко удается применить объем смеси, способный полностью компенсировать дефицит потребления питательных веществ. Поэтому рацион питания необходимо обогащать витамино-минеральными комплексами, особенно с достаточным содержанием жирорастворимых витаминов, цианокобаламина и железа, всасывание которых страдает в первую очередь, а клинические признаки недостаточности диагностируются достаточно часто.
У больных с тяжелой экзокринной недостаточностью после гастрэктомии даже при помощи высоких доз ферментных препаратов порой не удается полностью ликвидировать стеаторею [4, 7, 11]. Полная ликвидация стеатореи остается на сегодняшний день целью дальнейших научно-клинических исследований. Пока критерием адекватности подобранной дозы пищеварительных ферментов служит увеличение массы тела, нормализация частоты стула (менее 3 раз в день), уменьшение диспепсических проявлений, положительная картина при динамических копрологических исследованиях (уменьшение выраженности или редукция стеатореи; уменьшение содержания жира в стуле) [4].
Главным фактором, определяющим эффективность заместительной ферментной терапии, является правильный выбор лекарственного препарата. У больных после гастрэктомии рекомендован прием пищи 6-8 раз в сутки, и каждый раз пациент должен принимать панкреатин. Таблетированные препараты панкреатина не подходят для этой цели, поскольку разрушение кислотозащитной оболочки (ей покрыты все зарегистрированные в настоящее время в РФ таблетки панкреатина) происходит дистальнее потенциальной зоны пристеночного пищеварения и всасывания. Можно было бы использовать для этой цели порошок панкреатина, однако он в настоящее недоступен. Кроме того, использование порошка не гарантирует осаждения его части на слизистой пищевода с усугублением часто сопутствующего состоянию после гастрэктомии эрозивного рефлюкс-эзофагита. Казалось бы идеально подходящие в данной ситуации препараты панкреатина с компонентами желчи являются препаратами выбора, однако все они являются таблетированными, а желчные кислоты могут усилить диарейный синдром. Необходимо отметить, что поскольку в первую очередь нарушается переваривание жиров (дефицит амилаз и протеаз частично компенсируется кишечными ферментами), в препарате для заместительной терапии после гастрэктомии должно быть достаточное содержание липазы.
Таким образом, можно предполагать, что препаратами выбора являются галенические формы панкреатина 4 поколения, содержащие минимикросферы или микротаблетки, удовлетворяющие как минимум двум требованиям – небольшой размер частиц панкреатина и высокое содержание липазы в препарате (не менее 10000 ЕД липазы). Именно поэтому все известные исследования, в которых изучались различные аспекты применения панкреатина после операций на желудке, проведены на препаратах 4 поколения [8, 24], а также во всех авторитетных публикациях рассматриваются именно эти препараты, обеспечивающие наиболее равномерное смешивание и одновременное поступление с химусом в проксимальные отделы тонкой кишки [25, 26, 30].
В настоящее время на Российском рынке имеется два оригинальных препарата панкреатина 4 поколения – Креон и Панцитрат. Однако, использование этих препаратов в нативной форме в виде капсул минимизирует потенциально благоприятный эффект и приравнивает эти препараты к таблетировнным ввиду того, что на разрушение наружной капсулы также необходимо время. Поэтому, для наиболее адекватной имитации нормального пищеварения после гастрэктомии минимикросферы креона необходимо использовать без наружной капсулы (вскрывать ее). Микросферы добавляются непосредственно в пищу, запиваются глотком воды. Тем самым обеспечивается практически сопоставимое с физиологическим перемешивание панкреатических ферментов с химусом. Безусловно, выпадение функции желудка должно быть компенсировано использованием полужидких и протертых блюд, а недостаточное перемешивание с желчью – высокой дозой панкреатина, в первую очередь липазы. Согласно инструкции к применению в настоящее время Панцитрат нельзя использовать в таком виде. Кроме того, можно предполагать потенциально меньшую эффективность Панцитрата ввиду большего диаметра микротаблеток и меньшего их количества, однако подобных сравнительных исследований проведено не было.
В клинических исследованиях продемонстрировано, что на фоне терапии препаратами 4 поколения у пациентов с внешнесекреторной недостаточностью ПЖ после гастрэктомии улучшалось переваривание и всасывание питательных веществ, увеличивалась масса тела, повышались показатели альбумина, холестерина, железа в сыворотке крови [8, 24].
Таким образом, наиболее эффективным в настоящее время препаратом для заместительной терапии экзокринной панкреатической недостаточности после гастрэктомии является Креон. Однако, как мы отмечали выше, даже пожизненный прием Креона, так или иначе контролирующий экзокринную недостаточность, не всегда способен полностью купировать ее. Причиной тому служит многогранность патогенеза синдрома и необходимость порой воздействовать на различные патологические механизмы.
Важнейшими факторами, затрудняющими проведение эффективной заместительной ферментной терапии у больных после операций на желудке является ускоренный пассаж химуса и избыточный бактериальный рост в тонкой кишке.
Больным с внешнесекреторной недостаточностью ПЖ после гастрэктомии с симптоматической целью короткими курсами могут быть назначены препараты, ослабляющие кишечную перистальтику, энтеросорбенты, вяжущие и обволакивающие средства [4]. С целью устранения нарушения микробиоценоза кишечника и для обеспечения наиболее адекватной терапии экзокринной недостаточности необходимо обязательное включение в состав лечебного комплекса препаратов про- и пребиотиков. Предпочтительнее препараты с пребиотическими свойствами, стимулирующими, в отличие от пробиотиков, рост собственной микрофлоры, что не вызывает лишней антигенной нагрузки на организм [1].
Монотерапия пробиотиками при избыточном бактериальном росте после гастрэктомии чаще всего малоэффективна ввиду практически непрерывного персистирования синдрома и чрезвычайно высокого содержания бактерий в тонкой кишке. Поэтому препаратами выбора являются лекарственные средства, не оказывающие системного токсического действия, длительность применения которых не лимитирована короткими курсами, и к которым практически не развивается резистентность микроорганизмов. Всем выше указанным требованиям удовлетворяет недавно появившийся на российском рынке, но уже давно зарекомендовавший себя в мировой практике кишечный антисептик рифаксимин (Альфа-нормикс).
Таким образом, экзокринная панкреатическая недостаточность после гастрэктомии имеет сложный многофакторный патогенез, включающий механизмы развития и первичной и вторичной недостаточности, а чаще всего их комбинации. Единственным средством адекватной компенсации панкреатической недостаточности является пожизненный прием препарата Креон без наружной капсулы во время каждого приема пищи в индивидуально подобранной дозе (не менее 30000 ЕД липазы в сутки). Эффективность Креона определяется соотношением колипаза/липаза, которое равно 1,9 (должно быть выше 1). Малый размер микросфер, кроме адекватного смешивания ферментного препарата с химусом, обеспечивает большую площадь соприкосновения ферментов с пищевым субстратом. Кроме того, растворимая в кишечнике оболочка минимикросфер Креона 10 000 не содержит кополимера метакриловой кислоты, способного вызывать развитие такого осложнения, как фиброзирующая колонопатия. Учитывая выраженность панкреатической недостаточности крайне удобным становиться прием Креона, содержащего 40 000 ЕД липазы.
Добиться высокой эффективности лечения может помочь соблюдение больным диеты с использованием полужидких и протертых блюд, обогащение рациона питания (по показаниям) витамино-минеральными комплексами, лечение синдрома избыточного бактериального роста в тонкой кишке. Только комплексный подход способен предотвратить развитие трофологической недостаточности и улучшить качество жизни таких больных.
Список литературы
