Пищевая аллергия и пищевая непереносимость, терминология, классификация, проблемы диагностики и терапии
СтатьиЛусс Людмила Васильевна,
доктор медицинских наук, профессор, заведующая научно-консультативным отделением
ГНЦ "Институт иммунологии ФМБА России", Москва.
ФАРМАРУС ПРИНТ
Москва 2005
Настоящее пособие рассчитано на аллергологов-иммунологов, педиатров, терапевтов и врачей других специальностей.
Трудно найти человека, который в течение своей жизни не имел бы тех или иных проявлений непереносимости пищевых продуктов. Как правило, впервые реакции, связанные с приемом пищевых продуктов отмечаются в детстве. У детей раннего возраста такие состояния часто называют "экссудативным диатезом", еще раньше их называли "золотухой", а позднее "аллергией".
Проблемы пищевой аллергии и пищевой непереносимости в последние десятилетия переросли в глобальную медико-социальную проблему. В настоящее время до 30% населения планеты страдают аллергическими болезнями, среди которых значительную часть занимает пищевая аллергия. В клинической аллергологии приходится сталкиваться с серьезными проблемами ранней диагностики и терапии пищевой аллергии, поскольку на ранних стадиях развития болезни ее клинические проявления оказываются неспецифическими. Сложность проблемы заключается и в том, что непереносимость пищевых продуктов может быть обусловлена различными механизмами. Так, пищевая аллергия может являться результатом сенсибилизации к пищевым аллергенам, пищевым добавкам, примесям к пищевым продуктам и т. п., приводящей к развитию аллергического воспаления, являющегося качественно новой формой реагирования, возникшей на поздних ступенях эволюционного развития человека. Кроме того, формирование реакций непереносимости пищевых продуктов может быть обусловлено наличием сопутствующих патологий, приводящих к нарушению процессов переваривания и всасывания пищевого субстрата.
Не менее серьезную проблему представляет широкое внедрение в питание человека качественно новых продуктов, генетически модифицированных или измененных, о характере влияния которых на желудочно-кишечный тракт, гепатобилиарную и иммунную систему нет убедительных данных. Более того, изучение побочных реакций на пищевые продукты можно рассматривать как одну из важнейших проблем национальной биобезопасности.
Кроме того, наличие перекрестно реагирующих свойств между пищевыми и другими группами аллергенов, создает условия для расширения спектра причино-значимых аллергенов, формирования полисенсибилизации, развития более тяжелых форм аллергопатологии и неблагоприятного прогноза.
В клинической практике, как правило, диагноз "пищевая аллергия" ставят на основании наличия причинной связи между приемом пищи и развитием клинических симптомов ее непереносимости, что является причиной разногласий в трактовке самого понятия пищевой аллергии и неправильной постановки диагноза.
Следует отметить, что пищевая аллергия представляет лишь некоторую часть среди множества реакций, составляющих определение: "повышенная чувствительность к пище". "Повышенная чувствительность к пище" - включает реакции непереносимости пищевых продуктов, разные по механизму развития, клиническим симптомам и прогнозу. Чаще всего это пищевая непереносимость, пищевая аллергия и отвращение к пище.
Реакции гиперчувствительности к пище известны с давних времен. Гиппократ впервые описал тяжелые реакции на коровье молоко в виде желудочно-кишечных и кожных проявлений. Гален сообщил об аллергически-подобных реакциях у детей после употребления козьего молока. В XVII и XVIII столетиях было представлено много наблюдений тяжелых побочных реакций на пищу: приступы удушья после употребления рыбы, кожные проявления после употребления яиц или ракообразных (устрицы, крабы).
Уже в 1656 г Пьер Борел (во Франции) впервые использовал кожные тесты с яичным белком.
В 1902 г Рише и его коллеги впервые описали пищевую анафилаксию, а в 1905 г Шлосман, а несколько лет спустя Финкельштейн, сообщили о случаях анафилактического шока после употребления молока. Позже была впервые предложена пероральная специфическая иммунотерапия.
В 1919 г Шарль Рише и его сотрудники опубликовали монографию под названием "Пищевая анафилаксия", в которой обобщили все работы за этот период.
Существенный вклад в понимание проблемы пищевой аллергии, в начале тридцатых годов XX в, внес Роу в США, обозначив ее как важнейшую медицинскую проблему.
Эпидемиология
До настоящего времени нет точных эпидемиологических данных о распространенности пищевой аллергии. Это связано со многими факторами: отсутствием единых диагностических критериев, длительным отсутствием единой классификации и связанной с этим гипо- и гипердиагностикой, наличием большого количества потенциальных аллергенов пищи, частым наличием в пище "скрытого пищевого" аллергена, появлением в последние годы генетически модифицированной пищи и отсутствием сведений о ее влиянии на течение и возникновение пищевой аллергии.
Однако совершенно очевидно, что пищевая аллергия обычно возникает у детей до 15 лет.
Частота встречаемости пищевой аллергии выражается в соотношении 3 ребенка на 1 взрослого. Известно, что в детском возрасте пищевая аллергия выявляется у девочек приблизительно в 7 раз чаще, чем у мальчиков.
Аллергия к продуктам животного происхождения чаще возникает у детей до 6 лет, а аллергия к продуктам растительного происхождения чаще всего возникает в возрасте старше 6 лет и у взрослых.
По данным отечественных и зарубежных исследователей, распространенность пищевой аллергии колеблется в широких пределах от 0,01 до 50%. В частности, считают, что пищевая аллергия встречается в среднем у 10% детей и 2% взрослых. У 30-40% детей и 20% взрослых, страдающих атопическим дерматитом, обострения заболевания имеют связь с пищевой аллергией. Среди больных бронхиальной астмой (без подразделения ее на отдельные формы) в 8% случаев приступы удушья были обусловлены пищевой аллергией, а в группе больных атопией связь обострения заболевания с пищевыми аллергенами достигает 17%. Среди больных с заболеваниями желудочно-кишечного тракта и гепатобилиарной системы распространенность аллергии к продуктам питания выше, чем среди лиц, не страдающих этой патологией, и колеблется от 5 до 50%. (А.М. Ногаллер, 1983).
По данным научно-консультативного отделения ГНЦ "Института иммунологии ФМБА России", на непереносимость пищевых продуктов указывают 65% больных, страдающих аллергическими заболеваниями. Из них истинные аллергические реакции на пищевые аллергены выявляются приблизительно у 35%, а псевдоаллергические - у 65%. По данным обращаемости в это отделение, истинная пищевая аллергия как основное аллергическое заболевание составила в структуре всей аллергопатологии за последние 5 лет около 5,5%, реакции на примеси, находящиеся в составе пищевых продуктов - 0,9%. Аллергические реакции на пищевые продукты отмечались у 48% больных атопическим дерматитом, 45% больных поллинозом, 15% у больных бронхиальной астмой и у 15% больных аллергическим ринитом.
Этиология. Практически любой пищевой продукт может стать аллер-геном и причиной развития пищевой аллергии. Однако одни продукты питания обладают выраженными аллергизирующими свойствами, а другие имеют слабую сенсибилизирующую активность. Более выраженными сенсибилизирующими свойствами обладают продукты белкового происхождения, содержащие животные и растительные белки, хотя прямая зависимость между содержанием белка и аллергенностью продуктов отсутствует. К наиболее распространенным пищевым аллергенам относят молоко, рыбу и рыбные продукты, яйца, мясо различных животных и птиц, пищевые злаки, бобовые, орехи, овощи и фрукты и другие.
Рыба и морепродукты. Рыба и морепродукты относятся к наиболее распространенным пищевым аллергенам. В рыбе наиболее аллергенными являются саркоплазматические протеины - парвальбумины. Наиболее выраженными аллергизирующими свойствами обладает М-протеин трески, который обладает термостабильностью, при кипячении он переходит в паровой дистиллят и сохраняется в запахах и парах. Считают, что морская рыба более аллергенна, чем речная.
К морепродуктам, обладающим выраженными аллергизирующими свойствами относятся ракообразные (креветки, крабы, раки, лобстеры), моллюски (мидии, устрицы, губки, омар, кальмар, осьминог) и др.
Из креветок выделен мышечный аллерген - тропомиазин (он обнаружен также у других ракообразных и моллюсков). Тропомиазин сохраняется в воде, где варились креветки. Тропомиазин моллюсков изучен недостаточно, но известно, что все тропомиазины устойчивы к обработке и действию пищеварительного сока.
Молоко. К основным белкам молока, обладающих сенсибилизирующей активностью и имеющих важное практическое значение относятся: a-лактальбумин, который составляет 4% белковых антигенов коровьего молока.
a-лактальбумин термолабилен, при кипячении переходит в пенки, видоспецифичен, имеет перекрестно-связывающие детерминанты с белком яйца (овальбумином).
b-лактоглобулин, составляет до 10% белков коровьего молока. Он обладает наибольшей аллергенной активностью, видоспецифичен, термостабилен, у человека практически отсутствует.
Казеин среди белков коровьего молока составляет до 80%, видонеспецифичен белок, термостабилен, устойчив в кислой среде желудочного сока, при закислении выпадает в осадок, особенно много казеина в твороге, в сырах.
Бычий сывороточный альбумин содержится в молоке в следовых количествах, термостабилен, перекрестно реагирует с говядиной и телятиной.
Аллергенными свойствами обладает и молоко других млекопитающих. Выраженными аллергенными свойствами обладает и козье молоко.
Белок куриных яиц, как и белки рыбы, относятся к наиболее частым этиологически значимым пищевым аллергенам. Среди белков яйца наиболее выраженными аллергенными свойствами обладают овальбумин, овамукоид, кональбумин. Овальбумин составляет 64% белков яйца, он термолабилен. У животных (у крыс) вызывает анафилактоидную реакцию за счет способности неспецифической гистаминолиберации из тучных клеток. Овамукоид содержится в яйце до 9%, обладает термостабильностью, ингибирует трипсин и поэтому длительно сохраняется в кишечнике. Овамукоид нередко является причиной развития псевдоаллергических реакций на яйцо за счет способности вызывать неспецифическую гистаминолиберацию.
Кональбумина в яйце содержится 14%, этот белок перекрестно реагирует с перьями и пометом птиц. В яйце также содержится лизоцим (34%) и овоглобулин (9%).
Основным аллергеном желтка является а-ливетин, обладающий выраженной перекрестной реактивностью с перьями и пометом птиц.
Мясо животных. Аллергия к мясу животных встречается редко, большинство аллергенных белков мяса животных полностью теряют сенсибилизирующую активность после термической и кулинарной обработки. Аллергические реакции могут наблюдаться как к одному виду мяса (говядина, свинина, баранина), так и к мясу животных разных видов.
В мясе животных имеется два основных аллергена: сывороточный альбумин и гаммаглобулин.
Пищевые злаки: пшеница, рожь, ячмень, кукуруза, рис, просо (пшено), тростник, бамбук. Главные аллергены пищевых злаков - альбумин и глобулин.
Семейство гречишных: гречиха, ревень, щавель. Гречиха относится к "псевдозлакам".
В Европе гречиха используется как альтернативная пища у больных, страдающих аллергией к пищевым злакам. Однако в Японии гречиху относят к наиболее распространенным пищевым аллергенам,что связано с употреблением в пищу большого количества гречишной лапши.
Пасленовые: томат, картофель, баклажан, сладкий перец. Томат богат гистамином.
Зонтичные: сельдерей, морковь, петрушка, укроп, фенхель, кориандр, тмин, анис.
Сельдерей содержит термостабильный аллерген и при термической обработке не теряет своих сенсибилизирующих свойств.
Розоцветные: яблоки, персики, абрикосы, сливы, вишня, малина. Моноаллергия к розоцветным встречается редко. Аллергия к розоцветным чаще встречается у больных поллинозом, сенсибилизированных к пыльце деревьев.
Орехи: фундук, бразильский орех, кешью, пекан, фисташки, миндаль, кокос, кедровый орех, грецкий орех. Орехи относятся к пищевым аллергенам, обладающим выраженной сенсибилизирующей активностью и наличием перекрестных реакций с другими группами аллергенов.
Кунжут, мак, семена ("семечки") подсолнечника также могут быть причиной развития тяжелых аллергических реакций .
Бобовые: соя, арахис, горох, чечевица, бобы, люпин. Ранее считалось, что аллергия к бобовым, особенно к сое, встречается относительно редко, однако в последние годы отмечается значительный рост пищевой аллергии к этому продукту, обусловленный значительным увеличением употребления сои с пищей у детей и взрослых.
Арахис обладает среди бобовых наиболее сильными аллергенными свойствами, вызывает тяжелые аллергические реакции, вплоть до анафилактического шока. Арахис широко применяется в пищевой промышленности и относится к так называемым "скрытым аллергенам".
По данным эпидемиологических исследований, имеется тенденция к увеличению числа аллергических реакций на арахис. При варке и жарке аллергенные свойства арахиса усиливаются.
Соя широко применяется в пищевой промышленности и является часто используемым продуктом питания среди населения, особенно у вегетарианцев.
Перекрестные свойства между пищевыми и другими группами аллергенов
Одной из серьезных проблем пищевой аллергии является наличие перекрестных аллергенных свойств как между пищевыми, так и другими неинфекционными и инфекционными аллергенами.
Известно, что основными источниками растительных пищевых аллергенов, имеющих важное значение в формировании пищевой аллергии являются: PR (pathogen-response proteins) белки или "белки защиты", актин-связывающие (структуральные) белки или профилины, тиоловые протеазы и проламины (резервные белки семян и белки хранения/запаса). PR белки имеют довольно низкую молекулярную массу, стабильны при низких значениях рН, устойчивы к действию протеаз, обладают структурной общностью. Из 14 групп PR белков 8 содержат аллергены, имеющие перекрестные реакции с различными пищевыми продуктами и имеющие важное практическое значение. Так, PR2 белки (β-1,3,-глюконазы), выделенные из бразильской гевеи (Hev b 2), имеют перекрестную реактивность со многими овощами и фруктами и являются причиной развития фруктово-латексного синдрома.
PR3 белки (эндохитиназы) гидролизуют хитин и обладают перекрестными свойствами с латексом, фруктами, овощами. PR4 белки (хитиназы), имеют аминокислотные последовательности гомологичные белкам сои, картофеля, томатов.
PR5 белки (тауматин-подобные белки), первым из них выделен главный аллерген яблок, вишни, пыльцы горного кедра. Аминокислотная последовательность этого аллергена гомологична тауматину пшеницы, сладкого перца, томатов. PR8 белки (латексный минорный аллерген гевамин) идентичен лизоцим/хитиназе огурца. PR9 белки (лигнин-образующие пероксидазы) выделены из пшеничной муки, их рассматривают как причину "астмы булочников". PR10 белки - большая группа внутриклеточных белков из растений разных семейств (косточковые, пасленовые и др.). Структурная гомология наблюдается с аллергенами пыльцы березы, ольхи, орешника, каштана, граба, дуба и пищевых продуктов (каштана, фундука, желудя и др.). PR14 белки обеспечивают межмембранный перенос фосфолипидов из липосом к митохондриям. PR14 белки обладают выраженной перекрестной реактивностью. Первые PR14 белки были выделены из пыльцы крапивы, к ним принадлежат такие аллергены: персиков, абрикосов, слив, вишни, яблок, винограда, лесного ореха, каштана.
Актин-связывающие (структуральные) белки или профилины
Актин-связывающие (структуральные) белки регулируют сеть актиновых волокон, образующих цитоскелет растений. Эти белки впервые обнаружены в пыльце березы и названы профилинами. Они обладают выраженными перекрестно реагирующими свойствами со многими группами аллергенов и часто являются причиной анафилактических реакций, особенно у детей, на сою и арахис. С профименами связывают развитие аллергических реакций на морковь, картофель, сельдерей, тыквенные семена, лесной орех, томаты и др. у больных поллинозом.
Тиоловые протеазы содержат папаин из папайи, фицин из винной ягоды, бромелайн из ананаса, актинидин из киви, соевый белок из сои.
Проламины - резервные белки семян и белки хранения/запаса. Многие резервные белки семян относятся к PR14 белкам.
Наличие перекрестных реакций между белками, содержащимися в различных пищевых продуктах, имеет особенно важное значение для больных с ИПА, поскольку у этих пациентов возможно развитие перекрестных аллергических реакций на другие группы аллергенов, например пыльцевые (табл. 1). Пищевые злаки вызывают перекрестные реакции с пыльцой злаковых трав. Банан имеет перекрестные свойства с авакадо, дыней и пыльцой полыни. Соя имеет перекрестную реактивность с казеином молока, (около 15% детей с аллергией к коровьему молоку имеют перекрестную сенсибилизацию к сое). Арахис обладает перекрестной реактивностью с соей и картофелем. После обжаривания и варки аллергенные свойства арахиса усиливаются. Арахис, фундук, грецкий орех не рекомендуют больным с аллергией к сложноцветным.
Таблица 1. Перекрестные реакции между пищевыми и пыльцевыми аллергенами
|   | Пыльца березы | Пыльца сложноцветных (полынь, амброзия, одуванчик) |
| Пищевые продукты | яблоки; морковь; картофель; груша; сельдерей; томаты; слива; петрушка; баклажан; вишня; укроп; перец; персик; абрикос | дыня; морковь; картофель; тыква; сельдерей; томаты; арбуз; петрушка; баклажан; кабачок; укроп; перец; банан |
Перекрестные реакции также могут развиваться между пищевыми, бытовыми и эпидермальными аллергенами (табл. 2).
Таблица 2. Перекрестные реакции между пищевыми, бытовыми и эпидермальными аллергенами
| Пищевые продукты (аллергены) | Аллергены, дающие перекрестные реакции |
| Креветки Крабы Лобстеры Лангусты Устрицы съедобные Улитки | Тараканы Дафнии Dermatophagoides pteronissinus D. farinae |
| Свинина Говядина | Эпителий кошки |
| Конина | Мясо кролика |
Свинина имеет перекрестные аллергенные свойства с шерстью кошки и сывороточным альбумином кошки, которые приводят к развитию у пациентов так называемого рork-сat синдрома.
Перекрестную реактивность имеют аллергены ракообразных и моллюсков. Между аллергенами рыб разных видов также имеется перекрестная реактивность.
Возможны перекрестные реакции между белками козьего и коровьего молока. Кобылье молоко также имеет перекрестную реактивность с различными видами молока - коровьим, козьим, овечьим. Сенсибилизация к белкам кобыльего молока может появиться у больных с сенсибилизацией к конскому волосу (перхоти лошади). Овамукоид обладает перекрестно реагирующими свойствами с сывороткой говядины, лошади, мыши, крысы, кролика, кошки, собаки.
При аллергии к белкам яйца может наблюдаться повышенная чувствительность к мясу различных видов птиц, а также к перу и помету птиц, так называемый вirdеgg синдром.
Существует умеренно выраженная перекрестная реактивность между мясом курицы, гуся, голубя, индюшки, перепела и сывороткой крови говядины, лошади, мыши, крысы, собаки, кошки, кролика.
Известно, что при наличии истинной пищевой аллергии к кофе и какао нередко развиваются перекрестные аллергические реакции при употреблении других бобовых (фасоль, горох, чечевица и др.).
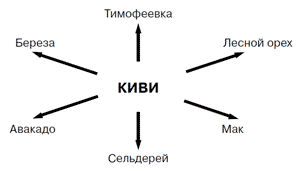
Киви имеет перекрестные реакции с разными пищевыми и пыльцевыми аллергенами (рис. 1).
Рис. 1. Наиболее частые перекрестные реакции киви
В практической медицине имеет значение возможность развития перекрестных аллергических реакций на сывороточные препараты, полученные из животных, на мясо которых имеется аллергия, например, развитие реакции на введение противодифтерийной сыворотки при аллергии к конине, или на ферментные препараты, полученные из поджелудочной железы и слизистых оболочек кишечника крупного рогатого скота, свиней и т.д.
Классификация
Общепринятая унифицированная классификация пищевой аллергии отсутствует. В классификации побочных реакций на пищу, принятую за рубежом, к пищевой аллергии относят совершенно различные по механизмам развития реакции непереносимости пищевых продуктов: истинная пищевая аллергия; пищевая псевдоаллергия, или ложная пищевая аллергия; пищевая непереносимость; токсические пищевые реакции; анафилактический шок.
Очевидно, что такой подход к терминологии пищевой аллергии создает ряд проблем при определении тактики ведения больных с непереносимостью пищевых продуктов, столь различных по патогенезу.
На конгрессе Европейской академии аллергии и клинической иммунологии (Стокгольм, июнь 1994) была предложена рабочая классификация побочных реакций на пищу, в основу которой положены механизмы развития этих реакций (рис. 2). Согласно этой классификации, среди реакций непереносимости пищевых продуктов выделяют реакции на пищу токсического и нетоксического характера. Нетоксические реакции на пищу могут быть результатом участия как иммунных, так и не иммунных механизмов.
Рис. 2. Классификация побочных реакций на пищу
(Европейская академия аллергии и клинической иммунологии, Стокгольм. 1994 г)
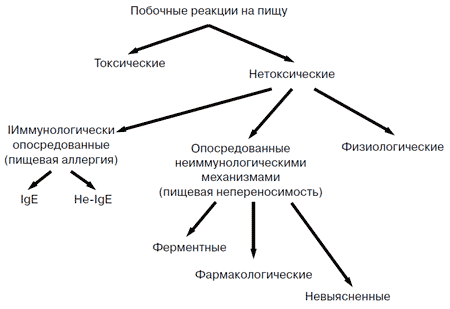
Следует заметить, что академик РАМН А.Д. Адо еще в 60-х годах двадцатого столетия указывал, что по механизму развития аллергические реакции подразделяют на истинные и ложные. Это относится и к пищевой аллергии, при которой выделяют истинные аллергические реакции на пищевые продукты (пищевая аллергия) и псевдоаллергические (пищевая неперносимость). Эти же позиции сформулированы и в классификации непереносимости пищевых продуктов, принятой в Стокгольме (1994 г).
С патофизиологических позиций к пищевой аллергии следует относить реакции непереносимости пищевых продуктов, в развитии которых лежат иммунологические механизмы. Они могут протекать как по гуморальным, так и клеточным механизмам аллергии, т.е. с участием аллергических антител или сенсибилизированных лимфоцитов. Иммунологически опосредованная истинная пищевая аллергия в зависимости от механизма подразделяется на IgE и не IgE-опосредованные реакции и пищевую аллергию, протекающую по механизмам замедленной аллергии.
Неиммунологическая пищевая непереносимость нетоксического характера может быть обусловлена наличием врожденных и приобретенных энзимопатий (например, непереносимость коровьего молока вследствие лактазной недостаточности), наличия в пищевых продуктах фармакологических и других примесей. Вторичная лактазная недостаточность возникает главным образом у взрослых, тогда как большинство других энзимных дефицитов являются редкими врожденными нарушениями метаболизма.
Ферментопатии являются одной из важнейших причин непереносимости пищи, которые приводят к нарушениям обмена и всасывания (углеводов, белков и жиров) клинически проявляющимся различными патологическими симптомами.
Некоторые пациенты, утверждающие, что они страдают аллергией к пище, несмотря на отсутствие у них объективных данных, могут нуждаться в психологической помощи и медицинском обследовании у психиатра.
Токсические реакции развиваются после употребления пищевых продуктов, содержащих в виде примесей токсические вещества. Клинические проявления этих реакций и степень их тяжести зависят от дозы и химических свойств токсических соединений, а не от вида пищевого продукта. Токсические примеси в продуктах питания могут быть естественным компонентом пищи или образовываться в процессе приготовления пищи, или попадать в пищу при загрязнении, или за счет токсического действия пищевых добавок.
К естественным компонентам пищи относятся натуральные токсины (например, цианиды), которые содержатся в грибах, фруктах, ягодах, косточках фруктов (компот из вишни с косточкой, из абрикоса с косточкой).
К токсинам, образующимся в процессе приготовления пищи относятся, например, гемагглютинины, которые содержатся в недоваренных бобах. В плесенях, поражающих сыры, хлебные злаки, крупы, сою, содержится афлатоксин, вызывающий тяжелые побочные реакции после употребления таких продуктов.
Примером токсинов, которые могут попадать в пищу при загрязнении, являются токсины морских водорослей, которыми питается рыба, моллюски и ракообразные. В этих водорослях содержатся PSP (paralytic shellfish poisoning)-токсин и DSP (diarrhetic shellfish poisoning)-токсин, ответственные за развитие тяжелых системных неиммунологических реакций, которые ошибочно могут относить к аллергическим реакциям на рыбу и морепродукты.
Токсические реакции могут отмечаться при употреблении продуктов с избыточным содержанием нитратов, нитритов, сульфатов.
Кроме того, токсические реакции на пищу могут развиваться за счет присутствия в пище токсинов или бактерий, ответственных за гистаминовый шок (например, гистамин, высвобожденный при отравлении рыбой), или химические примеси в пище могут провоцировать некоторые расстройства (например, кофеин в кофе).
Факторы, способствующие формированию пищевой аллергии, являются общими для взрослых и детей.
При нормальном функционировании желудочно-кишечного (ЖКТ) и гепатобилиарной системы сенсибилизация к пищевым продуктам, поступаемым энтеральным путем, не развивается.
Важное значение в формировании сенсибилизации к пищевым продуктам имеет генетически детерминированная предрасположенность к аллергии. Как показали исследования, примерно половина больных, страдающих пищевой аллергией, имеют отягощенный семейный или собственный аллергологический анамнез, т.е. либо они сами страдают какими-либо аллергическими заболеваниями (поллиноз, атопическая бронхиальная астма), либо этими заболеваниями болеют их ближайшие родственники.
Формированию пищевой аллергии способствует нарушение питания матери во время беременности и лактации (злоупотребление определенными продуктами, обладающими выраженной сенсибилизирующей активностью: рыба, яйца, орехи, молоко и др.). Провоцирующими факторами развития пищевой аллергии являются следующие: ранний перевод ребенка на искусственное вскармливание; нарушение питания детей, выражающееся в несоответствии объема и соотношения пищевых ингредиентов массе тела и возрасту ребенка; сопутствующие заболевания ЖКТ, заболевания печени и желчевыводящих путей и др.
Нормальное переваривание и всасывание пищевых продуктов обеспечивается состоянием нейроэндокринной системы, строением и функцией ЖКТ, гепатобилиарной системы, составом и объемом пищеварительных соков, составом микрофлоры кишечника, состоянием местного иммунитета слизистой кишечника (лимфоидная ткань, секреторные иммуноглобулины и т.д.) и другими факторами.
В норме пищевые продукты расщепляются до соединений, не обладающих сенсибилизирующими свойствами (аминокислоты и другие неантигенные структуры), а кишечная стенка является непроницаемой для нерасщепленных продуктов, которые обладают или могут обладать при определенных условиях сенсибилизирующей активностью или способностью вызывать псевдоаллергические реакции.
Повышение проницаемости слизистой кишечника, которое отмечается при воспалительных заболеваниях ЖКТ, способствует избыточному всасыванию нерасщепленных продуктов, способных сенсибилизировать организм или вызывать псевдоаллергические реакции.
Нарушение (снижение или ускорение) всасывания высокомолекулярных соединений может быть обусловлено нарушением этапов превращения пищевого субстрата в пищеварительном тракте при недостаточной функции поджелудочной железы, энзимопатии, дискинезии желечевыводящих путей и кишечника и др.
Беспорядочное питание, редкие или частые приемы пищи приводят к нарушению секреции желудка, развитию гастрита, гиперсекреции слизи и другим расстройствам, способствующим формированию пищевой аллергии или псевдоаллергии.
На формирование гиперчувствительности к пищевым продуктам белковой природы оказывают влияние не только количество принятой пищи и нарушения диеты, но и кислотность желудочного сока (А. Уголев, 1985). В экспериментальных исследованиях установлено, что с увеличением кислотности желудочного сока, всасывание нерасщепленных белков уменьшается. Показано, что недостаток в пище солей кальция способствует повышению всасывания нерасщепленных белков.
Разные исследователи, используя различные методы исследования (электронномикроскопические, гистохимические, гистологические и др.), обнаружили нарушения обмена веществ, снижение ферментативной активности, повышение проницаемости слизистой оболочки пищеварительного тракта у 40-100% обследованных больных с пищевой аллергией (А.М. Ногаллер, 1983; М. Лессоф и соавт., 1986).
Иммунные механизмы развития пищевой аллергии
Полученные за последние годы сведения позволили конкретизировать некоторые представления о механизмах формирования пищевой непереносимости, однако до настоящего времени механизмы формирования истинной пищевой аллергии изучены недостаточно. Сенсибилизация к пищевым аллергенам может произойти внутриутробно, в младенчестве и раннем детском возрасте, у детей и подростков или у взрослых.
Материнские аллерген-специфические IgE не проникают через плацентарный барьер, но известно, что продуцировать такие антитела плод может уже на сроке 11 нед.
Предполагают, что материнские антитела, принадлежащие к IgG, играют основную роль в передаче аллергена плоду. Эти антитела проникают через плацентарный барьер, неся в составе иммунного комплекса пищевой аллерген.
Передача аллергена плоду возможна также через амниотическую жидкость, через высокопроницаемую кожу плода, через глотательные движения плода и за счет попадания антигена в кишечник или в воздушные пути при дыхательных движениях плода.
К настоящему времени получены данные о существовании у всех новорожденных универсальной склонности к первоначальному ответу Т-лимфоцитов в сторону Th2 цитокинового профиля и синтеза интерлейкина (ИЛ)-4 и относительной недостаточности продукции интерферона-γ (ИНФ-γ). Сенсибилизация к пищевым аллергенам чаще развивается в младенческом возрасте как у атопиков, так и у неатопиков. Было установлено, что у неатопиков пик концентрации аллерген-специфических IgE к пищевым аллергенам обычно наблюдается в течение первого года жизни, а затем снижается, и в дальнейшем IgE к пищевым аллергенам не определяются.
У детей с атопическими болезнями титр аллерген-специфических IgE к пищевым продуктам постоянно сохраняется и растет (часто бывает очень высоким). Имеются данные о том, что наличие высокого титра аллерген-специфических IgE к куриному белку у детей раннего возраста является маркером, позволяющим предсказать развитие в дальнейшем атопического заболевания.
В основе истинных аллергических реакций на пищевые продукты лежат сенсибилизация и иммунный ответ на повторное введение пищевого аллергена.
Наиболее изучена пищевая аллергия, развивающаяся по механизмам I типа (IgE-опосредованного). Для формирования пищевой аллергии пищевой аллерген должен обладать способностью индуцировать функцию Т-хелперов и угнетать активность Т-супрессоров, что приводит к усилению продукции IgE. Кроме того, аллерген должен иметь не менее двух идентичных детерминант, отстоящих друг от друга, связывающих рецепторы на клетках-мишенях с последующим высвобождением медиаторов аллергии.
Наряду с IgE, существенное значение в механизме развития пищевой аллергии имеют антитела класса IgG4, особенно при аллергии к молоку, яйцам, рыбе.
Иногда пищевая аллергия может развиваться на некоторые пищевые добавки, особенно азокрасители (например, тартразин). В этом случае, последние выполняют роль гаптенов, и образуя комплексы с белком, например, с сывороточным альбумином, становятся полноценным антигеном, на который в организме вырабатываются антитела.
Существование антител класса IgE против тартразина было продемонстрировано в экспериментах на животных, выявлялись они и у человека при использовании РАСТ.
Возможно также развитие гиперчувствительности замедленного типа, проявляющейся в виде экземы, при употреблении пищевых продуктов, содержащих азокрасители, бензилгидроокситолуен, бутилгидроксианисол, хинин и др. В частности, установлено, что пищевые добавки могут индуцировать выработку фактора, тормозящего миграцию макрофагов, являющегося медиатором гиперчувствительности замедленного типа, что свидетелствует о развитии замедленных аллергических реакций на пищевые продукты, содержащие эти добавки.
Следует, однако, заметить, что, в двойном-слепом плацебо-контролиркемом исследовании (DBPCFCs) определяющая роль изотипов иммуноглобулинов (кроме IgE) иммунных комплексов и клеточно-опосредованных реакций в механизме реакции на пищевые продукты не была доказана с достаточной убедительностью.
Ложные аллергические реакции на пищевые продукты (псевдоаллергия)
Чаще непереносимость пищевых продуктов протекает по механизмам псевдоаллергических реакций (ПАР). ПАР и истинные аллергические реакции имеют сходные клинические проявления, но разные механизмы развития. При ПАР на пищевые продукты не принимают участие специфические иммунные механизмы, как при истинной пищевой аллергии. В основе развития ПАР на пищевые продукты лежит неспецифическое высвобождение медиаторов (в основном гистамина) из клеток-мишеней аллергии.
ПАР отличаются от других реакций непереносимости пищевых продуктов тем, что в их развитии хотя и принимают участие те же медиаторы, что и при истинной пищевой аллергии (гистамин, лейкотриены, простагландины, другие цитокины и др.), но высвобождаются они из клеток-мишеней аллергии неиммунологическим способом. Это возможно при прямом воздействии белков пищевого продукта (без участия аллергических антител) на клетки-мишени (тучные клетки, в частности) и опосредованно, при активации антигеном ряда биологических систем (кининовой, системы комплемента и др.). Среди медиаторов, ответственных за развитие симптомов непереносимости при ПАР, особая роль отводится гистамину.
Развитию ПАР на пищевые продукты способствует ряд факторов: избыточное поступление в организм гистамина; при употреблении (злоупотреблении) пищевых продуктов, богатых гистамином, тирамином, гистаминолибераторами; избыточное образование гистамина и/или тирамина из пищевого субстрата за счет синтеза их кишечной флоры; повышенное всасывание гистамина и/или тирамина при функциональной недостаточности слизистой ЖКТ; избыточное образование тирамина при частичном дефиците тромбоцитарной моноаминооксидазы, что приводит к неполному разрушению эндогенного тирамина; повышенное высвобождение гистамина из клеток-мишеней; нарушение синтеза простагландинов, лейкотриенов.
Наиболее часто ПАР развиваются после употребления продуктов, богатых гистамином, тирамином, гистаминолибераторами, таких, как ферментированные сыры, кислая капуста, вяленая ветчина и говяжьи сосиски, ферментированные вина, свиная печень, консервированный тунец, филе сельди, консервированная копченая селедочная икра, шпинат, томаты, рокфор промышленный, камамбер, бри, чеддер, пивные дрожжи, маринованная сельдь и др.
Примером развития ПАР на рыбные продуктя является употребление рыбы с высоким содержанием красного мяса, которое при приготовлении становится коричневым (семейство Scambridae - тунец, скумбрия, макрель) и содержит в мышечной ткани большое количество гистидина. Когда рыба неправильно хранится, охлаждается или замораживается с нарушением технологии этого процесса, то гистидин под влиянием бактериальной гистидиндекарбоксилазы переходит в гистамин. Образуется очень большое количество гистамина, так называемого скомбротоксина, который вызывает скомбротоксическе отравление, симптоматически похожее на аллергическую реакцию: покраснение кожи, крапивница, рвота, боли в животе, диарея. За счет очень высокого содержания гистамина скомбротоксин инактивируется при тепловой обработке (при варке, копчении) и солении.
В последние годы отмечается рост ПАР на примеси, обладающие высокой физической и биологической активностью (пестициды, фторсодержащие, хлорорганические соединения, сернистые соединения, аэрозоли кислот, продукты микробиологической промышленности и т.д.), загрязняющие пищевые продукты.
Нередко причиной развития ПАР на пищевые продукты является не сам продукт, а различные химические добавки, вносимые для улучшения вкуса, запаха, цвета, обеспечивающие длительность хранения. Пищевые добавки включают большую группу веществ: красители, ароматизаторы, антиоксиданты, эмульгаторы, ферменты, загустители, бактериостатические вещества, консерванты и др. К наиболее распространенным пищевым красителям относятся тартразин, обеспечивающий оранжево-желтое окрашивание продукта; нитрит натрия, сохраняющий красный цвет мясным продуктам и др.
Для консервации пищи применяют глутамат натрия, салицилаты, в частности, ацетилсалициловую кислоту и др.
Вазоактивный амин - бетафенилэтиламин, который содержится в шоколаде, в продуктах, подвергаемых ферментированию, например, сырах, ферментированных бобах какао. Такие продукты вызывают у больных симптомы, подобные реакциям, возникающим при аллергии.
Наиболее распространенные пищевые добавки
Пищевые красители: тартразин (Е102), желто-оранжевые (Е110), эритрозин (Е-127), азорубин (Е-122), амарант (Е-123), красная кошениль (Е-124), бриллиантовая чернь BN (Е-151).
Консерванты: бензойная кислота (Е-210), бензоаты (Е 211-219), суль-фиты и их производные (Е 220-227), нитриты (Е 249-252).
Вкусовые добавки: глутамат натрия (Е-621), глутамат калия (Е-622), глутамат кальция (Е-623), глутамат аммония (Е-624), глутамат магния (Е-625).
Ароматизаторы: глутаматы (В 550-553).
Продукты, содержащие сульфиты: салаты из помидоров, моркови, перца, лука, уксус, маринады и соления, фруктовые соки, вино, пиво, наливки, ликеры, желатин, сушеные овощи, колбасный фарш, сыры, соусы к мясу, рыбе, консервированные овощи, супы, сухие суповые смеси, морепродукты, свежая рыба, смеси для выпечки.
Продукты, которые могут содержать тартразин: жареный хрустящий картофель, окрашенный в оранжевый цвет, готовые пироги, коврижки, пряники, пудинги, глазурь, замороженные хлебобулочные изделия, хлеб из теста быстрого приготовления, шоколадная стружка, готовые смеси для приготовления теста, окрашенные газированные и фруктовые напитки, цветной зефир, карамель, драже, обертка для конфет, хлопья.
Механизм действия пищевых примесей и пищевых добавок может быть различным:
- индукция ПАР за счет с прямогом действия препаратов на чувствительные клетки-мишени аллергии с последующей неспецифической либерацией медиаторов (гистамина);
- нарушение метаболизма арахидоновой кислоты (тартразин, ацетилсалициловая кислота) за счет угнетения циклооксигеназы и нарушения баланса в сторону преимущественного образования лейкотриенов, которые оказывают выраженное биологическое влияние на различные ткани и системы, вызывая спазм гладкой мускулатуры (бронхоспазм), гиперсекрецию слизи, повышение проницаемости сосудистой стенки, уменьшение коронарного кровотока и др;
- активация комплемента по альтернативному пути рядом пищевых добавок, при этом продукты активации комплемента оказывают эффект, сходный с действием медиаторов аллергии;
- игибиция ферментативной активности моноаминоксидазы.
Необходимо отметить, наличие истинной пищевой аллергии не исключает возникновения у того же пациента ложных аллергических реакций на пищевые продукты.
До сих пор, пока нет убедительных данных о безопасности генетически модифицированных продуктов, их не следует употреблять больным с пищевой аллергией. Генетически обработанная (модифицированная) пища - качественно новые продукты, полученные путем генетической обработки (соевые бобы, картофель, кукуруза и др.) с использованием современных новых технологий. Влияние генетически модифицированных продуктов на организм и ферментные системы человека изучено недостаточно.
Клинические проявления пищевой аллергии
Клинические симптомы непереносимости пищи, вызванные как сенсибилизацией, так и другими механизмами, разнообразны по форме, локализации, степени тяжести и прогнозу, но ни один из симптомов не является специфическим для пищевой аллергии.
Выделяют системные аллергические реакции после воздействия пищевого аллергена и локальные. Системные аллергические реакции на пищу могут развиваться и протекать с преимущественным поражением различных органов и систем. Наиболее ранним и типичным проявлением истинной пищевой аллергии является развитие орального аллергического синдрома (ОАС).
ОАС характеризуется появлением периорального дерматита, зудом в полости рта, онемением и/или чувством "распирания" языка, твердого и/или мягкого неба, отечностью слизистой полости рта после употребления "виновного" пищевого аллергена.
Самым тяжелым проявлением истинной пищевой аллергии является анафилактический шок, развивающийся после употребления (проглатывания) пищевых продуктов, например, рыбы, яйца, молока, земляного ореха (арахиса) и др.
Анафилактический шок при истинной пищевой аллергии может возникнуть через интервал от нескольких секунд до 4 ч после приема пищи, характеризуется тяжелым течением, серьезным прогнозом (летальность при анафилактическом шоке колеблется от 20 до 70%).
При ПАР на пищевые продукты системные реакции могут проявляться в виде анафилактоидного шока.
Анафилактоидный шок, вызванный употреблением пищевого продукта, развивается по механизмам псевдоаллергии, по клиническим симптомам он может напоминать анафилактический шок, но отличается от последнего отсутствием полисиндромности и более благоприятным прогнозом. В частности, при анафилактоидном шоке отмечаются симптомы преимущественно со стороны одной из систем организма, например, падение артериального давления (АД) и потеря сознания. В случае проявления анафилактической реакции в виде генерализованной крапивницы и отека Квинке возникает резкая слабость, тошнота, но АД остается в пределах нормальных значений. Прогноз при анафилактоидном шоке благоприятный и при своевременном назначении адекватной симптоматической терапии положительный клинический эффект наступает быстро, как правило, в первые минуты и часы после начала терапии.
Желудочно-кишечные проявления пищевой аллергии. К наиболее частым клиническим проявлениям пищевой аллергии со стороны ЖКТ относятся: рвота, колики, анорексия, запоры, диарея, аллергический энтероколит.
Рвота при пищевой аллергии может возникать от нескольких минут, до 4-6 ч после приема пищи. Иногда рвота принимает упорный характер, имитируя ацетонемическую. Возникновение рвоты связано в основном со спастической рекцией привратника при попадании пищевого аллергена в желудок.
Колики. Аллергические коликообразные боли в животе могут наблюдаться сразу после приема пищи или спустя несколько часов и быть обусловлены спазмом гладкой мускулатуры кишечника, связанным со специфической или неспецифической либерацией медиаторов аллергии. Боли в животе носят, как правило, интенсивный характер и в некоторых случаях заставляют прибегать к консультации хирурга. Боли в животе при пищевой аллергии могут быть и не столь интенсивными, но постоянными и сопровождающимися снижением аппетита, появлением слизи в стуле и другими диспепсическими расстройствами.
Анорексия. В одних случаях отсутствие аппетита при пищевой аллергии может быть избирательным по отношению к причиннозначимому пищевому аллергену, в других отмечается общее снижение аппетита.
Запоры при пищевой аллергии обусловлены спазмом гладких мышц разных участков кишечника. При рентгено-контрастных исследованиях, как правило, удается хорошо определить участки спазмированного кишечника.
Диарея. Частый, жидкий стул, появляющийся после приема причиннозначимого пищевого аллергена, является одним из наиболее распространенных клинических симптомов пищевой аллергии как у взрослых, так и детей. Особенно часто диарея наблюдается при пищевой аллергии к молоку.
Аллергический энтероколит при пищевой аллергии характеризуется резкими болями в животе, наличием метеоризма, жидким стулом с отхождением стекловидной слизи, в которой содержится большое количество эозинофилов. Больные с аллергическим энтероколитом жалуются на резкую слабость, снижение аппетита, головную боль, головокружение. Аллергический энтероколит, как проявление пищевой аллергии, встречается чаще, чем его диагностируют.
При гистологическом исследовании у больных с аллергическим энтероколитом выявляются геморрагические изменения, выраженная тканевая эозинофилия, местный отек и гиперсекреция слизи.
Кожные проявления пищевой аллергии относятся к самым распространенным как у взрослых, так и у детей.
У детей в возрасте до года, первыми признаками пищевой аллергии могут быть упорные опрелости, несмотря на тщательный уход за кожей, перианальный дерматит и перианальный зуд, которые возникают после кормления. Локализация кожных изменений при пищевой аллергии различна, но чаще они появляются сначала в области лица, периорально, а затем приобретают склонность к распространению процесса по всей кожной поверхности. В начале заболевания при пищевой аллергии можно выявить четкую связь кожных обострений с приемом причиннозначимого пищевого аллергена, но со временем аллергические изменения со стороны кожи приобретают стойкий характер и постоянно рецидивирующее течение, что затрудняет определение этиологического фактора.
Для истинной пищевой аллергии наиболее характерными кожными проявлениями являются крапивница, ангионевротический отек Квинке и атопический дерматит.
Псевдоаллергические реакции на пищу отличаются полиморфизмом кожных высыпаний: от уртикарных (в 10-20% случаев), папулезных (20-30%), эритематозных, макулезных (15-30%) до геморрагических и булезных высыпаний. Кожные проявления при любой форме пищевой аллергии сопровождаются, как правило, зудом разной интенсивности. Наряду с кожными проявлениями, у больных с пищевой аллергией отмечается снижение аппетита, плохой сон, астеноневротические реакции.
Респираторные проявления пищевой аллергии
Аллергический ринит при пищевой аллергии характеризуется появлением обильных слизисто-водянистых выделений из носа, иногда заложенностью носа и затруднением носового дыхания.
При риноскопии обнаруживается отечность слизистой оболочки носовых раковин, имеющих бледно-синюшную окраску.
Нередко, наряду с ринореей или отечностью слизистых, у больных отмечается чихание, зуд кожи вокруг носа или в носу. Наиболее частыми причинами развития аллергического ринита у больных с пищевой аллергией являются рыба и рыбные продукты, крабы, молоко, яйца, мед и др.
Пищевая бронхиальная астма. По мнению большинства исследователей, роль пищевых аллергенов в развитии бронхиальной астмы невелика. В наших исследованиях клинические проявления пищевой аллергии в виде приступов удушья наблюдались приблизительно в 3% случаев, и хотя роль пищевых аллергенов в патогенезе бронхиальной астмы оспаривается рядом исследователей, значение пищевых аллергенов в развитии аллергических реакций со стороны респираторного тракта несомненно и требует дальнейшего изучения и уточнения.
Более редкие клинические проявления пищевой аллергии
К более редким клиническим проявлениям пищевой аллергии относятся изменения со стороны системы крови, мочевыделительной, нейроэндокринной и других систем организма.
Аллергическая гранулоцитопения. Симптомы аллергической гранулоцитопении чаще наблюдаются у детей и четко связаны с приемом причиннозначимого пищевого аллергена.
Клиническая картина аллергической гранулоцитопении, обусловленной сенсибилизацией к пищевым аллергенам, характеризуется быстрым началом, связанным с приемом пищи, когда появляется озноб, резкая общая слабость, боль в горле. Позже присоединяется ангина с некротическими и язвенными поражениями миндалин, неба, слизистой полости рта и губ. У больных отмечается бледность кожных покровов, лимфоаденопатия, увеличение селезенки. Эти симптомы исчезают на фоне элиминационной диеты.
Аллергическая тромбоцитопения. Причиной аллергической тромбоцитопении может служить сенсибилизация к молоку, яйцам, рыбе и рыбным продуктам, морским панцирным животным и др. Мы наблюдали развитие аллергической тромбоцитопении у детей с сенсибилизацией к молоку и моркови после употребления в пищу морковного сока и творога (Т.С. Соколова, Л.В. Лусс, Н.И. Рошаль, 1974). У взрослых причиной развития аллергической тромбоцитопении может служить сенсибилизация к пищевым злакам, молоку, рыбе и др.
Диагноз аллергической тромбоцитопении практически никогда не устанавливается сразу из-за отсутствия специфических симптомов. Заболевание начинается с лихорадки, геморрагических высыпаний на коже, болей в животе, артралгии. В анализе мочи отмечается наличие белка, лейкоцитов, единичных эритроцитов. Изменения в составе периферической крови бывают неоднозначными. В одних случаях наблюдается резкое снижение содержания тромбоцитов, в других, показатели содержания тромбоцитов сохраняются нормальными, но на коже появляются геморрагические высыпания, а в анализах мочи отмечаются патологические изменения (белок, лейкоциты, эритроциты).
Диагноз пищевой аллергии во всех вышеуказанных случаях устанавливается не только на основании положительного аллергологического, пищевого, фармакологического анамнеза, по результатам специфического аллергологического обследования с пищевыми аллергенами, но и на основании полного исчезновения симптомов после назначения элиминационной диеты.
Описаны клинические проявления пищевой аллергии в виде мигрени (Эдда Ханингтен, 1986 и др.), лихорадки, невритов, болезни Меньера, нарушения сердечного ритма, развития депрессии и др. Однако во многих случаях причиннозначимая роль пищевых аллергенов в развитии этих симптомов сомнительна, поскольку диагноз основывался на наличии анамнестической причинно-следственной связи между развитием симптомов и приемом пищи, но не был подтвержден результатами специфического аллергологического обследования.
Диагностика пищевой аллергии
Диагностика пищевой аллергии представляет большие сложности в связи с отсутствием единых методических подходов, унифицированных методов диагностики непереносимости пищевых продуктов, позволяющих выявить все многообразие механизмов реакций гиперчувствительности на пищевые продукты. Непереносимость пищевых продуктов при истинной пищевой аллергии сохраняется многие годы, часто всю жизнь, требует разработки индивидуальных элиминационных диет, влияет на трудоспособность и качество жизни пациентов.
Псевдоаллергические реакции непереносимости пищевых продуктов, как правило, развиваются на фоне сопутствующей соматической патологии, нередко на фоне вторичных иммунодефицитных состояний, требуют иного алгоритма диагностики и лечения заболеваний.
Принципы диагностики истинной пищевой аллергии остаются теми же, что и для всех аллергических заболеваний, и направлены на выявление аллергических антител или продуктов специфического взаимодействия антител с антигеном, а также на выявление реакций на пищевые продукты, протекающих по замедленному типу гиперчувствительности.
При диагностике пищевой аллергии и пищевой непереносимости особое внимание уделяют сбору анамнеза жизни и болезни, анализу данных аллергологического, фармакологического, пищевого анамнеза (Приложение 1) и пищевого дневника (рис. 3).
Рис. 3. Алгоритм диагностики пищевой аллергии и пищевой непереносимости
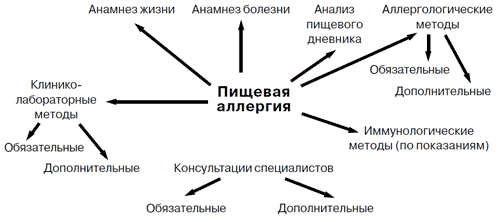
Для диагностики истинной пищевой аллергии применяют методы специфического аллергологического обследования и оценку клинико-лабораторных данных. К специфическим методам аллергологического обследования, наиболее часто используемым в практической аллергологии, относятся: кожные тесты, провокационные методы, методы выявления аллерген-специфических IgE и IgG к пищевым продуктам.
Кожные тесты. Кожное тестирование с пищевыми аллергенами проводится врачом аллергологом-иммунологом в условиях аллергологического кабинета и обязательно включается в план обследования больных с пищевой аллергией. В настоящее время отечественные и зарубежные фирмы выпускают широкий перечень пищевых аллергенов растительного и животного происхождения, в частности: злаки (пшеничная мука, рожь, овес, кукруза и др.); розоцветные (яблоко, вишня, груша, слива, малина, ежевика, клубника, абрикос, персик, нектарин и др.); гречишные (гречиха, ревень); пасленовые (картофель, баклажаны, перцы и др.); бобовые (фасоль, соя, чечевица, горох, арахис, сенна и др.); ореховые (орех грецкий, серый, американский и др.); рутовые (апельсин, мандарин, лимон и др.); грибы (дрожжевые, шампиньоны и др.); вересковые (клюква, брусника, черника и др.); ракообразные (крабы, креветки, лангусты, омары); млекопитающие (говядина, телятина, свинина, баранина, конина, мясо кролика и др.), молоко млекопитающих (коровье, козье, кобылицы и др.); птица (курица, утка, гуси, куропатки, голуби и др.), яйца птиц; рыбы (морская и речная: треска, сайда, хек, осетровые, сельди, сиговые, угревые, карповые и др. и их икра); моллюски (мидии, устрицы, гребешки, кальмары, морские ушки и др.); земноводные (лягушки) и др. Положительные кожные тесты с пищевыми аллергенами, выявляются у больных с истинной пищевой аллергией, протекающей по IgE-опосредованному типу. Однако отрицательные кожные тесты с пищевыми аллергенами позволяют с достаточной достоверностью отвергнуть диагноз пищевой аллергии, так как последняя может развиваться по другим механизмам аллергии.
Провокационные методы относят к наиболее достоверным методам диагностики пищевой аллергии. Учитывая, что провокационные тесты могут привести к развитию тяжелой системной реакции, их рекомендуется проводить только врачу, в условиях стационара или амбулаторно (в аллергологическом кабинете, расположенном на базе многопрофильного стационара с отделением интенсивной терапии).
Описанные в литературе такие диагностические тесты, как реакции лейкоцитолиза, альтерации лейкоцитов, бласттрансформации лимфоцитов, иммунного прилипания, лейкопенический и тромбоцитопенический тесты, для диагностики пищевой аллергии не используются из-за низкой их информативности. Метод "гемокод" для диагностики пищевой аллергии не может быть применен, так как с его помощью в принципе невозможно определить принадлежность пищевой непереносимости к истинным, независимо от того, или ложным аллергическим реакциям.
К наиболее информативным методам, позволяющим выявлять пищевую аллергию, относятся радиоаллергосорбентный тест (РАСТ), а также тесты с использованием САР-system, MAST-CLA-system и др. Мнения об информативности и надежности тестов агглютинации, преципитации, реакции пассивной гемагглютинации для диагностики пищевой аллергии весьма противоречивы, и используются эти методы редко. Определенное клиническое значение имеет выявление в периферической крови больных, страдающих пищевой аллергией, эозинофилии. Характерно также наличие эозинофилов в копрограмме.
Дифференциальную диагностику пищевой аллергии следует проводить с заболеваниями ЖКТ, психическими, метаболическими нарушениями, интоксикациями, инфекционными заболеваниями, аномалиями развития ЖКТ, недостаточностью эндокринной функции поджелудочной железы, целиакией, иммунодефицитными состояниями, передозировкой лекарственных средств, дисахаридазной недостаточностью, эндокринной патологией, синдромом раздраженной кишки и др.
Примером нарушения всасывания (мальабсорбции) и обмена углеводов является недостаточность лактазы - фермента, расщепляющего молочный сахар - лактозу.
У больных с лактазной недостаточностью после употребления молока возникает вздутие живота, урчание, понос, жидкий стул.
Недостаточность лактазы может быть полной или частичной, врожденной или приобретенной. Следует отметить, что в кислом молоке лактоза сбраживается и частично разрушается, поэтому кисло-молочные продукты эти больные переносят лучше.
Недостаточность сахарозы-изомальтозы. При дефиците этого фермента нарушается расщепление свекловичного или тростникового сахара - сахарозы. Недостаточность этого фермента встречается редко.
Фруктоземия - заболевание, связанное с отсутствием фермента альдолазы, участвующей в метаболизме фруктозы, в результате чего метаболизм фруктозы останавливается на образовании фруктозо-1-фосфата. Накопление этого продукта вызывает гипогликемию.
Клинические проявления возникают после приема пищи, содержащей фруктовый сахар (фрукты, мед, тростниковый сахар) и характеризуются следующими симптомами: потливость, рвота, тошнота, может быть потеря сознания и транзиторная желтуха.
Фруктоземия относится к редким наследственным заболеваниям, возникающим по аутосомно-рецессивному типу. Интересно, что носители этого заболевания избегают употребления сладкой пищи. Лечение состоит во внутривенном введении глюкозы.
Галактоземия - непереносимость галактозы, относится к наследственным энзимопатиям, передается по рецессивному типу. В основе заболевания лежит нарушение превращения галактозы в глюкозу из-за отсутствия фермента галактокиназы, что приводит к накоплению фермента галактозо-1-фосфата, повреждающего ткань почек, печени, хрусталика глаза.
Клинические проявления возникают через 2 нед после рождения. Новорожденный, кажущийся до этого здоровым, теряет аппетит, становится вялым, появляются рвота, желтуха, возникает быстрое падение массы тела, гепатоспленомегалия, кровотечение, катаракта. Лечение состоит в исключении молока.
Существует более мягкое течение галактоземии, в этом случае может быть единственный симптом - катаракта.
Нарушение обмена аминокислот. Фенилкетонурия (фенилпировиноградная олигофрения). Заболевание характеризуется отсутствием фермента фенилаланиноксидазы, необходимого для превращения фенилаланина в тирозин. В крови накапливается фенилаланин и продукт его расщепления - финилпировиноградная кислота, которые вызывают поражение головного мозга.
Лечение заключается в исключении продуктов, содержащих фенилаланин.
Нередко непереносимость пищевых продуктов обусловлена контаминацией их паразитами.
Так, например, анисакиаз - гельминтоз, который вызывается нематодами Anisakis simplex. Эти паразиты могут жить в кишечнике рыб, ракообразных, моллюсков.
При употреблении рыбы и морепродуктов, зараженных этим паразитом, может развиться крапивница, отек Квинке, тяжелые анафилактические реакции, обусловленные действием термостабильного аллергена паразита. Возникающие симптомы часто принимают за проявление аллергии к рыбе и морепродуктам.
В последние годы участились случаи непереносимости пищевых продуктов, обусловленные психическими нарушениями. У таких пациентов после приема любой пищи развиваются боли в животе, тошнота, рвота, головокружение и другие симптомы. Развивается анорексия, приводящая к истощению. Такие пациенты нуждаются в консультации психиатра и назначении адекватной терапии.
Лечение пищевой аллергии
Основными принципами лечения пищевой аллергии являются комплексный подход и этапность в проведении терапии, направленные как на устранение симптомов аллергии, так и на профилактику обострений. Важнейшее значение имеет назначение адекватного рационального питания, соответствующего по объему и соотношению пищевых ингредиентов возрасту больного, массе его тела, лечения сопутствующей патологии и коррекции сопутствующих соматических заболеваний, прежде всего со стороны ЖКТ (ферменты, пробиотики, энтеросорбенты и др.). Особенности терапии и профилактики пищевой аллергии зависят от механизмов развития непереносимости пищевых продуктов, стадии и степени тяжести клинических проявлений, возраста больного, сопутствующих заболеваний и условий проживания пациента.
Лечебно-профилактические мероприятия при пишевой аллергии включают следующие основные приемы:
- Первичную;
- Вторичную;
- Третичную.
При истинной пищевой аллергии, как и при любом другом аллергическом заболевании, применяются специфические и неспецифические методы лечения.
Неспецифические методы, или фармакотерапия, направлены на устранение симптомов развившегося заболевания и на профилактику обострений. Фармакотерапия при пищевой аллергии назначается в острый период для устранения симптомов развившейся реакции, а базисная терапия используется для профилактики возникновения таких реакций. Как известно, одним из важнейших медиаторов, ответственных за развитие клинических симптомов непереносимости пищевых продуктов, является гистамин. Поэтому особая роль в лечении заболевания отводится антигистаминным препаратам.
Выделяют три основные группы антигистаминных препаратов, применяемых при пищевой аллергии.
1. Препараты, блокирующие гистаминовые рецепторы (Н1-рецепторы), 1-го поколения, или классические антигистаминные препараты : хлоропирамин (супрастин), клемастин (тавегил), хифенадин (фенкарол), и др. и нового поколения: цетиризин (зиртек, цетрин, парлазин), эбастин (кестин), лораталин (кларитин, эролин), фексофенадин (телфаст), дезлоратадин (эриус), левоцетиризин (ксизал) и др.
2. Препараты, повышающие способность сыворотки крови связывать гистамин (гистаглобин, гистаглобулин и др.), которые назначают с профилактической целью. В настоящее время они применяются реже, так как для неспецифической терапии имеются медикаменты с лучшим профилем безопасности, не содержащие белка.
3. Препараты, тормозящие высвобождение гистамина из тучных клеток: кетотифен, препараты кромоглициевой кислоты (налкром) и др. Эта группа препаратов назначается с профилактической целью на длительный срок, не менее 2-4 мес.
В острый период назначаются антигистаминные препараты, дозы и способ введения которых (внутрь или парантерально) определяются степенью тяжести реакции.
При острых системных тяжелых клинических проявлениях пищевой аллергии вводят парентерально глюкокортикостероиды (в частности, дексазон и др.), антигистаминные препараты 1-го поколения (супрастин и др.).
Антигистаминные препараты 1-го поколения являются конкурентными блокаторами Н1-рецепторов и поэтому связывание их с рецептором быстро обратимо. В связи с этим для получения клинического эффекта необходимо использовать эти препараты в высоких дозах и часто (3-4 раза в сутки), однако существует возможность использовать некоторые препараты в комбинациях с препаратами 2-го поколения при назначении на ночь.
В начале 80-х годов в практику клинической аллергологии были введены антигистаминные препараты 2-го поколения.
Н1-антагонисты нового поколения отличаются высокой избирательной способностью блокировать периферические Н1-рецепторы. Принадлежат они к разным химическим группам. Большинство Н1-антагонистов 2-го поколения связываются с Н1-рецепторами неконкурентно. Такие соединения с трудом могут быть вытеснены с рецептора, а образовавшийся лиганд-рецепторный комплекс диссоциирует сравнительно медленно, чем и объясняется более продолжительное действие таких препаратов. Н1-антагонисты 2-го поколения легко вса сываются в кровь. Прием пищи не влияет на абсорбцию этих препаратов. Большинство Н1-антагонистов являются пролекарствами и оказывают противогистаминное действие за счет накопления в крови фармакологически активных метаболитов.Поэтому метаболизируемые препараты максимально проявляют свое антигистаминное действие после появления в крови достаточной концентрации активных метаболитов. В отличие от метаболизируемых антигистаминных препаратов цетиризин практически не метаболизируется и начинает действовать сразу. Он выводится в основном через почки в неизмененном виде.
При назначении антигистаминных препаратов следует учитывать возможные нарушения абсорбции в системе желудочно-кишечного тракта и одновременный прием сорбентов. Нередко, при острых системных аллергических реакциях на начальном этапе терапии предпочтение следует отдавать парентаральным формам. Необходимо учитывать и биодоступность препарата, например, супрастин в инъекционной форме имеет 100% мгновенную биодоступность. Большую роль играет и липофильность - чем выше липофильность, тем больше биодоступность.
Эффективность антигистаминных препаратов как 1-го, так и нового поколения весьма высокая. К настоящему времени накоплен почти 60-летний опыт применения антигистаминных препаратов 1-го поколения, а за последние два десятилетия широкое применение нашли препаратов 2-го, или нового, поколения.
По мере накопления клинического опыта по эффективности данных препаратов, накапливались и данные о нежелательных эффектах препаратов этой группы. Основные побочные фармакологические эффекты Н1-антагонистов 1-го поколения: проникновение через гематоэнцефалический барьер; блокада не только Н1-рецепторов, но и М-холинорецепторов; 5НТ-рецепторов; D-рецепторов; местнораздражающее действие, аналгизирующий эффект, седативное действие. Эти препараты могут вызывать головокружение, вялость, расстройства со стороны ЖКТ (тошнота, боли в животе, нарушение аппетита), нарушение мочевыделения, ухудшение зрения. Побочные действия антигистаминных препаратов 1-го поколения проявляются также сухостью слизистых оболочек полости рта, носа, горла. Самым характерным и хорошо известным побочным действием противогистаминных препаратов 1-го поколения является седативный эффект, связанный с проникновением этих препаратов через гематоэнцефалический барьер и блокадой гистаминовых рецепторов в ЦНС. Седативное действие может варьировать от легкой сонливости до глубокого сна. Наиболее выраженные седативные свойства выявлены у этаноламинов, фенотиазинов, пиперазинов. Другими проявлениями действия Н1-антагонистов на ЦНС могут быть нарушения координации, головокружение, чувство вялости, снижение способности координировать внимание. К редким побочным эффектам антигистаминных препаратов 1-го поколения можно отнести - повышение аппетита (у пиперидинов). Тахифилаксия (снижение терапевтической эффективности препарата) в той или иной степени проявляется у всех антигистаминных препаратов 1-го поколения.
Основными преимуществами Н1-антагонистов 2-го поколения являются: высокая специфичность и высокое сродство к Н1-рецепторам; быстрое начало действия; длительное действие (до 24 ч); отсутствие блокады рецепторов других медиаторов; непроходимость через гематоэнцефалический барьер; отсутствие связи абсорбции с приемом пищи; отсутствие тахифилаксии.
Наиболее широко применяемыми в практической аллергологии антигистаминными препаратами 1-го поколения являются: этаноламины, этилендиамины, пиперидины, алкиламины, фенотиазины.
К этаноламинам относятся следующие препараты: дифенгидролин, клемастин и др. Дифенгидрамин (димедрол) является одним из основных представителей антигистаминных препаратов 1-го поколения. Он проникает через гематоэнцефалический барьер, обладает выраженным седативным эффектом, умеренным противорвотным свойством. Клемастин (тавегил) по фармакологическим свойствам близок к димедролу, но обладает более выраженной антигистаминной активностью, более продолжительным действием (в течение 8-12 ч) и умеренным седативным эффектом.
К классическим представителям этилендиаминов относитсяхлоропирамин (супрастин) , в применении которого накоплен колоссальный опыт. Показано, что при аллергических заболеваниях, сопровождающихся интенсивным зудом, возможно комбинированное применение супрастина с антигистаминным препаратом нового поколения (И.С. Гущин, Н.И. Ильина, 2002). Парентеральная форма препарата часто используется для стартовой терапии аллергодерматозов, так как позволяет получить 100% биодоступность лекарства и преодолеть проблему нарушений абсорбции у пациентов с пищевой аллергией.
Среди производных пиперидина наиболее широко используют ципрогептадин (перитол) , который относится к антигистаминным препаратам с выраженной антисеротониновой активностью. Кроме того, перитол обладает свойством стимулировать аппетит, а также блокировать гиперсекрецию соматотропина при акромегалии и секрецию АКТГ при синдроме Иценко-Кушинга.
Представителем алкиламинов, используемым для лечения аллергических заболеваний, является диметинден (фенистил) . Препарат действует в течение суток, обладает выраженным седативным действием, как и у других препаратов 1-го поколения отмечается развитие тахифилаксии. Побочные симптомы проявляются также сухостью слизистых оболочек полости рта, носа, горла. У особо чувствительных лиц могут возникать расстройства мочеиспускания и ухудшение зрения. Другими проявлениями действия на ЦНС могут быть нарушения координации, головокружение, чувство вялости, снижение способности координировать внимание.
Хифенадин (фенкарол) обладает низкой липофильностью, плохо проникает через гематоэнцефалический барьер, имеются указания, что он обладает антиаритмической активностью, активирует диаминоксидазу (гистаминазу), разрушающую гистамин. За счет того, что препарат плохо проникает через гематоэнцефалический барьер, после его приема отмечается либо слабый, либо отсутствие седативного эффекта. Разрешен к применению у детей раннего возраста.
Кетотифен (задитен) , как полагают, оказывает противоаллергическое действие за счет торможения секреции медиаторов аллергии из тучных клеток и блокады Н1-рецепторов гистамина.
Среди современных антигистаминных препаратов нового поколения, в настоящее время в клинической практике используются следующие группы: пиперазиновые производные (цетиризин, левоцетиризин), азатидиновые производные (лоратадин, дезлоратадин), трипролидиновые производные (акривастин), оксипиперидины (эбастин), пиперидиновые (фексофенадин).
Пиперазиновые производные. Цетиризин (цетрин, парлазин, зиртек и др.) является избирательным блокатором Н1-рецепторов, не оказывает существенного седативного эффекта, и как другие представители 2-го поколения, не имеет антисеротонинового, антихолинергического действия, не усиливает действие алкоголя. Сравнительные исследования показали, что цетиризин эффективнее подавляет действие гистамина, чем лоратадин и фексофенадин. Только у цетиризина доказана истинная противовоспалительная активность при приеме в терапевтических дозах у людей. Цетиризин уменьшает миграцию эозинофилов и нейтрофилов (на 75%), базофилов (на 64%) и снижает концентрацию простагландина D2 (в 2 раза) в очаге аллергического воспаления (E. Chalesworth et al.). Исследования других антигистаминных препаратов не выявили такого действия. Кроме этого, опубликованные результаты программы ETAC (Early Treatment of the Atopic Child), свидетельствовали о профилактическом воздействии цетиризина на развитие бронхиальной астмы у детей. При проспективном исследовании 817 детей с АтД из семей с наследственной отягощенностью по атопическим заболеваниям показано, что длительное применение этого препарата в комплексной терапии АтД в подгруппе из 200 детей в 2 раза снижало вероятность развития у них бронхиальной астмы при сенсибилизации к домашней пыли (28,6% среди получавших цетиризин по сравнению с 51,5% среди получавших плацебо) и к пыльце (27,8% и 58,8% соответственно).
Азатидиновые производные. Лоратадин (кларитин, эролин и др.) - относится к метаболизируемым Н1-антагонистам, является селективным блокатором Н1-рецепторов, не имеет антисеротонинового, антихолинергического действия, не усиливает действие алкоголя. Дезлоратадин (эриус) является фармакологически активным метаболитом лоратадина, обладает большим сродством к Н1-рецепторам и может быть использован в меньшей, чем лоратадин, лечебной дозе (5 мг в сутки).
Оксипиперидины. Эбастин (кестин) - современный, высокоизбирательный неседативный Н1-антагонист 2-го поколения. Относится к метаболизируемым препаратам. Фармакологически активный метаболит - каребастин. Эбастин оказывает выраженный клинический эффект как при сезонных, так и при круглогодичных аллергических ринитах, обусловленных сенсибилизацией к пыльцевым, бытовым и пищевым аллергенам. Противоаллергическое действие кестина начинается уже через час после перорального приема и продолжается до 48 ч. В детской практике эбастин используется у детей с 6 лет. Кестин, в отличие от лоратадина, можно назначать в удвоенной дозе, что значительно повышает его эффективность, но при этом, кестин не вызывает побочных эффектов со стороны ЦНС и сердечно-сосудистой системы.
Пиперидины. Фексофенадин (телфаст) является конечным фармакалогически активным метаболитом терфенадина и обладает всеми преимуществами Н1-антагонистов 2-го поколения.
Препараты, повышающие способность сыворотки крови связывать гистамин. Гистаглобулин (гистаглобин) представляет собой комбинированный препарат, состоящий из нормального человеческого иммуноглобулина и гистамина гидрохлорида.
Препараты, тормозящие высвобождение медиаторов из тучных клеток и других клеток-мишеней аллергии. Противоаллергический эффект этой группы препаратов связан с их способностью тормозить высвобождение медиаторов из клеток-мишеней аллергии.
Препараты кромоглициевой кислоты (кромогликат натрия). Теория нецитотоксического вовлечения в аллергический ответ клеток-мишеней аллергии окончательно сформировалась в 70-е годы и послужила поводом для создания препаратов, действие которых направлено на торможение функции клеток-мишеней аллергии (И.С. Гущин). Кромогликат натрия, открытый в 1965 г Altounyan, отвечал этим требованиям и уже через 3 года нашел клиническое применение. Кромогликат натрия действует рецепторным механизмом, не проникая в клетки, не метаболизируется и экскретируется в неизмененном виде с мочой и желчью. Этими свойствами кромогликата натрия может быть объяснена чрезвычайно низкая частота нежелательных побочных эффектов. При пищевой аллергии особое значение имеет пероральная лекарственная форма кромоглициевой кислоты - налкром.
Таким образом, выбор антигистаминных препаратов, при лечении аллергических заболеваний, требует от врача учета индивидуальных особенностей пациента, особенностей клинического течения аллергического заболевания, наличия сопутствующих заболеваний, профиля безопасности рекомендуемого медикамента. Не малое значение имеет и доступность (в частности, стоимость медикамента) для пациента.
Среди современных антигистаминных препаратов имеются медикаменты, обладающие высокой степенью безопасности, что позволяет аптекам отпускать их без рецепта врача. В частности, к таким препаратам относится кестин, зиртек, цетрин, парлазин, кларитин, телфаст, эриус и др. Тем не менее следует рекомендовать пациентам советоваться с лечащим врачом, какой из препаратов более всего показан конкретному пациенту с пищевой аллергией.
При клинических симптомах легкой и средней степени тяжести рекомендуется назначать антигистаминные препараты новой генерации и их генерики: эбастин (кестин), цетиризин (зиртек, парлазин, цетрин, летизен и др.), фексофенадин (телфаст), лоратадин (кларитин, эролин, кларисенс и др.), дезлоратадин (эриус). Принципы назначения, схемы и способы введения антигистаминных препаратов при пищевой аллергии те же, что и при других формах аллергопатологии.
При назначении антигистаминных препаратов следует четко придерживаться рекомендаций, изложенных в инструкции по применению, особенно у детей и лиц пожилого и старческого возраста.
Антигистаминые препараты назначаются в сочетании с комплексной терапией, направленной на коррекцию сопутствующих соматических заболеваний.
Имеются данные о высокой клинической эффективности комбинированных схем применения антигистаминных препаратов, позволяющих определить индивидуальную чувствительность пациента и подобрать максимально эффективную схему лечения.
Схемы комбинированной терапии
1. При аллергических заболеваниях с интенсивным зудом рекомендовано сочетанное применение антигистаминных препаратов 2- и 1-го поколений (И.С. Гущин, Н.И. Ильина, 2002) утром + вечером 1 таб. эролин 1 таб. супрастин
2. Подбор разных препаратов к индивидуальной чувствительности пациента 5-7 дней супрастин -> 5-7 дней парлазин -> 5-7 дней эролин
Прием препарата в течение 5-7 дней, при отсутствии положительной динамики - смена препарата (на основании рекомендаций главного детского аллерголога МЗ РФ профессора, д.м.н. В.А. Ревякиной, ГУ НЦ Здоровья детей РАМН).
Эффективной является и комбинация кестина с фенкаролом, как у взрослых, так и у детей.
К специфическим методам лечения пищевой аллергии относятся элиминация пищевого аллергена и аллерген-специфическая иммунотерапия (АСИТ).
Элиминация пищевого аллергена
Элиминация, или исключение из питания причиннозначимого пищевого аллергена, относится к основным методам терапии пищевой аллергии, а в случаях, когда пищевая аллергия развивается к редко употребляемым пищевым продуктам (например, клубника, шоколад, крабы и пр.), единственным эффективным методом лечения.
Элиминация требует не только исключения конкретного пищевого продукта, ответственного за развитие сенсибилизации, но и любых других, в состав которых он входит даже в следовых количествах.
При назначении элиминационной диеты необходимо строго следить за тем, чтобы больной получал питание, соответствующее по объему и соотношению пищевых ингредиентов массе тела и возрасту.
Большой вклад в составление элиминационных диет внес Rowe, который разработал элиминационные диеты для больных с пищевой аллергией к молоку, яйцу, пищевым злакам, а также к сочетанным формам пищевой аллергии.
При пищевой непереносимости больные нуждаются не в элиминационных диетах, а лишь в адекватной терапии и коррекции питания, соответствующего сопутствующим соматическим заболеваниям.
При истинной пищевой аллергии больным следует назначать элиминационные диеты с полным исключением причиннозначимых пищевых аллергенов и других продуктов, в состав которых они могут входить. При назначении элиминационных диет важно не только указать, какие продукты исключаются из питания, но и предложить пациенту перечень пищевых продуктов, которые можно включать в диету. Элиминационная диета по объему и соотношению пищевых ингедиентов должна полностью соответствовать возрасту больного, сопутствующим заболеваниям и энергетическим затратам. Элиминация пищевого продукта назначается только при доказанной аллергии к нему.
При назначении элиминационной диеты необходимо исключать и продукты, имеющие с пищевым аллергеном перекрестные реакции (молоко - говядина, пищеварительные ферменты; плесневые грибы - кефир, сыр, дрожжевая выпечка, квас, пиво и др.; пыльца растений - фрукты, овощи, ягоды и др.).
При отсутствии положительной динамики симптомов пищевой аллергии в течение 10 дней после назначения элиминациии диеты следует пересмотреть перечень рекомендуемых больному продуктов и выявить причину неэффективности назначенной диеты.
Варианты диет при пищевой аллергии
1. Беззлаковая диета: исключить крупы, муку и мучные изделия, приправы, соусы и др.). Можно: мясо, рыба, овощи, фрукты, яйца, молочные продукты и др. (при отсутствии аллергии к ним).
2. Диета с исключением яиц: исключить яйца и приправы, майонез, кремы, соусы, кондитерские, макаронные и хлебобулочные изделия с содержанием яиц). Можно: мясо, молочные продукты, крупы, муку и мучные изделия без яиц, овощи, фрукты (при отсутствии аллергии к ним).
3. Диета с исключением молока: исключить молоко и молочные продукты, каши на молоке, сгущенное молоко, творог, сметану, кондитерские, макаронные и хлебобулочные изделия с содержанием молока), сливочное масло, сыры, конфеты, содержащие молоко. Можно: мясо, рыба, яйца, крупы, овощи и фрукты, мучные изделия без молока и др. (при отсутствии аллергии к ним).
4. Диета с исключением молока, яиц и злаков: исключить продукты, содержащие молоко, яйца, пищевые злаки.
В настоящее время имеется большой выбор продуктов питания промышленного производства, рекомендованных для больных с истинными и ложными аллергическими реакциями, как для детей, так и взрослых, которые включают различные смеси на основе гидролизатов молочного белка, изолята соевого белка, гипоаллергенные монокомпонентные мясные консервы и пюре, гипоаллергенные безмолочные каши и др. В частности, уже более полувека западногерманская фирма HUMANA предлагает программу детского питания, включающего лечебные и профилактические продукты и продукты прикорма. Большинство продуктов, входящих в него, может применяться детьми различного возраста и взрослыми. В разработке состава смесей учитываются все новейшие достижения и требования ВОЗ и Европейского общества педиатров, гастроэнтерологов и диетологов. Для детей с повышенным риском возникновения аллергии, а также для детей с пищевой аллергией, непереносимостью белков сои можно, начиная с первых дней жизни, рекомендовать смесь "Humana HA1", которая может применяться и как единственное питание, у детей, находящихся на искуственном вскармливании, и как дополнение к естественному вскармливанию, сразу же после кормления грудью или любым другим гипоаллергенным молочным питанием для младенцев.
"Humana HA2" можно рекомендать детям после 4 мес, у которых есть повышенный риск развития аллергии. Смесь содержит расщепленные белки, хорошо насыщает и усваивается, не содержит белого сахара-песка и глютена.
"Humana HA Каша" - специальная гипоаллергенная каша для детей после 4-месячного возраста и для взрослых. "Humana HA Каша" назначают как дополнение к кормлению грудью, к "Humana HA1", "Humana HA2" или любому другому питанию для детей.
При аллергии к коровьему молоку рекомендовано использование специальных смесей, приготовленных на основе гидрализатов молочного белка, соевые смеси, безмолочные смеси (каши).
Например, "Humana SL" изготовлена на основе растительного белка. Этот продукт можно давать, начиная с первого месяца, вплоть до школьного возраста. "Humana SL" не содержит коровьего молока , молочного белка , галактозы, белого сахара-песка, клейковины.
При сопутствующей патологии ЖКТ можно рекомендовать программу "Humana HN лечебное питание".
Расчет размера порции "Humana HN лечебное питание" на одно кормление зависит от индивидуальных особенностей ребенка и взрослых (табл. 3).
Таблица 3. Расчет размера порции "Humana HN лечебное питание" на одно кормление
| Возраст | Вода (мл) | Количество мерных ложек | Объем смеси (мл) | Количество кормлений в день (жидкая 14,5% смесь) | Количество кормлений в день (каша 30%) |
| 1-3 мес | 120 | 4 | 130 | 6 | - |
| 4-5 мес | 150 | 5 | 170 | 5-6 | - |
| После 6 мес | 150 | 6 13 | 200 300 | 3-4 | 1-2 |
| Ранний школьный возраст | 150 | 13 | 200 | - | 4-5 |
| Взрослые | При необходимости в качестве дополнительного питания (каша 30%) | ||||
Существуют и другие программы питания для детей и взрослых, выпускаемые отечественными и зарубежными фирмами, которые назначаются с учетом показаний и противопоказаний к их применению.
В частности, компания "Хайнц" производит каши в г. Георгиевске Ставропольского края, завозит пюре, соки и печенье из Италии, пюре и каши из Англии.
Компания "Хайнц" в производстве питания категорически не применяет генетически модифицированные продукты (ГМП) и добровольно анализирует сырье (муку) и готовый продукт на наличие ГМП. Все итальянское питание производится по программе "Хайнц"-Оазис", что означает государственную сертификацию всей производственной цепочки - от выращивания сырья (овощи и фрукты) и откорма животных (мясо) до 24-часового мониторинга качества и безопасности готового продукта. Компания гарантирует производство питания из растительного сырья, выращенного на полях без пестицидных и гербицидных удобрений, и использование мяса животных, выкормленных исключительно растительным сырьем из сертифицированных источников, без применения различных пищевых добавок, сырья, не подвергавшегося воздействию антибиотиков, и пр. На заводе имеется поименный список стад, эти стада на периодической основе контролируются ветеринарными службами Италии и компании. Аналогично обстоит дело и на заводах в Англии.
Компания "Хайнц" выпускает широкий ассортимент питания, из которого можно составить и аглютеновую диету, и диету для детей с лактазной непереносимостью, и при пищевой непереносимости, обусловленной патологией ЖКТ.
Наибольшие проблемы в составлении диеты возникают у врача при назначении питания детям первых месяцев жизни, находящихся на искусственном вскармливании. В этих случаях дети, как правило, получают смеси на основе коровьего молока. Как показывает клинический опыт, именно в этом возрасте отмечаются симптомы непереносимости молочных смесей и необходимость включения в питание заменителей грудного молока.
В таких ситуациях врачу приходиться учитывать ряд проблем, возникающих при назаначении заменителей грудного молока, а именно: имеется ли у ребенка истинная пищевая аллергия к коровьему молоку или только непереносимость, связанная с расстройствами функционирования ЖКТ или другими причинами, указанными выше; необходимость временного назначения заменителей грудного молока с целью профилактики последующей сенсибилизации к пищевым продуктам у детей с отягощенной аллергологической наследственностью, особенно по пищевой аллергии.
В зависимости от особенностей клинического течения истинной и ложной пищевой аллергии к коровьему молоку, детям рекомендуют различные смеси. Как указано выше, существуют смеси на основе сои, гидролизатов белка, аминокислот, молока других животных, кисломолочные смеси. При истинной пищевой аллергии к коровьему молоку у детей первого года жизни для питания можно рекомендовать смеси на основе гидролизата белка (табл. 4).
Таблица 4. Пептиды с различным молекулярной массой в гидролизованных смесях
| Гидролизаты | Молекулярная масса (в кДа) | |||||
| <1 | 1-3,5 | 3,5-5,5 | 5-10 | 10-20 | >20 | |
| Альфаре | 50,7 | 40,2 | 4,9 | 2,6 | 0,4 | 1,1 |
| Нан-га | 31,4 | 41,9 | 7 | 7 | 4,2 | 8,6 |
| Прегестемил | 69,9 | 23,5 | 0,9 | 0,3 | 0,1 | 4,3 |
| Фрисопеп | 40,9 | 48,6 | 5,8 | 3,3 | 0,6 | 0 |
К основным недостаткам гидролизованных смесей относятся высокая стоимость продукта, низкие вкусовые качества, недостаточная доступность для населения.
Проведенные в последние годы научные исследования российских и западных ученых, показали эффективность замены коровьего молока на козье у больных пищевой аллергией, что связывают с особенностями физико-химической структуры козьего молока. В частности, в козьем молоке основной казеиновой фракцией является бета-казеин и отсутствует альфа S-1-казеин и гамма-казеин. Кроме того, основным сывороточным белком коровьего молока является бета-лактоглобулин, обладающий выраженной сенсибилизирующей активностью, а в козьем молоке основным сывороточным белком является альфа-лактальбумин (табл. 5).
Таблица 5. Сравнение белков коровьего и козьего молока (г/л)
| Белки молока | Коровье молоко | Козье молоко |
| альфа S-1-казеин | 13,7 | 0 |
| β-казеин | 6,2 | 22,8 |
| γ-казеин | 1,2 | 0 |
| β-лактоглобулин | 3,0 | 2,6 |
| α-лактальбумин | 0,7 | 4,3 |
| Иммуноглобулины | 0,6 | 0 |
| Сывороточный альбумин | 0,3 | 0 |
| Всего | 29,4 | 29,7 |
Более того, белки козьего молока отличаются от коровьего и по структурным свойствам. В таблице 6 указано содержание основных пищевых веществ в женском, коровьем и козьем молоке.
Таблица 6. Содержание основных пищевых веществ в женском, коровьем и козьем молоке (на 100 мл) [по И.И. Балаболкину и соавт., 2004]
| Пищевые вещества | Женское молоко | Коровье молоко | Козье молоко |
| Белки (г): Казеин (%) Сывороточные белки (%) | 1,0-2,0 60 40 | 2,8-3,3 80 20 | 2,9-3,1 75 25 |
| Жиры (г) | 4,5 | 4,0 | 4,1 |
| Углеводы (г) Лактоза | 6,5 6,5 | 4,6 4,6 | 4,3 4,3 |
| Энергитическая ценность (ккал) | 75 | 66,5 | 66 |
Данные о количественных и структурных различиях в содержании пищевых ингредиентов в женском, коровьем и козьем молоке послужили основанием для поиска и разработки продуктов на основе козьего молока для использования не только в качестве заменителя жеснского молока, но и при непереносимости коровьего молока, и при пищевой непереносимости, обусловленной заболеваниями ЖКТ у взрослых.
Компания БИБИКОЛЬ выпускает линию сухих молочных смесей на основе козьего молока для детей и взрослых. Адаптированная молочная смесь "НЭННИ" рекомендована для детей от момента рождения при невозможности грудного вскармливания и при непереносимости коровьего молока и сои.
Витаминизированная молочная смесь "НЭННИ Золотая козочка" рекомендуется детям в возрасте от одного года, производится в Новой Зеландии из экологически чистого козьего молока. Отличается от сухой смеси "НЭННИ для детей от рождения" более высоким содержанием белка, минеральных веществ и витаминов, обеспечивающих потребности растущего организма.
АМАЛТЕЯ - быстрорастворимое козье молоко для взрослых, производится в Голландии из свежего козьего молока по технологии, сохраняющей его биологическую ценность. Рекомендуется больным с непереносимостью коровьего молока, беременным и кормящим женщинам для обеспечения повышенной потребности в кальции, фолиевой кислоте, витаминах, минеральных веществах и для профилактики пищевой аллергии, а также лицам пожилого и старческого возраста, спортсменам в период интенсивных тренировок и при стрессах.
Существуют и другие продукты питания, предназначенные для больных пищевой аллергией и пищевой непереносимость, информация о которых имеется в периодической печати. Кроме вышеуказанных продуктов питания, имеются и другие предложения различных отечественных и зарубежных фирм, знакомство с которыми позволяет подобрать наиболее оптимальную индивидуальную диету.
Гипоаллергенная диета характеризуется исключением из питания продуктов, обладающих выраженной сенсибилизирующей активностью и содержащих продукты, богатые гистамином, тирамином, гистаминолибераторами.
Детям в возрасте от 0 до 1,5 лет из питания исключают куриные яйца, рыбу, морепродукты, бобовые, пшено, орехи, арахис, цельное или разведенное коровье молоко и его разведения.
У взрослых из питания исключают также алкогольные напитки (любые), прянности, копченности и другие продукты, содержащие в избытке гистамин, тирамин, пищевые добавки, биологически активные добавки (Приложение 2).
При назначении гипоаллергенной диеты больным с ПАР необходимо точно указать длительность ее применения и порядок расширения диеты после устранения симптомов непереносимости пищевых продуктов. В основном гипоаллергенную диету назначают сроком от 3 нед до 2 мес. Пациенты, получающие гипоаллергенную диету, должны вести пищевой дневник, анализ которого позволяет с достаточной вероятностью выявить основные причины непереносимости пищевых продуктов. Гипоаллергенная диета назначается и как один из этапов подготовки больного к проведению провокационных оральных тестов и проведения двойного-слепого плацебо-контролированного исследования с пищевыми продуктами.
Аллергенспецифическая иммунотерапия при пищевой аллергии проводится лишь в том случае, когда в основе заболевания лежит реагиновый механизм, а пищевой продукт является жизненно необходимым (например, аллергия к молоку у детей). Первые попытки проведения АСИТ при пищевой аллергии осуществлялись в начале 20-х годов XX в. Были предложены разные методы ее проведения: пилюльный, пероральный, подкожный. Однако многие исследователи пришли к заключению о низкой эффективности АСИТ пищевыми аллергенами при пищевой аллергии. Тем не менее мы считаем, что вопрос о целесообразности проведения специфической иммунотерапии при пищевой аллергии еще не решен окончательно и требует дальнейшего изучения.
Профилактика пищевой аллергии направлена на устранение (желательно наиболее полное) причинозначимых пищевых аллергенов, факторов риска и провоцирующих факторов развития пищевой аллергии, с учетом возраста, наличия генетически детерминированной предрасположенности к развитию аллергии и при проведении адекватной коррекции сопутствующих соматических заболеваний.
Приложение 1.
Пищевой анамнез
(указать время последнего приема пищевого продукта, время появления, длительность и особенности клинических проявлений реакции, чем купировалась реакция)
Продукты
Мясо: говядина, свинина, баранина, другие сорта
Рыба и рыбные продукты
Птица
Масло: Сливочное, Подсолнечное, Оливковое, другие сорта
Молоко и молочные продукты
Яйца
Овощи
Фрукты
Ягоды
Мучные продукты
Крупы
Орехи
Кофе
Мед
Грибы
Шоколад
Острые и копченые изделия
Приложение 2.
Общая неспецифическая гипоаллергенная диета
РЕКОМЕНДУЕТСЯ ИСКЛЮЧИТЬ ИЗ РАЦИОНА:
1. Цитрусовые - апельсины, мандарины, лимоны, грейпфруты и др.
2. Орехи - фундук, миндаль, арахис, и др.
3. Рыбу и рыбные продукты - свежую и соленую рыбу, рыбные бульоны, консервы из рыб, икру и др.
4. Птицу - гуся, утку, индейку, курицу и др. - и изделия из нее.
5. Шоколад и шоколадные изделия.
6. Кофе.
7. Копченые изделия.
8. Уксус, горчицу, майонез и прочие специи.
9. Хрен, редис, редьку.
10. Томаты, баклажаны.
11. Грибы.
12. Яйца.
13. Молоко пресное.
14. Клубнику, землянику, дыни, ананасы.
15. Сдобное тесто.
16. Мед.
17. Категорически запрещается употреблять все алкогольные напитки.
В ПИЩУ МОЖНО УПОТРЕБЛЯТЬ:
1. Мясо говяжье нежирное отварное.
2. Супы крупяные, овощные:
а) на вторичном говяжьем бульоне,
б) вегетарианские.
3. Масло сливочное, оливковое.
4. Картофель отварной.
5. Каши - гречневую, геркулесовую, рисовую.
6. Молочнокислые продукты однодневные - творог, кефир, простоквашу.
7. Огурцы свежие, петрушку, укроп.
8. Яблоки печеные.
9. Чай.
10. Сахар.
11. Компоты из яблок, сливы, смородины, вишни, сухофруктов.
12. Белый не сдобный хлеб.
Пищевой рацион включает приблизительно 150 г белков, 250 г углеводов, 150 г жиров, что соответствует энергитической ценности около 2800 ккал. РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
1. Клинические реакции на пищу. Под ред. М.Х. Лессоф. М., Медицина, 1986, 254 с.
2. Клиническая аллергология. Под. ред. Р.М. Хаитова. М., "МЕДпресс-информ", 2002, 623 с.
3. Боровик Т.Э., Ревякина В.А., Макарова С.М. Современные представления о лечебном питании при пищевой аллергии у детей раннего возраста. Доктор. Ру, 2004, № 2, с. 2.
4. Лусс Л.В. Пищевая аллергия. Аллергия, астма и клин. иммунол., 2002, т. 6 , № 12, с. 3-14.
