Магний и пиридоксин как основы нутрициального подхода к патогенетической терапии детей с синдромом дефицита внимания c гиперактивностью
СтатьиГромова О.А.1,2, Гусев Е.И.2, Баранов А.А.3, Шиляев Р.Р.1, Гришина Т.Р. 1, Егорова Е.Ю. 1,2, Калачева А.Г. 1,2, Лиманова О.А. 1,2, Новикова Е.А. 1, Сатарина Т.Р. 1,2, Торшин И.Ю.2, Федосеенко М.В. 2,3, Федотова Л.Э. 1,2
2 - РСЦ «Нейробиология» Института Микроэлементов ЮНЕСКО, Москва
(директор – академик РАМН, заведующий кафедрой неврологии РГМУ, проф. Е.И. Гусев)
3 - Научный Центр Здоровья Детей РАМН, Москва(директор - академик РАМН, проф. А.А. Баранов)
Абстракт
Синдром дефицита внимания с гиперактивностью (СДВГ) широко распространен среди детей и подростков. Данное заболевание характеризуется сложной этиологией и, в настоящее время, патогенетического лечения СДВГ не существует. Анализ симптоматики и данные биохимических исследований позволяют предположить, что СДВГ характеризуется нарушениями нейротрансмиттерного баланса, в частности баланса дофамина, норадреналина, серотонина. При анализе этиологии СДВГ и, следовательно, при назначении терапии, часто упускается из вида фундаментальный факт – баланс нейротрансмиттеров в значительной степени зависит от состояния гомеостаза витаминов, макро- и микроэлементов. В настоящей статье представлена ретроспектива клинических исследований взаимосвязи между макро/микронутриентным статусом и клиническими проявлениями СДВГ у детей. Особое внимание уделяется роли магния в терапии СДВГ. Результаты исследований более 700 детей с СДВГ указывают на существование четкой взаимосвязи между дефицитом магния и интенсивностью проявления симптоматики заболевания. Применение препаратов органического магния с пиридоксином (МагнеВ6) способствует существенной компенсации СДВГ, особенно при использовании в комплексных программах лечение педиатрических пациентов.
Ключевые слова: дети, СДВГ, патогенетическая терапия СДВГ, Магний и пиридоксин.
Введение
Синдром дефицита внимания с гиперактивностью (СДВГ) – большая социальная, педагогическая и медицинская проблема. Клиника этого неврологическо-поведенческого расстройства развития начинается в раннем возрасте (до 3 лет) и проявляется такими симптомами, как трудность концентрации внимания, гиперактивность, плохо управляемая импульсивность и, в целом, недостатком самоконтроля над поведением в ответ на конкретные требования окружающей обстановки. В различных странах мира, от 5% до 40% детей в популяции могут характеризоваться СДВГ различной интенсивности [1,2].
СДВГ обязательно характеризуется дефицитом внимания, также гипермоторикой, эмоциональной неустойчивостью, неконтролируемым поведением во время стресса. По данным Н.Н.Заваденко (1999-2002) [3], в результате комплексного неврологического и психологического обследования учащихся начальных классов общеобразовательных школ г. Москвы, частота встречаемости СДВГ в городе составила 16,5%, при этом среди мальчиков - 22% , что гораздо выше чем у девочек (10%) [3,4]. СДВГ обнаруживается у детей независимо от национальности из семей всех социальных слоев, хотя низкий уровень образования и культуры в семьях детей с СДВГ встречается заметно чаще. Дети страдающие СДВГ не могут высидеть 20 минутный урок в дошкольных учреждениях, а 45-минутное занятие в общеобразовательной школе часто является для них непреодолимым препятствием.
До начала перестройки, СДВГ не имело столь широкого распространения у российских детей как в настоящее время. После 1992 года, в России наблюдается постоянное нарастание популяции детей и подростков с СДВГ, осложненным девиантными формами поведения [3,5] такими как алкоголизм и наркомания. По словам акад. Л.В. Бадаляна, основавшего в России научную школу детской неврологии, игнорирование проблемы лечения СДВГ у детей приведет к поножовщине подростков. Действительно, постановка диагноза СДВГ в детстве соответствует девиантным формам поведения и повышенной травматизации подростков [3].
Некомпенсированный СДВГ – деструктивный тип поведения. СДВГ влечет за собой широчайший круг проблем социальной адаптации, включая наркоманию [6], токсикоманию, и преступность. СДВГ крайне отрицательно сказывается на образовании, профессиональной деятельности, браке и сексуальной активности, воспитании детей, способности распоряжаться финансами и др [7-9]. По данным Бюро переписи населения США (аналог российского Госкомстата), менее 5% пациентов с СДВГ получили диплом какого-либо колледжа (по сравнению с 28% в среднем по США) [10].
Этиология СДВГ только начинает прояснятся, хотя за последние 5 лет выявлено множество факторов, увеличивающих риск развития данного заболевания. Существует множество гипотез (генетическая, нейробиологическая, нейроанатомическая, биохимическая, токсическая и другие), пытающихся раскрыть тайну “многоликого клинического ассорти” под рубрикой СДВГ. Выявлены характерные нарушения макро- и микроэлементного баланса, выяснены роли различных генетических полиморфизмов. Продемонстрирована весомая роль современного «искусственного» питания (содержащего значительные количества синтетических пищевых добавок и избыток поваренной соли) в формировании гиперактивности. Гиперактивность у детей поддерживается неблагоприятными экологическими факторами (формальдегид, диоксид углерода, тяжелые металлы). В анамнезе у детей с гиперактивностью, по сравнению со здоровыми сверстниками, чаще обнаруживаются токсикозы и эклампсия у матерей, алкоголизм, курение и наркомания у родителей. Асоциальный образ жизни семьи также способствует развитию СДВГ и значительно затрудняет реабилитацию ребенка [4, 11].
Существует два основных подхода к терапии СДВГ: фармакотерапевтический (включая препараты ноотропного действия, модуляторы нейротрансмиттерного баланса, нейротрофические препараты) и психотерапевтический (включает поведенческую психотерапию, работу над личностью и др.). Среди препаратов для фармакотерапии СДВГ часто используют ноотропные препараты (луцетам, пирацетам, фенотропил, гингко билоба, циннаризин) и нейротрофики (церебролизин, глицин [12]) которые характеризуются наименьшими нежелательными эффектами. В последнее время отчетливо вырисовывается концепция нутрициологической поддержки при СДВГ. Использование таких микронутриентов как омега-3 полиненасыщенные жирные кислоты (особенно в виде ДГК), йода, цинка, магния, витаминов группы В, лецитина имеет в своей основе фундаментальные механизмы воздействия этих нутриентов на биохимию мозга [13].
В то же время, модуляторы нейротрансмиттерного баланса, несмотря на отчетливое психостимулирующее действие, характеризуются значительными побочными эффектами. Например, метилфенидат, (близок по своим эффектам к амфетамину, но оказывает менее сильное возбуждающее действие) вызывает раннюю остановку роста. Кроме того, этот психостимулятор вызывает привыкание и даже может обладать фармакологическим действием, схожим с воздействием кокаина [14]. Вследствие этих и многих других нежелательных эффектов, «метилфенидат» был изъят из оборота лекарств в России.
Использование других синтетических препаратов, таких как ингибиторы пресинаптических переносчиков норадреналина, может приводить к быстрому и эффективному ослаблению симптоматики СДВГ. Однако, компании-производители, соблюдающие этический кодекс, открыто предупреждают, что при приеме этих препаратов у 1-10% пациентов наблюдаются многочисленные побочные эффекты: от раздражительности и колебаний настроения до панических атак, гипомании и развития суицидальных мыслей. Независимые компании, анализирующие
Во многом, низкая эффективность и безопасность широко используемых форм фармакотерапии СДВГ обусловлена фрагментарным пониманием этиологии данного заболевания. В настоящее время, педиатры и неврологи начинают учитывать роль элементного гомеостаза в патофизиологии СДВГ. Например, как известно, клинические признаки отравления свинцом у детей весьма схожи с проявлениями СДВГ. Загрязнение внешней среды свинцом, алюминием, наряду с нарушениями натрий-магниевого и фосфорно-магниевого баланса, могут способствовать увеличению риска развития СДВГ у детей. В настоящей статье последовательно рассматриваются этиология и результаты клинических исследований макро- и микроэлементов у детей с СДВГ. Особое внимание уделяется необходимости компенсации магниевого дефицита органическими препаратами магния.
Диагностика СДВГ
Типично, СДВГ проявляется импульсивностью, трудностью сосредоточения, быстрой истощаемостью внимания, избеганием задач, требующих умственных усилий, неумением организовать работу, забывчивостью. Гиперактивность часто не имеет определенной цели и не зависит от ситуации, проявляясь в непоседливости, частой смене места, бесцельном перемещении [3]. Импульсивность выражается в том, что ребенок часто действует, не подумав: выкрикивает ответ, не дослушав вопроса, без разрешения встает со своего места; перебивает других, бывает не в состоянии ждать своей очереди в играх и во время занятий. Дети с СДВГ мало читают, предпочитают смотреть телевизор и играть в агрессивные компъютерные игры. Ослабленный кортикальный контроль у этих детей появляется неопрятностью в одежде и рассенностью внимания: дети не застёгивают пуговицы, не зашнуровывают шнурки, постоянно пачкают одежду, часто теряют вещи, не могут сконцентрироваться. Импульсивность приводит к излишней активности в отстаивании собственных интересов, что нередко провоцирует конфликты и создает опасные ситуации.
Следует подчеркнуть, что в дошкольном и младшем школьном возрасте избыточная двигательная активность детей с СДВГ часто бесцельна и не соответствует требованиям конкретной обстановки. Наряду с гиперактивностью, в двигательной сфере у детей с СДВГ обычно обнаруживаются нарушения координации движений и тонкой моторики. Трудности, связанные с удерживанием равновесия и недостаточностью зрительно-пространственной координации, служат причинами моторной неловкости и повышенного риска травматизма [5, 15].
Поведение многих детей с СДВГ носит отчетливый деструктивный характер. Сверстники избегают детей с СДВГ, которые постоянно инициируют конфликты, нарушают правила детских игр, разрушают созданное другими детьми, портят общественное имущество. Речь детей с СДВГ обеднена, такие дети склонны к раннему использованию ненормативной лексики. Импульсивность и низкий самоконтроль у таких детей затрудняет оценить и логически предположить последствия своих действий: «игры» с огнеопасными и взрывчатыми веществами приводят к «неожиданному» ожогу и пожару; драка за собственный интерес приводит к тяжелым увечьям; вождение велосипеда, мотоцикла, мотороллера происходит без соблюдения правил дорожного движения и приводит к дорожно-транспортным происшествиям. Дети с СДВГ легко поддаются гипнозу и т.н. «нейролингвистическому программированию» [16], они гораздо чаще попадают под влияние отрицательных лидеров и, как следствие, вовлекаются в преступные и террористические сообщества.
Для постановки диагноза синдром дефицита внимания с гиперактивностью (СДВГ), соответствующего коду F90 по классификации МКБ-10, используются диагностические критерии психических расстройств общеизвестного руководства DSM-IV, разработанного Американской психиатрической ассоциаци в 1994 (Табл. 1). Согласно этим критериям, для постановки диагноза СДВГ необходимо выявление симптоматики невнимательности, гиперактивности и импульсивности строго при наличии достаточного количества симптомов, приведенных в соответствующих таблицах DSM-IV. Так, у больного ребенка для диагностирования признака "дефицит внимания" необходимо наличие шести или более из симптомов невнимательности, которые сохранялись на протяжении минимум 6 месяцев и выражены настолько, что свидетельствуют о недостаточной адаптации и несоответствии нормальным возрастным характеристикам нервно-психического развития.
Таблица 1.
Симптоматика невнимательности у детей, как диагностического критерия психических расстройств DSM-IV для СДВГ [1994]
| № | Признак – «Внимание» |
| 1 | Часто неспособен удерживать внимание на деталях; из-за небрежности и легкомыслия допускает ошибки в школьных заданиях, в выполняемой работе и других видах деятельности. |
| 2 | Обычно с трудом сохраняет внимание при выполнении заданий и во время игр. |
| 3 | Часто создается впечатление, что ребенок не слушает обращенную к нему речь. |
| 4 | Часто оказывается не в состоянии придерживаться предлагаемых инструкций и справиться до конца с уроками, домашней работой и обязанностями на рабочем месте (что никак не связано с негативным или вызывающим поведением и неспособностью понять задание). |
| 5 | Часто испытывает сложности в организации самостоятельного выполнения заданий и других видов деятельности. |
| 6 | Обычно избегает или выражает недовольство и сопротивляется вовлечению в выполнение заданий, требующих длительного сохранения умственного напряжения (например, школьных или домашних заданий). |
| 7 | Часто теряет вещи, необходимые в школе и дома (например, игрушки, книги, школьные принадлежности и рабочие инструменты). |
| 8 | Легко отвлекается на посторонние стимулы. |
| 9 | Часто проявляет забывчивость в повседневных ситуациях. |
| Итого (сумма признаков) |
| № | Признак - "Гиперактивность" |
| 1 | Часто наблюдаются беспокойные движения в кистях и стопах; сидя на стуле, крутится и вертится. |
| 2 | Часто встает с места в классе во время урока и в других ситуациях, когда нужно оставаться на месте. |
| 3 | Часто проявляет бесцельную двигательную активность: бегает, вертится, пытается куда-то залезть, причем в ситуациях, когда это неприемлемо. |
| 4 | Обычно не может тихо, спокойно играть и чем-то заниматься на досуге. |
| 5 | Часто находится в постоянном движении, ведет себя так, «как будто к нему прикрепили мотор». |
| 6 | Часто болтлив. |
| № | Признак - "Импульсивность" |
| 1 | Часто отвечает на вопросы, не задумываясь и не выслушав их до конца. |
| 2 | В различных ситуациях обычно с трудом дожидается своей очереди. |
| 3 | Часто мешает другим, пристает к окружающим (вмешивается в беседы или игры). |
Этиология СДВГ
В настоящее время выделяют многие факторы, увеличивающих риск СДВГ. Этиология СДВГ у конкретного пациента включает определенную комбинацию этих факторов, таких как перинатальная и постнатальная патология, психосоциальные факторы (негативное окружение ребенка в школе и дома, алкоголизм, курение, наркомания у родителей), варианты генов, экологические и биохимические факторы, питание и экология.
Перинатальная патология. СДВГ — один из вариантов минимальных мозговых дисфункций (ММД), являющихся последствиями ранних локальных повреждений головного мозга [3, 17]. СДВГ относится к наиболее легким исходам перинатальной энцефалопатии, четко ассоциированным с перинатальной гипоксией и формирующимся в перинатальный период ([5, 11, 18-20]). Доля СДВГ среди нозологий, являющихся последствием легких перинатальных поражений нервной системы, достигает 60% [21]. В результате перенесенной внутриутробной инфекции, у плода происходит нарушение функционирования ГЭБ. В период родов незрелый мозг плода, находящийся в состоянии гипоксии-ишемии, адаптационно несостоятелен, что может приводить к локальным поражениям мозга и предрасполагать к СДВГ. Гестозы при беременности, которые часто приводят к ишемии головного мозга плода, часто сопровождаются глубоким дефицитом магния [21].
Известно, что у детей с СДВГ наблюдаются нейроанатомические особенности строения мозга. Современные теории в качестве области анатомического дефекта при ММД рассматривают лобную долю и прежде всего орбифронтальную кору, через которую осуществляется регуляция функционального состояния коры. Размеры лобных долей правого полушария у детей с СДВГ по данным магнитно-резонансной томографии достоверно меньше, чем у здоровых сверстников [22]. Известно, что правое полушарие доминирует в процессах, обеспечивающих внимание.
Генетика. Генетические ассоциативные исследования показывают, что риск СДВГ может увеличиваться при наличии полиморфизмов в генах транспорта и метаболизма катехоламинов: альфа-2A адренергических рецепторов, дофамин транспортера, дофаминовых рецепторов D2/D3/D4 [23], дофамина бета-гидроксилазы моноаминоксидазы, катехоламин-метил-трансферазы, транспортера серотонина, 5-гидрокситриптамин 2А рецепторов (5-НТ2А), 5 - гидрокситриптамин 1B рецепторов [24] гидроксилазы дофамина бета [25] и др. Широкий спектр генов показывает, что СДВГ должно рассматриваться как результат сложного взаимодействия между генетическими и экологическими факторами.
Для того, чтобы извлечь полезную информацию из имеющихся генетических ассоциативных исследований по СДВГ, требуется проведение полноценного систематического анализа генетических полиморфизмов и сходных моногенных заболеваний с использованием новейших методов мета— и орто–анализа [26, 27]. Результаты такого анализа, проводимого в настоящее время кафедрой, позволят получить более полную картину этиологии заболевания, указать на перспективные подходы к фармакотерапии (в т.ч. препаратами магния) и на обширные возможности персонализированного ведения пациентов.
Экологические и биохимические факторы. Исследования показали, что курение и употребление алкоголя матерью во время беременности увеличивает риск СДВГ у потомства [28]. Дети дошкольного возраста, подвергшиеся воздействию высоких уровней свинца (краски, старые водопроводные трубы, курение родителей, сверстников и т.д.), что также соответствует повышенному риску СДВГ [29]. Здесь следует отметить, что магний является природным антагонистом свинца, алюминия, кадмия и способствует быстрой элиминации из организма этих и других нейротоксичных микроэлементов.
Судя по публикациям, у большинства западных исследователей установилось мнение, что именно нарушения дофамина являются «важнейшей причиной» СДВГ. Столь упрощенный взгляд на этиологию СДВГ напоминает другую ситуацию из области неврологии – когда при ишемии головного мозга только глутамат считают «причиной всех бед». Односторонняя концепция «эксайтотоксичности» в настоящее время пересматривается, что во многом обусловлено новыми данными о нейротрофных эффектах глутамата [30] и многочисленными неудачами клинических испытаний практически всех синтезированных ингибиторов НМДА-рецепторов [31]. Поэтому, требуется взвешенный и многосторонний подход к анализу биохимических причин СДВГ на основе проведения систематического анализа биохимических маркеров связанных с СДВГ. Результаты такого анализа позволят получить наиболее полную, к настоящему времени, картину этиологии СДВГ, описать молекулярные механизмы и дать основу для рациональной и высокоэффективной терапии данного заболевания.
Пищевые добавки. Недавнее английское исследование указывает на отчетливую связь между гиперактивностью у детей и потреблением некоторых пищевых добавок, искусственных красителей и консервантов. В Саутгемптонском исследовании детей 3..4 и 8..9 лет была установлена четкая корреляция между определенными пищевыми добавками и гиперактивностью [32]. Это особенно актуально для детей, которым нутрициально неграмотные родители позволяют есть пересоленные или искусственно окрашенные пищевые продукты, содержащие большое количество этих добавок.
Значительное повышение риска гиперактивного поведения у детей было установлено для консерванта бензоата натрия и искусственных пищевых красителей «закат желтый» FCF (E110), «хинолин желтый» (E104), «кармоизин» (E122), «красный очаровательный» (E129), «тартразин» (E102) и «понсо 4R» (E124). Следует отметить, что даже консервативное английское правительство в лице агентства по пищевым стандартам, после опубликования статьи [32] предложило производителям продуктов питания Великобритании добровольно отказаться от использования большинства искусственных пищевых красителей к концу 2009 года. После такого рода информации британского правительства, Европейская комиссия по питанию постановила, что любые пищевые продукты, содержащие эти красители, должны иметь предупредительные надписи на упаковке к 2010 году. В США, стране производящей подавляющее большинство таких противоестественных продуктов и характеризующейся наиболее высоким уровнем детей с СДВГ, мало что было сделано по пресечению коррупции в пищевой промышленности, которая по-прежнему производит огромные количества «пищевых» продуктов с названными выше добавками.
Нарушения иммунитета. У 120 детей 3..8 лет с СДВГ наблюдались отклонения и в иммунном статусе [33] – они чаще других болеют респираторными заболеваниями. Основными отличительными чертами часто болеющих детей были снижение содержания Т- и В-лимфоцитов, повышение CD16+ EK и активация нейтрофилов, что соответствовало ухудшению показателей иммунного статуса у обследованных детей.
Сосудистая патология. Гиперактивность у детей часто связана с церебральной ангиодистонией (ЦА) – группой сосудистых заболеваний, обусловленных нарушением нервной регуляции и вазомоторными расстройствами. В исследовании 200 детей с ЦА, у 55 детей (27%) с церебральной ангиодистонией отмечался синдром дефицита внимания с гиперактивностью [34]. Следует отметить, что самым распространенным патогенезом ЦА является гиперконстрикторный механизм, в основе которого лежит нарушение вегетативного регулирования вследствие дисбаланса адренергической регуляции [34]. Дефицит магния ухудшает передачу сигнала от адренергических рецепторов и ослабляет деградацию катехоламинов, тем самым способствуя усилению гиперконстрикторных реакций [35].
Клинические исследования микронутриентного статуса детей с СДВГ
В мировой практике, изучение микронутриентного статуса у детей с СДВГ и использование микронутриентной коррекции является практически неразработанным направлением исследований. Даже в недавнем обзоре, опубликованном в одном из западных журналов в 2009 году, высказываются всего лишь робкие предположения о «возможной пользе использования витаминов и биоэлементов» для коррекции СДВГ [36]. Данная ситуация обусловлена, вероятно, чрезвычайно высокой популярностью синтетических химических препаратов, агрессивно пропагандируемых некоторыми западными фармацевтическими компаниями с низкими этическими стандартами.
Следует отметить, что российским исследователям во многом принадлежит пальма первенства по систематическому исследованию нарушений макро- и микроэлементного статуса у детей с СДВГ [13, 17, 33, 34, 35, 37, 39, 41, 42, 40, 44, 45, 47-49, ]. Особое внимание следует уделить работам, проводимым в Ивановской Государственной Медицинской Академии начиная с 90х годов прошлого века. Исследования, проводимые на кафедрах клинической фармакологии, неврологии и педиатрии ИвГМА, включили более 700 детей (Иваново и Ивановская область, Владимир и Владимирская область, Нижний Новгород и Нижегородская область, г. Москва) и показали значительные отклонения в содержании целого ряда биоэлементов и витаминов. Определение спектра микронутриентов позволило применить высокоэффективный персонализированный подход к микронутриентной коррекции у детей с СДВГ. Направленная микронутриентная коррекция у детей с СДВГ приводила к значительному улучшению состояния педиатрических пациентов.
В соответствии с рекомендациями Заваденко Н.Н. (2003) [5], у всех детей был проведен дифференциальный диагноз СДВГ с индивидуальными особенностями характера (не выходящими за границы возрастной нормы); тревожными расстройствами; психосоматическими расстройствами (остаточные последствия ЧМТ, нейроинфекции, интоксикации, астенический синдром), расстройствами развития школьных навыков (дислексией, дисграфией, дискалькулией), психическими расстройствами такими, как эпилепсия (включая побочные эффекты противоэпилептической терапии, приводящей к дефицитам пиридоксина и магния); умственной отсталостью, аутизмом и шизофренией.
В цитируемых ниже работах Андреева А.В., Бурцева Е.М., Гришиной Т.Р. Громовой О.А, Егоровой Е.Ю., Калачевой А.Г., Лимановой О.А., Новиковой Е.А., Сатариной Т.А., Федотовой Л.Э., с соавторами элементный статус изучался у детей 3-8 лет с диагнозом ММД, у детей 8-12 лет и подростков старше 12 лет которым был поставлен диагноз СДВГ. Содержание 68 элементов оценивалось в различных биосубстратах пациентов: волосах, ногтях и в цельной крови. Элементный анализ волос достоверно отражает дефицит в организме таких макро- и микроэлементов, как Mg, Zn, P, Ca, Se, Zn, As, B, Cu, Fe и фиксирует избыток Pb, As, Al, Cd, Sr, Ca, Mg, P, Se, B, Cu, Fe. Нормальный диапазон концентраций элементов в волосах определялся на основе проведения репрезентативных выборок (не менее 2000 анализов в каждой возрастной группе) по данным Скального А.В. [38].
Анализ элементного состава волос у обследованных детей с СДВГ дал информацию, представляющую значительный научный и практический интерес. Так, у всех обследованных детей были выявлены отклонения от нормы в элементных составах волос, ногтей, крови. Элементный профиль СДВГ имеет ряд характерных особенностей (Рис. 1).
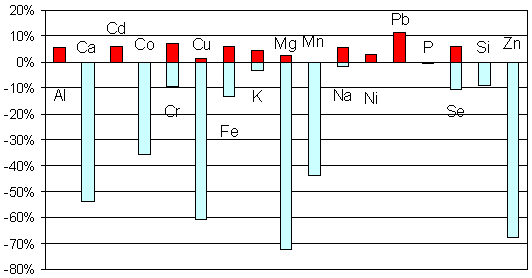
Рис. 1. Дисбаланс макро- и микроэлементов среди детей с СДВГ (содержание в волосах) в подгруппе из 258 детей [17]. Столбики направленные вверх обозначают %пациентов имевших концентрации элементов превышающие верхнюю границу нормы данного элемента. Столбики направленные вниз соответствуют содержанию элементов за нижней границы нормы.
В исследованных биосубстратах детей с СДВГ не выявлено ни одного случая монодефицита или моноизбытка любого из изучаемых элементов (Рис.). Установлено, что структура отклонений элементного спектра у детей с СДВГ имеет характерные особенности. Большая часть отклонений приходится на долю дефицитов (до 70% случаев), избыточное накопление элементов в волосах наблюдалось в 11% случаев [17].
Наиболее ярким фактом, имеющим колоссальное фундаментальное и практическое значение, являлось установление широчайшего преобладание дефицита магния у детей с СДВГ. Дефицит магния являлся наиболее ярко выраженным среди дефицитов прочих элементов и наблюдался более чем у 70% пациентов. Выявленные по анализам волос дефициты элементов у детей с СДВГ образуют следующий ряд: Mg (72%) > Zn (67%) > Cu (60%) > Ca (53%) > Mn (43%) > Co(35%) > Fe (13%) > Se (10%) = Si (10%)> Cr (9%). Очевидно, что ядро дефицитов составляют 6 металлов Mg, Zn, Cu, Ca, Mn и Co (р<0,0001). При этом, преобладание дефицитов магния и цинка у детей с СДВГ отмечалось во всех исследованных регионах (Рис. 2).
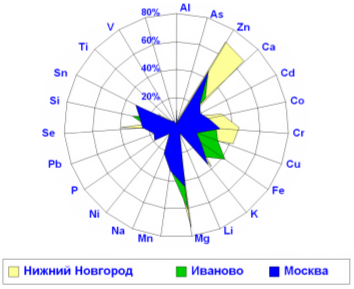
Рис. 2. Дефицит магния – один из наиболее глубоких элементных дефицитов у 750 детей с минимальной мозговой дисфункцией и СДВГ из различных регионов России.
Обращает на себя внимание тот факт, что избыток свинца всегда сочетался с пониженной концентрацией магния в волосах ([17, 18, 39-42]. Это объясняется, наиболее вероятно, способностью свинца вытеснять Mg из организма по принципу конкурентного антагонизма. Как известно, клинические признаки отравления свинцом у детей весьма схожи с проявлениями СДВГ. Загрязнение внешней среды свинцом, алюминием, наряду с нарушениями натрий-магниевого и фосфорно-магниевого баланса, могут способствовать увеличению риска развития СДВГ у детей [13]. Наши данные подтверждают результаты исследований более 1000 педиатрических пациентов в работах проф. J. Oleszkewicz [43] и исследователей Lech T. и Garlicka А. (2000) [18]. Характерным клиническим проявлением свинцовой интоксикации является выраженная гиперактивность, агрессивность, “неуправляемость” детей. Отметим, что дети с избытком свинца в волосах чаще других болеют простудными заболеваниями, которые отличались длительным течением и резистентностью к терапии ОРЗ (P<0.001, [17, 39, 41]).
Лидирующую позицию в структуре отклонений элементного статуса у детей с СДВГ занимает магний: содержание магния в волосах было за нижней границей нормы у 72% пациентов (Рис. 1, выше). При этом, более 65% пациентов с СДВГ имели уровни магния в 2 и более раз ниже нормы (Рис. 3). Пониженным уровням магния у большинства пациентов с СДВГ соотвествовала клиническая симптоматика, характерная для дефицита магния: дефицит внимания, моторный дефицит, проявления синдрома повышенной нервно-рефлекторной возбудимости (симптом Хвостека 2-3 степени, симптом Труссо и др.), церебральная ангиодистония (головные боли, головокружения, обморочные и липотимические состояния) [44, 45].
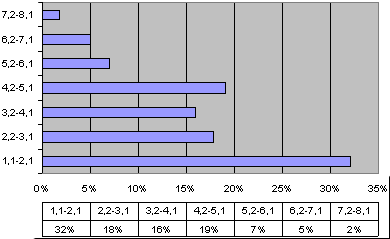
Рис. 3. Дефицит магния, распределение по глубине отклонений
Следует подчеркнуть, что и дефицит магния и СДВГ проявляются клинически схожей симптоматикой. Известно, что дефицит Mg приводит к таким неврологическим нарушениям как повышение активности глубоких сухожильных рефлексов, атаксия, тремор, дезориентация, провоцирует судорожные состояния, нистагм, парестезии [46]. Эти физиологические проявления дефицита магния соответствуют базисным компонентам СДВГ, а именно поведенческим расстройствам в виде импульсивности, неконтролируемого поведения во время стресса, дефицита внимания, и моторного дефицита проявляющегося в виде гиперактивности. Таким образом, дефицит Mg специфичен для синдрома дефицита внимания с гиперактивностью и может рассматриваться как характерная особенность нозологического элементного портрета у детей с СДВГ.
Более чем 30-летние исследования в области клинической и экспериментальной нутрициологии позволили нам создать структурированные опросники оценивающие в баллах обеспеченность витаминами и микроэлементами [47]. Разработанные нами структурированные опросники калибровались по содержанию микронутриентам в различных биосубстратах (плазма крови, моча) и показали высокие коэффиценты корреляции (r=0.7?0.9) между баллами по шкале обеспеченности витаминами и содержанием соответствующего витамина в крови и в моче. В исследовании 60 пациентов было установлено, что помимо дефицита магния и других элементов, дети с СДВГ страдали специфическим полигиповитаминозом, включающим дефициты витаминов В1, В6 (пиридоксина), С и фолатов [48].
Дефицит пиридоксина проявляется очень широким спектром клинических отклонений, от патологий кожи до пиридоксин-зависимых судорог [45]. Неврологическая компонента симптоматики дефицита пиридоксина имеет черты весьма схожие как с дефицитом магния, так и с СДВГ. Это не удивительно, так как и магний, и пиридоксин непосредственно участвуют в реализации биологических эффектов допамина [49] – нейротрансмиттера, часто ассоциируемого с этиологией СДВГ.
Следует отметить, что принимавшие участие в исследовании дети и их родители были опрошены на предмет питания. В питании детей с СДВГ наблюдался дефицит продуктов богатых витаминами группы В (В1, В6, фолаты) и магнием – свежая зелень, орехи, водоросли, нерафинированные крупы, хлеб грубого помола, рыбы. Крайне редко отмечалось употребление продуктов омега-3 полиненасыщенными жирными кислотами (жирные сорта рыбы, оливковое масло).
Наоборот, фактически все дети с СДВГ регулярно употребляли исскуственные продукты питания (англ. “junk food”, т.е. «мусорная еда»), содержащие значительные количества консервантов и синтетических пищевых красителей (чупа-чупсы, крашенные пастилки, торты и т.д.), пересоленные продукты длительного хранения (чипсы, сухарики, кальмары) и искуственные напитки типа лимонада с ароматизаторами и красителями. С точки зрения выбора исскуственных продуктов питания, детей с СДВГ можно разделить на 3 группы:
(1) 50% детей употребляли эти эрзац-продукты раз в неделю (выходные),
(2) 30% детей несколько раз в неделю настойчиво просили родителей о покупке таких продуктов,
(3) 20% детей каждодневно употребляли эти продукты, входящие в обязательный рацион семьи.
Было установлено, что во 2-ой и 3-ей группах клиническая симптоматика дефицита магния была более выражена, а содержание магния в волосах было более чем в 3 и более раз ниже нормы (P<0.05). Во 2-ой и 3-ей группах гораздо чаще отмечались такие общеизвестные симтомы дефицита магния как судороги, тики, симптом беспокойных ног, нарушения сна, бруксизм, вздрагивания во сне. Результаты позволяют предположить, что употребление продуктов с синтетическими пищевыми добавками (бензоат натрия и др.) приводят к интенсивным потерям магния организмом ребенка. Возрастание проявлений гиперактивности на фоне употребления искуственных продуктов соотвествует результатам упомянутого ранее Саутгемптонского исследования [32].
Роль магния и пиридоксина в терапии СДВГ
Повсеместно использующаяся в западных странах фармакотерапия СДВГ несовершенна и редко включает в свой спектр коррекцию имеющихся у детей с СДВГ нарушений нутриентного статуса и дисмикроэлементозов. В мировой медицинской литературе представлен большой опыт применения у больных с СДВГ препаратов из группы стимуляторов ЦНС (метилфенидат, метилфенидат-депо, меридил, риталин, центедрин, декстроамфетамин, пемолин) [3, 15, 50]. Психостимуляторы оказывают сложное действие на катехоламинергические системы мозга, увеличивая биологическую доступность катехоламинов (особенно допамина) на уровне синапсов путем стимуляции их выделения и торможения обратного захвата в пресинаптических окончаниях. Хотя отмечается достоверный регресс симптомов на фоне лечения препаратами этой группы, эффекты исчезают вскоре после окончания курса терапии [50]. То, что нейростимуляторы быстро вызывают привыкание и толерантность к препарату, обуславливает необходимость повышения дозировки для сохранения эффекта препарата. Психостимуляторы противопоказаны детям до 6 лет и характеризуются множеством побочных эффектов: вызывают бессонницу, снижение аппетита и массы тела, боли в животе, головную боль, раздражительность, плаксивость, излишнюю агрессивность, склонность к суициду и др.
Очевидно, что симптоматическая терапия СДВГ напоминает спешное тушение пожара. Патогенетическая терапия любых заболеваний всегда эффективней симптоматического лечения. Концепция патогенетической терапии основана на учении акад. И.П. Павлова - основателя отечественной научной школы клинической фармакологии. Патогенетическая терапия невозможна без детального изучения особенностей патофизиологии заболевания, неизбежно включающей нарушения обмена тех или иных метаболитов организма. В современной биомедицине это актуальнейшее направление исследований называется метаболомикой [26].
Существенной частью метаболомики является метаболомика биоэлементов и витаминов. Содержание макро- и микроэлементов в организме может быть определено неинвазивным методом (исследование вовлос) и с высокой степенью точности. Витаминный статус пациента может быть достоверно оценен с использование структурированных опросников. Приведенные ранее результаты исследований элементного статуса у детей с СДВГ однозначно указывают на характерные нарушения элементного баланса, причем дефицит магния наблюдался у подавляющего большинства (70%) пациентов. Так как имеющиеся данные фундаментальных исследований указывают на непреходящую роль магния и витаминов группы В для баланса нейротрансмиттеров, передачи нервного импульса и поддержания баланса других элементов [45], компенсация магниевого дефицита действительно может являться компонентом патогенетического лечения СДВГ. Это предположение, основанное на фундаментальных особенностях биохимии и молекулярной биологии магния, подтверждается результатами клинических испытаний органических солей магния у пациентов с СДВГ.
Например, результаты исследования Starobrat-Hermelin В. (1997) [51] показали, что длительная терапия (6 месяцев) магнием лактатом и/или аспартатом приводила к уменьшению симптоматики СДВГ и повышала концентрацию элемента в волосах. Контрольная группа получала стандартную терапию (нейролептики, антидепрессанты). Было установлено, что эффективность терапии магнием значительно превосходила терапию нейролептиками.
В исследовании Ноговициной О.Р. и Левитиной Е.В. (2006) [37] был показан эффект Магне В6 у 122 детей с СДВГ. Содержание магния в эритроцитах было гораздо ниже у детей с СДВГ (1.55±0.06 ммоль/л), чем у здоровых (2.17±0.04 ммоль/л, Р<0.05). Содержание магния в плазме показало еще более выраженный дефицит магния у пациентов с СДВГ (0.55±0.04 ммоль/л), тогда как у здоровых детей уровень магния составил 0.82±0.08 ммоль/л. Терапия МагнеВ6 в течение 30 днейпривела к улучшению поведения, двигательной активности и внимания, уменьшила уровень беспокойства и агрессии, вызвала положительные сдвиги в биохимических показателях крови в виде нормализации магния эритроцитов, магния плазмы крови; повышалась активность Mg2+-АТФазы.
Клинические исследования, проводимые нами на кафедре фармакологии ИвГМА, показали высокую эффективность препаратов органического магния при ведении пациентов с СДВГ. Препаратом выбора для коррекции магниевого дефицита у детей с СДВГ был элементсодержащий препарат Магне В6 (пр-во Санофи-Авентис, Франция), содержащий Mg в терапевтической дозе (470 мг лактата магния) и пиридоксин (5 мг). Пиридоксин необходим для синтеза кофакторов ферментов дофаминового метаболизма и также способствует эффективному транспорту магния внутрь клетки. Коррекция уровня магния препаратом Магне В6 проводилась в соответствии с возрастом. Дети 3-6 лет получали раствор Магне В6 в ампульной форме из расчета 15 мг солей магния/кг/сут, курс длительностью 4 месяца. Дети с 6-12 лет и подростки 12-18 лет получали Магне В6 в таблетированной форме также в дозе 15 мг/кг/сут в течение 4 месяцев.
Эффективность лечения оценивалась по клиническим и лабораторным показателям. Магне В6 хорошо переносился всеми детьми, и мы не отметили аллергических реакций на применение препарата. 3-х детей исключили из исследования, т.к. они не закончили курс лечения по причине острых респираторных заболеваний. В результате лечения Магне В6 у детей получавших в течение 2-х месяцев корректирующую терапию магнием отмечалась положительная клиническая динамика: уменьшение двигательной гиперреактивности и эмоциональной лабильности. Параллельно с клиническим улучшением, у детей с СДВГ после окончания курса Магне В6 в значительной мере нормализовался уровень магния в крови и в волосах. Прием препарата Магне В6 под контролем ультразвуковой транскраниальной допплерографии приводил к достоверному уменьшению выраженности гиперконстрикторных реакций и оптимизации цереброваскулярной реактивности у детей с СДВГ. (необходимо добавить статистику достоверности результатов)
В исследовании 56 детей с СДВГ и дефицитом магния [17] проводился курс лечения препаратом Магне В6 в течение 2-х месяцев. После проведения курса коррекции магниевого гомеостаза с помощью препарата Магне В6 головные боли сохранялись у 30 (56%) детей - до лечения у 49 (87%), головокружения у 16 (30%) - до лечения у 30 (53%), обморочные состояния у 8 (15%) – исходно у 16 (28%) детей с СДВГ.
Анкетирование родителей детей прошедших курс терапии Магне В6 свидетельствует об улучшении характеристик поведения детей с СДВГ к моменту окончания лечения. Лечение Магне В6 способствовало достоверному улучшению как общей суммы баллов, так и по отдельным шкалам: “импульсивность-гиперактивность” (P<0.02), “тревожность” (P<0.05), “проблемы поведения”, “психосоматические жалобы” (P<0.03).
В исследовании 96 детей с СДВГ 6-12 лет [39] при анализе результатов корректурной пробы в модификации Bourdon-Vos, 2-месячный курс Магне В6 приводил к достоверному снижению суммарного числа допущенных ошибок (день «0» 17.8±4.2, день «60» 10±2.4), особенно в 3-ей части задания (день «0» 7.3±2.2, день «60» 1.6±0.4, P<0.005). В том же исследовании ставилась клинико-фармакологическая проба (КФП) с препаратом Магне-В6 под контролем ультразвуковой транскраниальной допплерографии до и через 1 час после применения препарата в дозе 10 мг/кг веса. Исходно, у детей с глубоким дефицитом магния (более 4,2-х кратного снижения от нормы) отмечалось смещение порогов сосудистой ауторегуляции в сторону констрикторных реакций. Коэффициент реактивности на гипервентиляцию (Кро2) увеличивался (р<0.05), а коэффициент реактивности на пробу с апноэ уменьшался (р<0,05). КФП с препаратом Магне-В6 приводила к позитивной модификации цереброваскулярной реактивности, что указывает на вазоактивное действие Магне В6 у детей с СДВГ с гиперконтрикторным типом сосудистого реагирования. Результаты клинического обследования находились в полном согласии с результатами КФП: после проведения курса коррекции магниевого гомеостаза головные боли снизились с 70 до 30%, головокружения с 30 до 16% , обморочные состояния с 16 до 8% [39].
Заключение
Синдром дефицита внимания с гиперактивность является насущной проблемой российского здравоохранения. Патогенетические подходы к терапии СДВГ только начинают обозначаться. Результаты инновационных клинических исследований, проводимых по всему миру, показывают необходимость комплексного многоуровневого подхода к терапии данного заболевания, который включает как физиологические, нутрициальные так и психологические аспекты терапии.
Дети с СДВГ характеризуются серъезными нарушениями диеты в сторону обеднения эссенциальными микронутриентами и «обогащения» синтетическими пищевыми добавками.Нутрициологический подход к патогенетической терапии СДВГ (Рис.) крайней актуален. Без коррекции нутрициального статуса терапия симпатомиметикам, транквилизаторами, ноотропами и даже нейропротекторами может быть малоэффективна вследствие деформирования метаболизма различных биохимических каскадов мозга.
Исследования микронутриентного статуса детей с СДВГ указывают на специфические нарушения баланса микронутриентов. Установлен дисбаланс между Mg, Zn, Cu, Са, Mn и элементами с выраженными нейротоксичными свойствами (Pb, Cd, Al), причем дефицит магния лидирует и встречается более чем у 70% пациентов с СДВГ. Структурированные опросники витаминного дефицита показали существование дефицитов витаминов группы В (В1, В6, фолаты) и витамина С у детей с СДВГ. Применение препарата Магне В6 в ампульной и таблетированной формах в терапии СДВГ показало нормализацию течения заболевания и значительное улучшения состояния пациентов, в т.ч. элементного статуса. Необходимым шагом дальнейших исследований являются систематические анализы этиологии СДВГ (прежде всего, генетических и биохимических факторов) и разработка на основании результатов этих анализов персонализированной нутрициологической коррекции СДВГ.
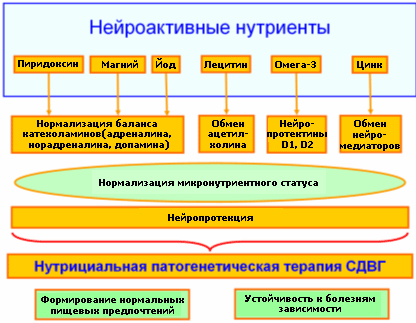
Рис. Нутрициальная концепция патогенетической терапии детей с СДВГ
Литература
1. Rader R, McCauley L, Callen EC (2009). "Current strategies in the diagnosis and treatment of childhood attention-deficit/hyperactivity disorder". Am Fam Physician 79 (8): 657–65.
2. Van Cleave J, Leslie LK (August 2008). "Approaching ADHD as a chronic condition: implications for long-term adherence". Journal of Psychosocial Nursing and Mental Health Services 46 (8): 28–37.
3. Заваденко Н.Н. Неврологические основы дефицита внимания и гиперактивности у детей. Автореф. Дис. на соискание уч. степ. докт. мед. наук. Москва, 1999, 34 с.
4. Журба Л.Т., Мастюкова Е.М. Минимальная мозговая дисфункция у детей. //Обзорная информация ВИНИМИ. 1980, 92c.
5. Заваденко Н.Н., Суворинова Н.Ю., Румянцева М.В. Гиперактивность с дефицитом внимания: факторы риска, возрастная динамика, особенности диагностики// Дефектология. 2003, №6, c 6-11.
6. Sharps MJ, Price-Sharps JL, Day SS, et al. Cognitive predisposition to substance abuse in adult attention deficit hyperactivity disorder. Addict Behav; 2005 Feb; 30(2):355-9.
7. Molina BS, Hinshaw SP, Swanson JM, et al. The MTA at 8 years: prospective follow-up of children treated for combined-type ADHD in a multisite study. J Am Acad Child Adolesc Psychiatry; 2009 May ; 48(5):484-500.
8. Polanczyk G, de Lima MS, Horta BL, Biederman J, Rohde LA. The worldwide prevalence of ADHD: a systematic review and metaregression analysis. Am J Psychiatry; 2007 Jun; 164(6):942-8.
9. Smucker WD, Hedayat M. Evaluation and treatment of ADHD. Am Fam Physician; 2001 Sep 1 ; 64(5):817-29.
10. College Degree Nearly Doubles Annual Earnings, Census Bureau Reports U.S. Census Bureau March 28, 2005.
11.Халецкая О.В., Минимальная мозговая дисфункция: многоуровневая диагностика и комплексная нейрореабилитация, автореф. дисс... докт мед. наук., Иваново, 1999, 43 с.
12. PA-ADHD trial group. EPA supplementation improves teacher-rated behaviour and oppositional symptoms in children with ADHD. Acta Paediatr; 2010 May 19
13. Громова О.А., Кудрин А.В. Нейрохимия макро- и микроэлементов, Москва, Алев-В, 2001, 300 с.
14. Kim Y, Teylan MA, Baron M, et al. Methylphenidate-induced dendritic spine formation and DeltaFosB expression in nucleus accumbens.Proc Natl Acad Sci U S A. 2009 Feb 24;106(8):2915-20.
15. Conners C. Hyperkinetic children. Cop. - 1986. - 160 p.
16. Grinder J., Bandler R. Patterns of Hypnotic Techniques of Milton H Erickson (1976), ISBN 091699001X.
17. Громова О.А. Элементный статус и способы его восстановительной коррекции у детей с различными исходами перинатальной энцефалопатии. Автореф. дисс. соиск. д.м.н., Иваново, 2001. 47 С.
18. Lech T., Garlicka А. Value of magnesium and calcium in serum and hair of children and adolescents with neurologic diseases // Przegl Lek; 2000 57(7-8):378-381.
19. Пальчик А.Б., Шабалов Н.П., Гипоксически-ишемическая энцефалопатия новорожденных, СПб: изд. "Питер", 2000, 224 с.
20. Millichap JG. Etiologic classification of ADHD. Pediatrics, 2008, 121(2):e358-65
21. Грачева О.Н.. Дисплазия соединительных тканей – профилактика гестационных осложнений. Вопросы гинекологии, акушерства и перинатологии, т. 9, №3, 2010, с.3-7.
22. Mullins P.G. et all. Chronic alcohol exposure decreases brain intracellular free magnesium concentration in rats //Neuroreport. - 1995.- Vol. 21.№ 612. - Р. 1633-1636.
23. Volkow ND; Wang GJ; Kollins SH; et al. "Evaluating Dopamine Reward Pathway in ADHD". JAMA 2009, 302 (10): P. 1084–1091.
24. Roman T., Rohde L.A., Hutz MH. 2004. "Polymorphisms of the dopamine transporter gene: influence on response to methylphenidate in attention deficit-hyperactivity disorder." American Journal of Pharmacogenomics, 2004, 4(2):P. 83–92
25. Smith K.M., Daly M., Fischer M., et al. "Association of the dopamine beta hydroxylase gene with attention deficit hyperactivity disorder: genetic analysis of the Milwaukee longitudinal study." Am J Med Genet B Neuropsychiatr Genet. 2003 May 15;119 (1): P.77–85.
26. Torshin I.Yu. Bioinformatics in the post-genomic era: physiology and medicine. Nova Biomedical, ISBN 9781600 217524, 2007, 300pp.
27. Torshin I.Yu. Bioinformatics in the post-genomic era: sensing the change from molecular genetics to personalized medicine. Nova Biomedical Books, NY, USA, 2009, In “Bioinformatics in the Post-Genomic Era” series, ISBN: 978-1-60692-217-0.
28. Linnet K.M., Dalsgaard S., Obel C. Maternal lifestyle factors in pregnancy risk of attention-deficit/hyperactivity disorder and associated behaviors: review of the current evidence. American Journal of Psychiatry, 2003 Jun; 160(6):1028-1040
29. Braun J., Kahn R.S., Froehlich T., Auinger P., Lanphear B.P. Exposures to environmental toxicants and attention-deficit/hyperactivity disorder in U.S. children. Environmental Health Perspectives, 2006 Dec; 114(12):1904-1909.
30. Suzuki M. Glutamate enhances proliferation and neurogenesis in human neural progenitor cell cultures derived from the fetal cortex. Eur J Neurosci. 2006;24:645–653.
31. Торшин И.Ю., Громова О.А. Мультимодальный эффект церебролизина против воинствующего редукционизма. Казан. Журн. Неврологии им. Бехтерева, № 8, 2008.
32. McCann D., Barrett A., Cooper A. Food additives and hyperactive behaviour in 3-year-old and 8/9-year-old children in the community: a randomised, double-blinded, placebo-controlled trial. Lancet, 2007 Nov 3; 370 (9598):1560-1567.
33. Новикова Е.А. Взаимосвязь иммунного и элементного статуса у детей с минимальной мозговой дисфункцией. Автореф. дисс. соиск. к.м.н., Иваново, 2002. 26 С.
34. Андреев А.В. Сосудистые головные боли у детей (клинико-допплерографическое исследование). Автореф. дисс… докт. мед. наук., 2000, СПб., 47 с.
35. Андреев А.В., Громова О.А., Федотова Л.Э., Бурцев Е.М. Влияние препарата Магне В6 на цереброваскулярную реактивность у детей с синдромом дефицита внимания в зависимости от содержания магния в организме, Клин. фармакология и терапия, 2000. №5, С. 31-34.
36. Rucklidge J.J., Johnstone J., Kaplan B.J. Nutrient supplementation approaches in the treatment of ADHD. Expert Rev Neurother, 2009, 9(4): 461-76.
37. Ноговицина О.Р., Левитина Е.В. Неврологический аспект клиники, патофизиологии и коррекции нарушений при синдроме дефицита внимания. Журнал неврологии и психиатрии им. С.С. Корсакова, №2, 2006, С. 65-67
38. Скальный А.В., Эколого-физиологическое обоснование эффективности использования макро- и микроэлементов при нарушениях гемостаза у обследуемых из различных климато-географических регионов, Автореф. дисс... д. м.н., Москва, 2000, 46 с.
39.Федотова Л.Э. Дефицит магния у детей с минимальной мозговой дисфункцией и его коррекция препаратом Магне В6, Автореф. дисс. соиск. к.м.н., Иваново, 2003, 23 с.
40. Гришина Т.Р. Элементный статус подростков 15-18 лет с артериальной гипертонией и способы коррекции его нарушений, Автореф. дисс. соис. д.м.н, Иваново, 2007, 62 с.
41. Лиманова О.А. Комплексная оценка элементного состояния у детей с перинатальными поражениями ЦНС. Автореф. дисс. к.м.н, Иваново, 2004, 19 с.
42. Калачева А.Г. Индикаторы магниевого дефицита: экспериментально-клиническое исследование, Автореф. дисс. к.м.н., Иваново, 2010, 23 с.
43. Oleszkewicz J. Zaburzenia Koncentracji Nadpobudliwosc to uleczalne choroby cywilizacji, Warzawa, 1998. 56 p.
44. Громова О.А., Егорова Е.Ю., Торшин И.Ю., Федотова Л.Э., Юдина Н.В. Перспективы применения магния в педиатрии и детской неврологии, Журнал Педиатрии им. Г.Н. Сперанского, 2010, № 7, С. 9-14.
45. Torshin I.Yu., Gromova O.A. Magnesium and pyridoxine: fundamental studies and clinical practice. Nova Science, 2009, ISBN-10: 1-60741-704-9. 250pp.
46. Чекман И.С., Горчакова Н.А., Николай С.Л. Магний в медицине. Кишинев, 1992, 101с.
47. Сатарина Т.Е. Сопряженность нарушений микронутриентного статуса с уровнем стресса и их коррекция витаминно-минеральными комплексами, Автореф. дисс. к.м.н., Иваново, 2010, 23 с.
48. Громова О.А., Красных Л.М., Лиманова О.А., Шиляев Р.Р., Гришина Т.Р., Кутузова Н.А. Коррекция витаминного статуса при синдроме дефицита внимания с гиперактивностью, Вопросы Современной Педиатрии, 2003, №5, С. 25-29.
49. Громова О.А., Торшин И.Ю., Егорова Е.Ю. Молекулярные роли магния и пиридоксина в антиалкогольной защите организма, журн. Врач, 2010, № 7, С. 51-54.
50. Воронина Т.А, Середенин С.Б., Ноотропные препараты, достижения и новые проблемы, Экспериментальная и клиническая фармакология, 1998, том 61, №4, С. 3-9.
51. Starobrat-Hermelin B. The effect of deficiency of selected bioelements on hyperactivity in children with certain specified mental disorders //Ann-Acad-Med-Stetin. 1998; 44, P. 297–314.
