Уважаемый посетитель!
Эта информация для специалистов здравоохранения
Нажимая «ПРОДОЛЖИТЬ», Вы подтверждаете, что им являетесь
 pikfarma.ru
pikfarma.ru
Элькар® - метаболическое средство пациентов с хронической ишемией мозга и патологией сердца / постинфекционной астенией, далее...
Лечение постинфекционной астении и постковидного синдрома
Особенности применения в кардиологии препарата Элькар (для в/в и в/м введения, 100 мг/мл)
СтатьиРезюме клинических исследований
Снижение летальности у инфарктных больных
L-карнитин снижает на 39% риск летального исхода в первые 5 дней у пациентов с ОИМ при добавлении к стандартной терапии
Госпитальная летальность пациентов с ОИМ в России в среднем достигает 15,5% [1]. В исследовании ЛИС (Люберецкое исследование смертности больных, перенесших острый инфаркт миокарда, Россия) госпитальная смертность больных с ОИМ составила 15,2% [2].
Терапия, направленная на поддержание жизнеспособности ишемизированного миокарда, ограничение размера зоны инфаркта и замедление прогрессирования ремоделирования ЛЖ, не только способствует сохранению глобальной сократимости ЛЖ, но и снижает смертность и частоту развития сердечной недостаточности у больных с ОИМ. В настоящее время эти терапевтические цели достигаются за счет тромболизиса либо первичной транслюминальной коронарной ангиопластики, а также блокады бета-адренорецепторов и ингибирования ангиотензин-превращающего фермента. Тем не менее, несмотря на успехи реваскуляризации и снижающей нагрузку на ЛЖ медикаментозной терапии, показатели смертности у больных с ОИМ остаются высокими [3].
Продолжается активный поиск дополнительных методов лечения, направленных на сохранение жизнеспособности миокарда, замедление прогрессирования дисфункции ЛЖ и улучшение выживаемости пациентов с ОИМ. Метаболическая протекция ишемизированного миокарда способна уменьшать выраженность неблагоприятных эффектов ишемии и реперфузии, что обусловливает дополнительные клинические преимущества этого терапевтического подхода у пациентов с ОИМ. L-карнитин является природным соединением, которое играет существенную роль в энергообразовании клетки на митохондриальном уровне.
При высокой биодоступности L-карнитина стимулируется образование ацетилкарнитина, что приводит к нормализации энергетического метаболизма в сердце - снижается β-окисление ЖК и усиливается окисление глюкозы (предотвращается лактат-ацидоз), ослабляется индуцированное ишемией повышение концентрации длинноцепочечных жирных кислот и, тем самым, ограничивает их токсический эффект на структуры мембран. Было показано, что как в ишемизированном, так и в инфарцированном миокарде отмечается быстрое снижение запасов L-карнитина [4], и что назначение L-карнитина положительно влияет как на механические, так и на электрические свойства миокарда. Кроме того, в многоцентровом рандомизированном двойном слепом плацебо-контролируемом исследовании CEDIM было продемонстрировано, что назначение L-карнитина препятствует прогрессированию ремоделирования ЛЖ у пациентов с передним ОИМ. В течение года после развития ОИМ у участников исследования CEDIM наблюдалось достоверное уменьшение прогрессирования дилатации ЛЖ. Поэтому повторные курсы Элькара имеют место быть у таких пациентов.
Исследование CEDIM 2 (L-Carnitine Ecocardiografia Digitalizzata Infarto Miocardico) [5, 6].
Рандомизированное, двойное слепое, плацебо-контролируемое исследование по оценке влияния L-карнитина на смертность и развитие сердечной недостаточности у пациентов с ОИМ передней локализации:
- 153 кардиологических центра
- Пациенты с ОИМ передней локализации получали стандартную базисную терапию, n=2330
- L-карнитин назначали по 9 г в сутки в/в медленно в течение 5 дней от момента развития ОИМ, затем per os по 4 г в сутки последующие 6 месяцев
- Длительность 6 месяцев
В КИ CEDIM 2 показано, что добавление левокарнитина к проводимой терапии достоверно на 39% снижает риск ранней смертности (в течение 5 дней от момента развития ОИМ) у пациентов с ОИМ в период госпитализации
L-карнитин снижает летальность у пациентов с кардиогенным шоком до 22,2% при добавлении к стандартной терапии
Частота возникновения КШ при развитии ОКС составляет 4,6% [7]. КШ – клинический синдром, острая форма СН, в основе которой лежит критическое уменьшение сердечного выброса, а важнейшими симптомами являются снижение АД (САД ≤90 мм рт.ст.) и резкое ухудшение перфузии органов и тканей, проявляющееся, в частности, снижением кожной температуры, особенно кистей рук и стоп, акроцианозом, а также олигурией или анурией вследствие уменьшения перфузии почек. В каждом случае шока у больного инфарктом миокарда (ИМ) речь идет о КШ.
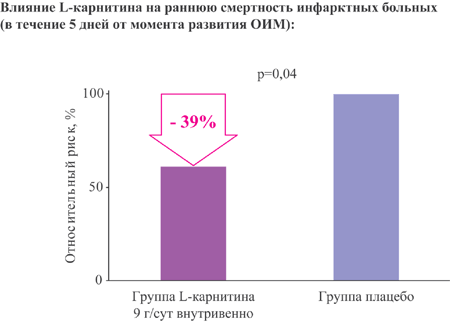
Наиболее частый механизм шока при ИМ – снижение сердечного выброса вследствие обширности ишемического поражения и резкого снижения пропульсивной способности ЛЖ. Летальность в этой группе без использования реперфузионной терапии достигает 70-80% и более [8]. Летальность пациентов с КШ при использовании современных реанимационных методов терапии составляет 59,4% [9].
Проспективное открытое контролируемое исследование по оценке влияния L-карнитина на выживаемость пациентов с КШ [9]:
- Пациенты с ОИМ и КШ, n=27
- Первую дозу L-карнитина 4 г вводили в/в болюсно, затем по 6 г в сутки в/в капельно в несколько приемов до выхода пациента из шока
- Длительность 10 суток
Добавление L-карнитина к стандартной терапии снизило летальность у пациентов с КШ до 22,2% в течение 10 дней наблюдения
Влияние на возникновение желудочковых аритмий
L -карнитин снижает на 80% количества эпизодов желудочковой тахикардии и ранних экстрасистол на 2 день от развития ОИМ при добавлении к стандартной терапии
Аритмии - самое частое осложнение инфаркта миокарда (ИМ) и самая частая причина смерти на догоспитальном этапе. Половина летальных исходов при ИМ происходит в первые два часа, в большинстве случаев вследствие фибрилляции желудочков (ФЖ). На госпитальном этапе аритмии являются второй по частоте (после острой сердечной недостаточности) причиной летальных исходов больных с ИМ. Нарушения ритма являются отражением обширного поражения миокарда и часто вызывают появление или усиление нарушений гемодинамики и клинических проявлений недостаточности кровообращения.
Желудочковые аритмии, особенно желудочковые экстрасистолии (ЖЭ), при ИМ с подъемом сегмента ST (ИМпST) встречаются в 80-90% случаев. Большинство эпизодов желудочковой тахикардии (ЖТ) и ФЖ возникает в первые 48 ч после начала заболевания. Устойчивая ЖТ и ФЖ в более поздние сроки ИМпST может указывать на наличие субстрата для возникновения угрожающих жизни аритмий и значительно ухудшает прогноз.
- ФЖ - основной механизм остановки сердца в остром периоде заболевания [10].
- Частота возникновения ФЖ у больных с ОИМ в первые две недели составляет от 2,5 до 15%[11]
- Пациенты с ОИМ, n=56
- L-карнитин вводили в/в 4 раза по 100 мг/кг веса с интервалом 12 ч. Первое введение L-карнитина осуществлялось от 5 до 12 ч от начала развития ОИМ
- Длительность наблюдения 2 суток
Добавление L-карнитина к стандартной терапии ОИМ достоверно снизило на 80% количества эпизодов желудочковой тахикардии и ранних экстрасистол на 2 день сердечной катастрофы

Влияние на прогностические показатели у больных с ОКС
Рандомизированное двойное слепое плацебо-контролируемое исследование по оценке влияния в/в введения Элькара на Δ QTc, QTc, ЧСС и эхокардиографические показатели у пациентов с ОКС в госпитальный период [13, 14, 15]:
- Пациенты с ОКС, n=58.
- Элькар вводили в/в в течение первых 3 суток по 2 г (4 ампулы) 2 раза в сутки (всего 8 ампул в сутки), с 4 суток по 15 сутки (или до выписки, если она происходила раньше) по 2 г (4 ампулы) 1 раз в сутки
- Длительность 15 суток или до выписки, если она происходила раньше
- пациенты с ОКС, не подвергавшихся инвазивному коронарному вмешательству, старше 18 лет
- наличие инфаркта миокарда (ИМ)
- типичный болевой приступ продолжительностью более 20 мин
- изменения на ЭКГ в виде подъемов или депрессий ST на ЭКГ
- Появление новой блокады левой ножки пучка Гиса
- Наличие повышенного уровня тропонина
- Наличие нестабильной стенокардии (НС)
- учащение или усиление типичных стенокардических болей
- наличие депрессий ST
- отсутствие повышения уровня тропонина
- Подписанное согласие пациента на проведение исследования
- Боли или изменения на ЭКГ, возникшие в связи с повышением АД (более 180 и 100 мм рт.ст.)
- Кардиогенный шок
- Хронические заболевания печени и почек с выраженными нарушениями функции (повышение АСТ, АЛТ более чем в два раза от верхней границы нормы и снижение уровня клубочковой фильтрации менее 30 мл/мин
- Наличие хронических интоксикаций (алкоголизм, наркомания)
- Прием других препаратов метаболического действия
Терапия (стандартная):
Все пациенты получали общепринятую при ОКС терапию, включавшую тромболизис по показаниям, двойную дезагрегантную терапию (ацетилсалициловая кислота и клопидогрел), антикоагулянтную терапию (гепарин или фондапаринукс), статины, бета-адреноблокаторы, ингибиторы АПФ или сартаны, нитраты (по показаниям). Частота назначения различных групп препаратов не различалась в исследуемых группах.
Режим дозирования препарата:
Способ введения препарата - внутривенно капельно. Перед внутривенным введением содержимое ампулы растворяли в 100-200 мл растворителя (0,9 % раствор хлорида натрия).
Препарат Элькар для внутривенного и внутримышечного введения или плацебо назначался сразу после рандомизации пациента
Дозы: в течение первых 3 суток по 2 г (по 4 ампулы) 2 раза в сутки (всего 8 ампул в сутки), с 4 суток по 15 сутки (или до выписки, если она происходила раньше) по 2 г (по 4 ампулы) 1 раз в сутки
Продолжительность наблюдения – не менее 15 дней или до выписки из стационара
Результаты
Влияние на дисперсию корригированного интервала QT (ΔQTc)
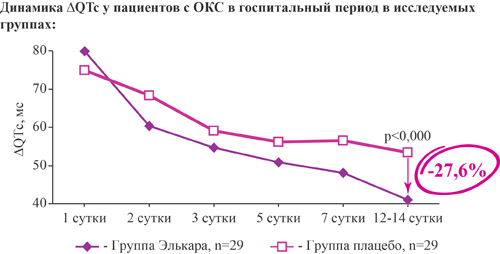
Элькар снижает на 27,6% дисперсию корригированного интервала QT на 12-14 сутки госпитализации у больных с острым коронарным синдромом при добавлении к стандартной терапии
Повышенную дисперсию корригированного интервала QT (ΔQTc) принято рассматривать, как признак неблагоприятного прогноза у широкой категории людей (здоровых, больных с врожденными заболеваниями сердца, ишемической болезнью сердца, инфарктом миокарда – ИМ и др.). По мнению большинства исследователей, ΔQTc, как маркер негомогенности реполяризации, может быть использована для выявления групп высокого риска, в частности риска внезапной сердечной смерти (ВСС). Особое внимание уделяют ΔQTc, как предиктора смерти и аритмических событий, у пациентов с ОИМ. Важно, что ΔQTc определяет не только краткосрочные, но и долгосрочные прогнозы у пациентов с ОИМ. При этом указывают, что ΔQTc является чувствительным предиктором риска жизнеугрожающих аритмий. Причем ΔQTc является истинным фактором риска, так как она не только увеличивается при ишемии миокарда, но, что особенно важно, устранение ишемии приводит к отчетливому уменьшению выраженности ΔQTc. Это наблюдают при успешно проведенной тромболитической терапии и при хирургическом восстановлении коронарного кровотока (в частности при стентировании) у пациентов с ОИМ.
Важным моментом для отдаленного прогноза является скорость уменьшения ΔQTc при устранении ишемии. Так, если в ближайшие 6 ч уменьшение было маловыраженным, даже при восстановлении кровотока прогноз был неблагоприятным и смертность была выше (14,6 % против 2,4%; p Дополнительный анализ результатов многоцентрового рандомизированного двойного слепого плацебо-контролируемого исследования AIREX на предмет оценки влияния величины ΔQT, измеренной непосредственно перед рандомизацией, на смертность пациентов с ОИМ в сочетании с клинически подтвержденной сердечной недостаточностью показал, что ΔQT является независимым предиктором смерти от любых причин в последующие 6 лет, n=501 [17].
В ретроспективном когортном исследовании проведенном в одной из клиник США исследовалась прогностическая связь между ΔQT, возникновением аритмий в госпитальный период и летальными исходами в последующий год у пациентов с ИМпST госпитализированных в течение 48 ч от момента развития симптомов ОКС, n=100. Была показана достоверная зависимость между увеличенной величиной ΔQTc и аритмиями в госпитальный период, в котором пациенты, выжившие в течение последующего года имели более низкие госпитальные значения ΔQTc и тенденцию к снижению в течение 48 ч, в отличие от пациентов с аритмиями, которые не выжили в течение года [18].
Таким образом:
- ΔQTc – чувствительный предиктор риска угрожающих жизни аритмий у пациентов с ИМ [17, 18]
- достоверно снижает на 27,6% дисперсию корригированного интервала QT (ΔQTc) на 12-14 день
- уже на второй день достоверно уменьшает выраженность ΔQTc (в %)
Влияние на корригированный интервал QT (QTc) при ОКС
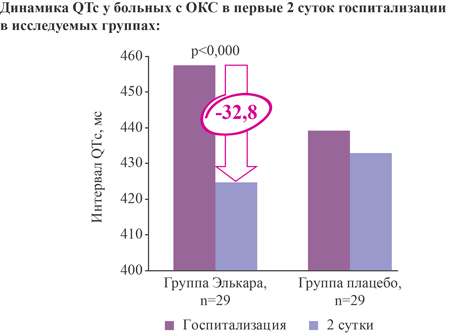
Элькар снижает на 32,8 мс длительность QTс на вторые сутки госпитализации у больных с острым коронарным синдромом при добавлении к стандартной терапии
Интервал QT показывает время общей электрической активности желудочков, включая как деполяризацию, так и реполяризацию.
Для унификации получаемых результатов обычно используют значение интервала QT, нормализованное или корригированное по ЧСС (поделенное на корень квадратный из ЧСС) и обозначаемое как QTc. Механизмы, которые ответственны за увеличение продолжительности интервала QT, окончательно не ясны. Так, увеличение продолжительности QT наблюдается у лиц старших возрастных групп, наблюдаются суточные и сезонные (удлинение наблюдается в зимний период) колебания продолжительности интервала QT. Корригированный интервал QT рассматривают, как маркер неблагоприятных исходов у различных категорий людей.
Контроль продолжительности QT является обязательным при оценке безопасности действия лекарственных препаратов, особенно обладающих антиаритмическими свойствами. Как показано в исследовании MERLIN –TIMI 36, n=6492 [19]:
- удлиненный QTc в первые 48 ч от развития симптомов ОКС является независимым параметром неблагоприятного прогноза и увеличивает в 2 раза риск ВСС в последующий год у больных с ОКСбпST (р=0,024)
- на каждые 10 мс уменьшения QTc в первые 48 ч от начала развития симптомов ОКС приходится снижение на 8,4% риска ВСС в последующий год у больных с ОКСбпST (р = 0,007).
Добавление Элькара к стандартной терапии ОКС достоверно снижает продолжительность QTc на 32,8 мс в первые 48 ч (на вторые сутки) [14]:
Влияние на размер и систолическую функцию миокарда при ОКС
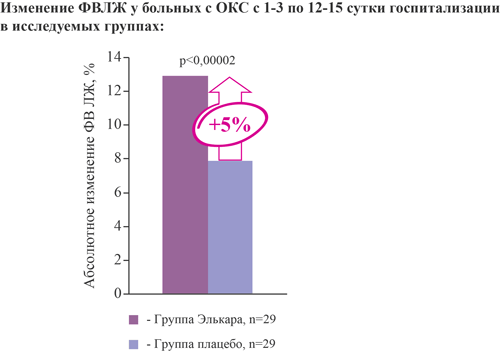
Элькар увеличивает на 5% фракцию выброса ЛЖ на 12-15 сутки госпитализации у больных с острым коронарным синдромом при добавлении к стандартной терапии
Повреждение миокарда сопровождается снижением фракции выброса левого желудочка (ФВЛЖ в норме 50 – 70 %), одного из основных показателей сократительной способности сердца (систолической функции ЛЖ). ФВЛЖ независимый предиктор смерти и других серьезных нежелательных исходов в отдаленном периоде у пациентов с ОКСбпST [20].
- Размер и сократительная функция ЛЖ у пациентов с ОИМ на 8-14 сутки от начала развития симптомов являются независимыми прогностическими факторами риска сердечно-сосудистой смерти (ССС) в течение последующего года [21].
- При увеличении ФВЛЖ на 10% у пациентов с ОИМ на 8-14 сутки от начала развития симптомов риск ССС в последующий год снижается на 38% (р=0,002) [21].
- увеличивает фракцию выброса ЛЖ на 5%;
- снижает конечный диастолический объем ЛЖ на 4,6%;
- снижает конечный систолический объем ЛЖ на 3,6%.
Выводы:
Добавление Элькара к стандартной терапии в сравнении с плацебо в ранние сроки ОКС приводило к улучшению параметров характеризующих электрическую стабильность миокарда, позволяло уменьшить степень постинфарктного ремоделирования ЛЖ и улучшить параметры локальной сократимости миокарда в госпитальный период. Наиболее выраженное и более раннее влияние Элькар оказывал на больных, которых можно отнести к категории высокого риска, то есть исходно имевших длительность QTc > 440 мс и/или Δ QTc>80 мс и/или сниженную ФВЛЖ [13, 14, 15].
Исследование по оценке эффективности и безопасности терапии препаратом «Элькар» раствор для инъекций 100 мг/мл в условиях отделения реанимации и интенсивной терапии при синдроме малого выброса у больных с ОИМ [22]
- Проспективное открытое контролируемое в параллельных группах исследование
- Пациенты с ОИМ 1-2 суточной давности и ФВЛЖ 40% не получающие метаболическую терапию, n=59.
- Группа Элькара: n=35, возраст 32-94 лет (средний возраст 66,1±2,9 лет); группа контроля: n=24, возраст 40-88 лет (средний возраст 64,2±2,0 лет).
- Введение Элькара (раствор для инъекций 100 мг/мл) проводилось в/в 1 раз в сутки по 500-1000 мг в 100 мл 0,9%-ного раствора хлорида натрия в первые 5 дней госпитализации.
- Длительность наблюдения 5-7 суток
Результаты
Сравниваемые группы обследованных больных в исследовании были сопоставимы по половозрастным показателям, срокам ОИМ и его «повторности», частоте сопутствующей патологии, хирургических вмешательств на коронарных артериях и количеству факторов риска атеросклероза. У большинства пациентов обеих групп при коронарографии были выявлены показания к АКШ - 70,8% и 72,7% соответственно в контрольной группе и у больных
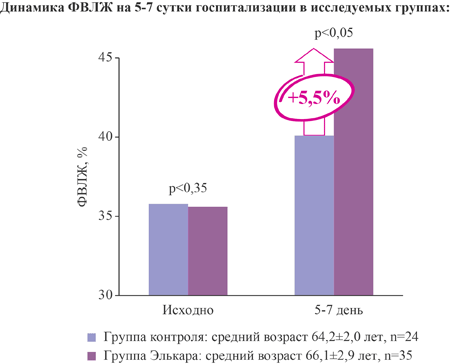
Средний реанимационный койко-день у больных, получавших Элькар, имел тенденцию к снижению, по сравнению с контрольным и ФВЛЖ у них ускоренно нарастала к 5-7-м суткам введения препарата, по сравнению с пациентами контрольной группы - с 35,5±0,9 до 45,4±1,2 против 35,8±0,7 до 40,1±0,9 (рВыявлен дозозависимый эффект Элькара - положительная достоверная корреляция суммарной дозы препарата, полученной каждым пациентом, с повторно определенной на 5-7 сут заболевания ФВЛЖ (r= 0,67, Р
| Основные показатели в сравниваемых группах | Контроль (n=24) | Элькар (n=35) | Р |
|---|---|---|---|
| Фракция выброса ЛЖ,% - исходная 5-7 день | 35,8±0,7 | 35,6±0,8 | 0,35 |
| 40,1±0,9 | 45,6±1,3 | ||
| Активность КФК, Е/л исходная 5-7 день | 432,0±102,9 | 487,8± 116,0 | 0,70 |
| 227,1±76,5 | 152,1±51,4 | ||
| Активность КФК-МВ, Е/л исходная 5-7 день | 70,9±11,1 | 83,6±17,0 | 0,50 |
| 29,8±3,9 | 19,22±3,3 | ||
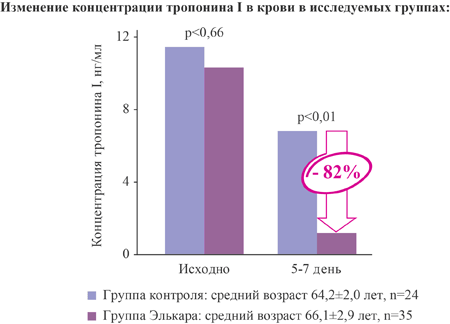
| Тропонин I, нг/мл исходный 5-7 день | 11,47±3,65 | 10,32±2,94 | 0,66 |
| 6,81±1,45 | 1,21±0,87 | ||
| Койко-день в отд. реанимации, сут | 5,8±0,9 | 4,9±0,8 | 0,18 |
| Умерло | 2 (8,3%) | 1 (2,8%) |
Элькар увеличивает на 5,5% фракцию выброса ЛЖ на 5-7 сутки госпитализации у больных с ОИМ при добавлении к стандартной терапии [22]:
Влияние на уровень содержания тропонина I в крови при ОИМ
В отличие от нестабильной стенокардии при ОИМ происходит гибель кардиомиоцитов - некроз. Чем больше размер очага некроза, тем выше вероятность развития СН и неблагоприятного исхода [8]. Наличие в крови кардиоспецифического фермента тропонина подтверждает некротическое поражение миокарда. Уровень тропонина отражает объем поражения сердечной мышцы и дает возможность оценить тяжесть состояния и риск смерти в ближайшие 30 дней [20].
Анализ дополнительных данных исследования Thrombolysis in Myocardial Ischemia Phase IIIB (TIMI IIIB) показал, что
- летальность пациентов с ОКС в течение 42 дней с высокой степенью достоверности повышается с повышением уровня тропонина I в крови измеренного в течение 24 ч от момента наступления боли в груди [23]
Побочные реакции на препарат Элькар раствор для внутривенного и внутримышечного введения.
Во всех случаях побочных явлений при использовании Элькара не зарегистрировано. Препарат не купировал и не провоцировал нарушений ритма и проводимости, его введение хорошо переносилось больными, включая пациентов с сахарным диабетом (СД) [13, 14, 15, 22].
Влияние на процессы ремоделирования ЛЖ
ОИМ часто приводит к частичной дисфункции ЛЖ, и вследствие этого вызывает прогрессирующее увеличение его объема - ремоделирование. Расширение ЛЖ объясняется не только возможным распространением пораженной зоны, но и адаптивным удлинением здоровой зоны миокарда. Расширение ЛЖ после ОИМ можно рассматривать как ответ на локальную дисфункцию, нацеленный на восстановление нормального объема выброса. Показатели расширения ЛЖ после ОИМ, а в частности конечный систолический объем, являются наиболее ценными прогностическими индикаторами клинического исхода. Пациенты, ЛЖ которых расширен больше, более предрасположены к сердечной недостаточности и смертельному исходу. Кроме того, показано, что ограничение увеличения объема ЛЖ после ОИМ может оказывать существенное клиническое улучшение. Именно поэтому большинство усилий было направлено на изобретение и разработку терапий по ограничению увеличения объема ЛЖ после ОИМ. Исследования показали, что увеличение объема ЛЖ зависит от:
1) собственного размера пораженного участка (наиболее важный показатель), и при своевременной реперфузии пациентов он существенно меньше;
2) от степени перегрузки ЛЖ: при уменьшении степени перегрузки можно избежать прогрессирующего увеличения объема ЛЖ .
L-карнитин – это физиологически активное соединение, играющее важную роль в процессе выработки энергии в митохондриях миокарда. Он уменьшает накопление длинноцепочечных жирных кислот, снижая, таким образом, их вредное влияние. Клинические исследования показали, что уровень L-карнитина быстро падает при ишемии, ОИМ или при сердечной недостаточности. В целом показано, что дополнительный прием L-карнитина восстанавливает его необходимый уровень, оказывая благотворное влияние на функцию миокарда.
Применение ингибиторов ангиотензин-превращающего фермента для уменьшения прогрессирования ремоделирования ЛЖ в ряде случаев было прекращено ввиду побочных эффектов, таких как снижение давления, кашель, понос и общее ухудшение самочувствия, что существенно ограничивает их клиническое применение. Их применение зависит от того, как скоро началось лечение (в течение часов, дней или только после госпитализации), от природы ингибитора, дозы, а также сопутствующей терапии.
Исследование CEDIM показало, что своевременное назначение L-карнитина эффективно препятствует прогрессированию ремоделирования ЛЖ у пациентов с ИМ. Пациенты группы, принимавшей карнитин, имели существенно более низкие конечные систолический и диастолический объемы по прошествии 3, 6 и 12 месяцев после выписки из госпиталя, по сравнению с пациентами группы, получавшей плацебо.
Пациенты с ИМ, у которых ЛЖ расширен больше, более предрасположены к сердечной недостаточности и смертельному исходу [24]
Ограничение увеличения объема, т.е. замедление процесса ремоделирования ЛЖ - важная клиническая задача, поскольку может оказывать существенное клиническое улучшение у пациентов с ОИМ [25]
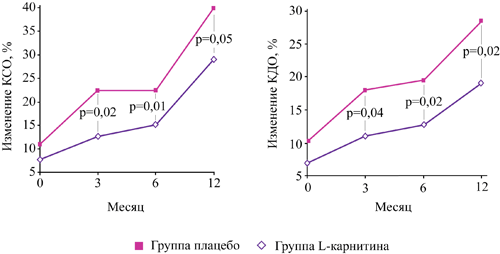
L-карнитин снижает прирост конечного систолического объема левого желудочка на 44% у пациентов с ИМ через 3 месяца с сохранением эффекта в течение года при продолжении терапии
Исследование CEDIM (L-Carnitine Ecocardiografia Digitalizzata Infarto Miocardico) [26]
Цель исследования - оценка влияния L-карнитина на расширение левого желудочка сердца у пациентов с острым инфарктом миокарда передней локализации
- Рандомизированное, двойное слепое, плацебо-контролируемое исследование
- 36 кардиологических центров
- Длительность 12 месяцев
- Пациенты с ОИМ передней локализации получали стандартную базисную терапию, n=472
- L-карнитин назначали по 9 г в сутки в/в медленно в течение 5 дней от момента развития ОИМ, затем per os по 2 г 3 раза в сутки последующие 12 месяцев
Результаты исследования CEDIM
В исследовании CEDIM показано, что добавление левокарнитина к стандартной терапии ОИМ с продолжением терапии в течение года после выписки:
- достоверно на 44% снижает прирост конечного систолического объема ЛЖ через 3 месяца с сохранением эффекта в течение года
- эффективно препятствует ремоделированию ЛЖ
Влияние на прогноз у инфарктных больных
L-карнитин может улучшать прогноз у пациентов с ИМ при добавлении к стандартной терапии
Терапия, направленная на поддержание жизнеспособности ишемизированного миокарда, ограничение размера зоны инфаркта и замедление прогрессирования ремоделирования ЛЖ, не только способствует сохранению глобальной сократимости ЛЖ, но и снижает смертность и частоту развития сердечной недостаточности у больных с ИМ. В настоящее время эти терапевтические цели достигаются за счет тромболизиса либо первичной транслюминальной коронарной ангиопластики, а также блокады бета-адренорецепторов и ингибирования ангиотензин-превращающего фермента. Тем не менее, несмотря на успехи реваскуляризации и снижающей нагрузку на ЛЖ медикаментозной терапии, показатели смертности у больных с ИМ остаются высокими. Проспективное когортное исследование в Дании показало, что не смотря на применение современных методов терапии летальность среди пациентов с ИМ через 1 год составляет 28,1%, а в течение 4 лет (медиана 2,4 года) – 54% [27]. В когортном исследовании ЛИС (Люберецкое исследование смертности больных, перенесших острый инфаркт миокарда, Россия) смертность больных с ОИМ в течение 3,9 года (медиана 1,6 года) составила 15,2% [2].
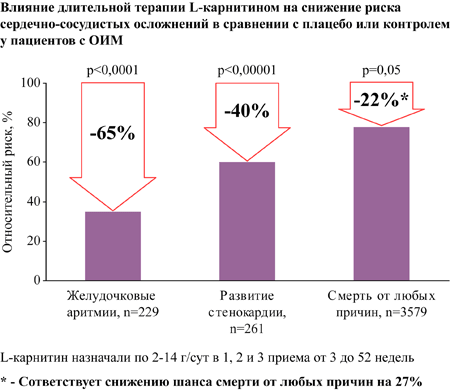
Систематический обзор и мета-анализ 13 РКИ по оценке длительной терапии L-карнитином пациентов с ИМ в сравнении с плацебо или контролем, n=3629.
L-карнитин назначали по 2-14 г/сут в 1, 2 и 3 приема от 3 до 52 недель [28].
Результаты
Добавление левокарнитина к стандартной терапии и пациентов с ОИМ с продолжением терапии от 3 до 52 недель достоверно снижает [28]:
- на 27% шанс смерти от любых причин (соответствует снижению риска на 22%)
- на 40% риск развития стенокардии
- на 65% риск возникновения желудочковых аритмий
Элькар раствор для внутривенного и внутримышечного введения 100 мг/мл
в упаковке 10 ампул по 5 мл
| Схема применения в кардиологии | |
|---|---|
| Острый инфаркт миокарда Острая сердечная недостаточность | 3-5 г/сут (6-10 ампул) в/в, разделенных на 2-3 введения в первые 2-3 суток с последующим снижением дозы в 2 раза (3-5 ампул) в/в или в/м на время нахождения пациента в кардиологическом отделении |
| Кардиогенный шок | 3-5 г/сут (6-10 ампул) в/в, разделенных на 2-3 введения до выхода пациента из шока |
| ИБС (стенокардия, постинфарктные состояния) | 0,5-1 г/сут (1-2 ампулы) в/в или в/м 2-3 раза в день без разведения в течение 3-7 дней. При необходимости через 12-14 дней назначают повторный курс |
| * - Более полную информацию смотрите в инструкции по медицинскому применению Элькар® вводят внутривенно капельно медленно или струйно (2-3 мин) или в/м. Перед в/в введением содержимое ампулы растворяют в 100-200 мл растворителя (0,9% раствор хлорида натрия) | |
Литература
[1] - Ощепкова Е.В. Смертность населения от сердечно-сосудистых заболеваний в Российской Федерации и пути по ее снижению. Кардиология 2009;(2):267–72
[2] – Марцевич С.Ю. и соавт. Исследование ЛИС (Люберецкое исследование смертности больных, перенесших острый инфаркт миокарда) . РФК 2012;8(6):738-745
[3] –Terkelsen CJ, et al. Mortality rates in patients with ST-elevation vs.non-ST-elevation acute myocardial infarction: observations from an unselected cohort. Eur Heart J. 2005 Jan;26(1):18-26;
[4] – Spagnoli LG, Corsi M, Villaschi S, et al.: Myocardial carnitine deficiency in acute myocardial infarction. Lancet 1982; 1: 1419—20
[5] - Тарантини Г. «Метаболическая терапия L-карнитином при переднем остром инфаркте миокарда с подъемом сегмента ST. Рандомизированное клиническое исследование» (CEDIM 2). Российский кардиологический журнал. 2011, №4 (90): 77-84
[6] - Пасечник И.Н. «Перспективы метаболической терапии КС» Доктор.Ру Кардиология 2015 №8-9: 22-27
[7] - Awad HH et al.Cardiogenic shock complicating acute coronary syndromes: insights from the Global Registry of Acute Coronary Event. Am Heart J. 2012 Jun;163(6):963-71
[8] - Национальные рекомендации. ВНОК. Диагностика и лечение больных острым инфарктом миокарда с подъемом сегмента ST на ЭКГ. Кардиоваскулярная терапия и профилактика 2007;6 (8), Прил. 1: 457
[9] - Corbucci GG, et al . L-carnitine in cardiogenic shock therapy: pharmacodynamic aspects and clinical data. Int J Clin Pharmacol Res. 1993;13(2):87-91
[10] - Национальные рекомендации. ВНОК. Диагностика и лечение больных острым инфарктом миокарда с подъемом сегмента ST на ЭКГ. Кардиоваскулярная терапия и профилактика 2007;6 (8), Прил. 1: 471
[11] - Ornek E, et al. The effect of thrombolytic therapy on QT dispersion in acute myocardial infarction and its role in the prediction of reperfusion arrhythmias. Niger J Clin Pract. 2014 Mar-Apr;17(2):183-7
[12] - Rizzon P et al High doses of L-carnitine in acute myocardial infarction: metabolic and antiarrhythmic effects. Eur Heart J. 1989 Jun;10(6):502-8
[13] - Глезер М.Г. и соавт. Влияние L-карнитина на дисперсию интервала QT у пациентов с острым коронарным синдромом . Кардиология. 2015; 3(55): 19-24
[14] - Глезер М.Г. и соавт. Влияние L-карнитина на ЧСС и QT у пациентов с острым коронарным синдромом . Сердце: журнал для практикующих врачей. 2015; 2(14): 78-84
[15] - Глезер М.Г. и соавт. Влияние L-карнитина на ЭХО-кардиографические показатели у пациентов с острым коронарным синдромом. Журнал Сердечная недостаточность. 2015; №4: 234-40
[16] - Zimarino M1, Corazzini A, Tatasciore A, et al. Defective recovery of QT dispersion predicts late cardiac mortality after percutaneous coronary intervention. Heart. 2011; 97(6): 466-72.
[17] - Spargias KS, et al. QT dispersion as a predictor of long-term mortality in patients with acute myocardial infarction and clinical evidence of heart failure. Eur Heart J. 1999; 20(16): 1158-65
[18] - Aziz F, et al. QT dispersion as a predictor for arrhythmias in patients with acute ST elevation myocardial infarction. J Thorac Dis. 2010 Jun; 2(2): 86-8
[19] - Karwatowska-Prokopczuk E et al. The risk of sudden cardiac death in patients with non-ST elevation acute coronary syndrome and prolonged QTc interval: effect of ranolazine. Europace. 2013;15(3):429-36
[20] - Национальные рекомендации. ВНОК. Рекомендации по лечению острого коронарного синдрома без стойкого подъема сегмента ST. Рациональная Фармакотерапия в Кардиологии 2012;Т8, Прил 2: 11, 15, 42
[21] - Sutton M et a.l for the SAVE investigators. Quantitative two dimensional echocardiographic measurements are major predictors of adverse cardiovascular events after acute myocardial infarction. The protective effects of captopril. Circulation 1994; 89:68-75
[22] - Семиголовский Н.Ю. и соавт. Положительные инотропные свойства левокарнитина при синдроме малого выброса у больных острым инфарктом миокарда. Кардиология и ССХ 2013; №3: 43-46
[23] - Antman EM, et al. Cardiac-specific troponin I levels to predict the risk of mortality in patients with acute coronary syndromes. N Engl J Med 1996;335:1342–9
[24] - White HD, et al. Left ventricular end-systolic volume as the major determinant of survival after recovery from myocardial infarction. Circulation. 1987 Jul;76(1):44-51
[25] - St John Hutton M., et al. for the SAVE Investigators. Quantitative two-dimensional echocardiography measurements are major predictors of adverse cardiovascular events after acute myocardial infarction. The protective effects of captopril. Circulation 1994; 89: 68–75
[26] - Iliceto S, et al. Effects of L-carnitine administration on left ventricular remodeling after acute anterior myocardial infarction: theL-Carnitine Ecocardiografia Digitalizzata Infarto Miocardico (CEDIM) Trial. J Am Coll Cardiol. 1995 Aug;26(2):380-7
[27] –Terkelsen CJ, et al. Mortality rates in patients with ST-elevation vs.non-ST-elevation acute myocardial infarction: observations from an unselected cohort. Eur Heart J. 2005 Jan;26(1):18-26;
[28] - Дж.Дж. Диниколантонио и соавт. L-карнитин для вторичной профилактики сердечно-сосудистых заболеваний: систематический обзор литературы и метаанализ. РМЖ Кардиология 2013; №5: 651-66

