Влияние побочных эффектов ингибиторов ангиотензин-превращающего фермента на тактику лечения сердечно-сосудистых заболеваний
СтатьиОпубликовано в журнале:
"Российский кардиологический журнал"
»» N3 2005
Орлов В.А., Гиляревский С.Р., Урусбиева Д.М., Даурбекова Л.В.
Российская медицинская академия последипломного образования МЗ и СР РФ, кафедра клинической фармакологии и терапии
Ингибиторы ангиотензин-превращающего фермента (ИАПФ) остаются краеугольным камнем лечения наиболее распространенных сердечно-сосудистых заболеваний. В последние годы показания для назначения ИАПФ существенно расширились, благодаря доказательствам эффективности ИАПФ, для профилактики неблагоприятных сердечно-сосудистых событий у пациентов высокого риска [1]. В связи с этим, проблемы переносимости ИАПФ продолжают быть актуальными.
Влияние фармакологических свойств ИАПФ на их клиническую эффективность и риск развития побочных эффектов
Большая часть побочных эффектов ИАПФ, как видно из табл. 1, определяется общими для этой группы свойствами, поэтому фармакологические различия между препаратами не должны оказывать большого влияния на частоту развития побочных эффектов за исключением тех, которые определяются наличием в составе молекулы препарата определенной группировки, в частности – сульфгидрильной.

Различия ИАПФ могут касаться химической структуры части молекулы, ответственной за связывание с АПФ, биодоступности, времени полужизни в плазме, пути элиминации, распределения, сродства к тканевому АПФ, а также поступления в организм в виде активного препарата или пролекарства. Ингибиторы АПФ могут быть разделены на три группы в зависимости от химической структуры активной части молекулы.
Каптоприл является прототипом ИАПФ, содержащих сульфгидрильную группу; другие представители этой группы – фентиаприл, пивалоприл, зофеноприл и алацеприл. Исследования in vitro показали, что наличие сульфгидрильной группы может обуславливать дополнительные свойства препаратов, которые не обусловлены ингибированием АПФ (связывание свободных радикалов, влияние на синтез простагландинов [2; 3]). Однако эти данные не подтверждены в клинических исследованиях.
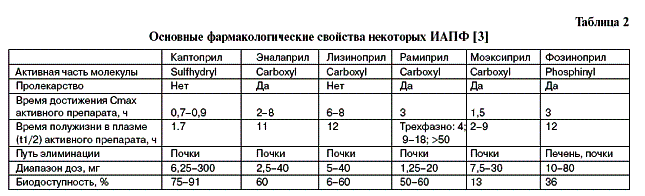
Среди ИАПФ фозиноприл – единственный препарат, у которого активная часть молекулы содержит фосфонильную группу. Большинство ИАПФ содержат карбоксильную группу в активной части молекулы. Основные фармакологические свойства некоторых ИАПФ представлены в табл. 2. Каптоприл отличается от других препаратов коротким периодом полужизни в плазме. За исключением фозиноприла, трандолаприла и спираприла, ИАПФ в основном выводятся почками, что определяет необходимость уменьшения дозы у больных с нарушением функции почек. Большая часть ИАПФ поступает в организм в виде пролекарства, которое становится активным после эстерификации в печени. Как правило, пролекарства имеют более высокую биодоступность по сравнению с активными препаратами.
Гипотония после приема первой дозы
Все ИАПФ способны вызывать артериальную гипотонию. Снижение АД, наблюдаемое в течение нескольких часов после приема первой дозы ИАПФ, происходит в результате ингибирования ренин-ангиотензиновой системы (РАС). Быстрое снижение АД более вероятно у больных, имеющих исходно высокий уровень ренина и ангиотензина II плазмы, например, у больных, получающих высокие дозы диуретиков [4].
Хотя развитие гипотонии при лечении ИАПФ обычно связывают с приемом первой дозы, она может появиться и на более поздних этапах терапии. Снижение АД после приема первой дозы обычно небольшое и бессимптомное, не приводящее к нарушению перфузии жизненно важных органов [5, 6]. Однако у небольшой части больных может отмечаться выраженная гипотония, сопровождающаяся симптомами гипоперфузии сердца, головного мозга и почек [7].
Хотя известно, что больные с ХСН имеют повышенный риск эффекта первой дозы, развитие клинически значимой гипотонии, требующей прекращения терапии ИАПФ, отмечается менее чем у 10% пациентов [8]. У больных с неосложненной эссенциальной гипертонией, которые не получают другие антигипертензивные препараты, начало терапии ИАПФ редко сопровождается клинически значимой гипотонией [9].
К факторам, способствующим развитию выраженной гипотонии, относят гипонатриемию [10] и гиповолемию [11], в частности, на фоне приема диуретиков [12], рвоты или диареи. Пожилой возраст, наличие выраженной и/или осложненной артериальной гипертонией (включая злокачественную или ренин-зависимую реноваскулярную гипертонию) считаются факторами риска значимой гипотонии. Исходное нарушение функции почек и стеноз почечных артерий также повышают риск развития гипотонии после приема первой дозы ИАПФ. Больным, имеющим один или несколько этих факторов риска, на начальном этапе терапии ИАПФ может потребоваться наблюдение в условиях стационара.
Риск развития гипотонии после приема первой дозы и в начале терапии ИАПФ можно свести к минимуму, если придерживаться определенной тактики.
Особенно важно добиться эуволемического состояния к моменту начала терапии, при необходимости корригируя дегидратацию [12]. Может также потребоваться временный отказ от ограничения употребления поваренной соли или менее жесткое ограничение ее потребления в раннем периоде лечения.
В случае высокого риска развития гипотонии после приема первой дозы или в начале терапии целесообразно использовать небольшую начальную дозу коротко действующего препарата (например, каптоприла в дозе 6,25 мг) [6], а также рекомендовать пребывание в постели после приема начальной дозы. В последующем возможен переход на длительно действующий препарат.
Две характеристики периндоприла определяют безопасность его использования в этих ситуациях: (1) постепенное начало действия; (2) отсутствие значимого гипотензивного действия у нормотоников при назначении в небольших дозах.
Navookarasu N.T. et al. у 80 больных с ХСН в двойном слепом рандомизированном плацебо-контролируемом исследовании сравнивали степень снижения АД после первого приема 2 мг периндоприла, 6,25 мг каптоприла, 2,5 мг эналаприла и 2,5 мг лизиноприла [13]. Измерение АД проводили каждые 30 мин в течение первых 2-х ч., а затем каждый час. Максимальное снижение среднего АД составило 5,3±2,5 мм рт. ст. для периндоприла, 13,3±3,3 мм рт. ст. – для эналаприла, 15,0±5,7 мм рт. ст. – для лизиноприла, 16,8±5,7 мм рт. ст. – для каптоприла и 5,9±2,7 мм рт. ст. – для плацебо. Различия при сравнении с плацебо оказались достоверны для всех препаратов (p<0,05), кроме периндоприла.
Развитие гипотонии несколько ограничивает применение ИАПФ в ранние сроки инфаркта миокарда. Считается, что нижней границей систолического артериального давления, при котором можно назначать ИАПФ в ранние сроки инфаркта миокарда, является 100 мм рт. ст. [14]. Отмена ИАПФ у больных инфарктом миокарда, обусловленная гипотонией, происходила в основном у тех больных, у которых было исходно низкое артериальное давление (<100 мм рт. ст.); но даже у этих больных развитие гипотонии не ухудшало ближайший прогноз.
В исследованиях ISIS-4 (Fourth International Study of Infarct Survival) и GISSI-3 (Gruppo Italiano per lo
Studio della Sopravvivenza nell’Infarto miocardico) артериальная гипотония, обусловленная терапией ИАПФ, сопровождалась более благоприятным ближайшим прогнозом по сравнению с гипотонией, развившейся на фоне приема плацебо.
Тем не менее, описан случай развития рефрактерного к введению катехоламинов кардиогенного шока у пациентки 42 лет с острым инфарктом миокарда передней локализации, дебютировавшего отеком легких, через 2 ч. после первого приема внутрь лизиноприла [15]. Внутривенное введение плазмозамещающих растворов и норадреналина не улучшало гемодинамический статус. Только после в/в введения ангиотензина II было отмечено существенное увеличение системного сосудистого сопротивления, сопровождавшееся регрессом клинических проявлений шока.
Наличие гемодинамически значимого аортального стеноза считается противопоказанием для назначения ИАПФ из-за опасности развития неуправляемой гипотонии [16]. Несмотря на это, в литературе появляются отдельные сообщения о применении ИАПФ у больных с критическим аортальном стенозом, которое сопровождалось положительным влиянием на гемодинамику, особенно при наличии сердечной недостаточности [17]. Несмотря на существование экспериментальных и клинических данных о положительном влиянии ИАПФ на функцию и процессы ремоделирования сердца при аортальным стенозе [18, 19], вопрос о возможности их практического применения при данной патологии будет оставаться открытым до получения в контролируемых исследованиях убедительных доказательств безопасности этих препаратов.
Нарушение функции почек
Важность правильной оценки негативного влияния ИАПФ на функцию почек определяется несколькими причинами. С одной стороны, ИАПФ широко применяют для лечения артериальной гипертонии, ХСН, диабетической и недиабетической нефропатии. С другой стороны, несмотря на то, что ИАПФ обычно улучшают почечный кровоток, увеличивают скорость экскреции натрия и замедляют прогрессирование хронических заболеваний почек, применение ИАПФ может сопровождаться развитием синдрома “функциональной почечной недостаточности”.
Эта форма острой почечной недостаточности (ОПН) обычно развивается вскоре после начала терапии ИАПФ, но может возникнуть и в отдаленные сроки от начала лечения, особенно у больных с ХСН.
Острую почечную недостаточность чаще всего определяют как быстрое снижение функции почек, обычно проявляющееся повышением концентрации креатинина плазмы. Хотя уровень креатинина, при котором диагностируется ОПН, точно не определен, при его повышении более чем на 0,5 мг/дл (44 мкмоль/л) у пациентов с исходным уровнем креатинина <2,0 мг/дл и более чем на 1,0 мг/дл при исходном его уровне >2,0 мг/дл, обычно можно говорить о развитии ОПН. Спектр клинических проявлений ОПН может варьировать от преходящей олигурии и бессимптомного повышения уровня креатинина плазмы до анурии [20].
Вероятность развития ОПН повышается в тех случаях, когда почечное перфузионное давление не может поддерживаться на адекватном уровне вследствие снижения среднего АД или когда скорость клубочковой фильтрации (СКФ) очень сильно зависит от уровня ангиотензина II. Исходная гипотония и низкое давление заполнения сердца могут указывать на риск развития негативных гемодинамических последствий терапии ИАПФ. Зависимость СКФ от уровня ангиотензина II становится особенно сильной при уменьшении объема внеклеточной жидкости, выраженном двухстороннем стенозе почечных артерий, а также стенозе почечной артерии функционально доминирующей или единственной почки, например, после трансплантации [21]. Наконец, ИАПФ могут повышать риск развития ОПН у больных, которые получают препараты с сосудосуживающим действием, например, нестероидные противовоспалительные препараты (НПВП) или циклоспорин А.
Риск развития ОПН на фоне терапии ИАПФ повышен также у лиц с хронической почечной недостаточностью (ХПН) любой этиологии. Уменьшение количества нефронов у больных с ХПН сопровождается компенсаторными функциональными изменениями, направленными на поддержание СКФ, в частности – гиперфильтрацией. Важным компонентом положительного действия ИАПФ у таких больных, по всей видимости, является уменьшение клубочковой гиперфильтрации за счет преимущественно эфферентной вазодилатации и снижения клубочкового капиллярного давления. Следовательно, устранение гиперфильтрации у пациентов с ХПН на первом этапе неизбежно будет сопровождаться снижением СКФ и повышением в крови уровня мочевины и креатинина. На самом деле это будет просто проявлением того, что препараты начали оказывать желательное в данном случае действие, направленное на сохранение функции почек. Практическим выводом из этих наблюдений является то, что не существует показателя уровня креатинина, при котором только его значение становится противопоказанием для назначения ИАПФ. При нарушении функции почек повышение
уровня креатинина плазмы на 10-20% от исходного является ожидаемым в начале терапии ИАПФ, и само по себе не может быть поводом для прекращения лечения. За исключением случаев неадекватного снижения среднего АД ниже уровня, необходимого для адекватной перфузии почек, во всех других ситуациях при хронических заболеваниях почек применение ИАПФ сопровождается преходящим снижением СКФ, степень которой не превышает 20%; вслед заэтим происходит стабилизация или даже снижение уровня креатинина за счет длительного ренопротективного действия ИАПФ [22].
При снижении перфузии почек происходит активация ренин-ангиотензиновой системы (РАС). В отличие от большинства сосудосуживающих веществ, которые воздействуют преимущественно на афферентные сосуды почек, ангиотензин II вызывает вазоконстрикцию как афферентных, так и эфферентных сосудов, приводя к повышению внутриклубочкового давления. При реноваскулярной гипертонии и застойной ХСН клубочковая фильтрация поддерживается за счет увеличения фильтрационного давления на фоне сужения эфферентных гломерулярных артериол. Констрикция артериол осуществляется за счет местной продукции ангиотензина II. Под действием ИАПФ, благодаря подавлению образования ангиотензина II, а возможно, и накоплению брадикинина, происходит снижение сопротивления эфферентных артериол, которое влечет за собой уменьшение клубочковой фильтрации и нарушение компенсаторного механизма.
С другой стороны, не фоне терапии ИАПФ уменьшение почечного сосудистого сопротивления вследствие снижения преF и постгломерулярной вазоконстрикции приводит к повышению почечного кровотока. Чем в большей степени увеличивается почечный кровоток, тем в меньшей степени снижается СКФ. Этот механизм отчасти компенсирует происходящее за счет ИАПФ снижение гломерулярного фильтрационного давления.
Все ИАПФ, ингибируя синтез ангиотензина II в почках, способны вызвать ухудшение функции почек. Однако в большинстве случаев оно является бессимптомным и обратимым. Нарушение функции почек, вызванное ИАПФ, во многих случаях не прогрессирует, несмотря на продолжение терапии ИАПФ.
Длительно существующая застойная сердечная недостаточность сама по себе часто сопровождается значительным ухудшением функции почек, поэтому не всегда легко отличить негативное влияние ИАПФ на функцию почек от почечной дисфункции, вызванной основным заболеванием. И все-таки, в некоторых случаях последствия ухудшения функции почек, вызванного терапией ИАПФ, могут быть серьезными и даже угрожающими жизни.
При ХСН нарушение функции почек, оцениваемое с помощью СКФ, является независимым предиктором неблагоприятного прогноза. У больных с умеренно выраженной сердечной недостаточностью уровень креатинина плазмы на фоне терапии ИАПФ либо не изменяется, либо повышается незначительно [23]. Установлено, что примерно у 30% больных с сердечной недостаточностью терапия ИАПФ вначале может приводить к достоверному повышению уровня креатинина плазмы. Однако в последующем функция почек обычно стабилизируется и дальнейшего повышения уровня креатинина не происходит. Приемлемым на фоне терапии ИАПФ считается повышение уровня креатинина плазмы <30% от исходного.
В исследовании Studies of Left Ventricular Dysfunction (SOLVD) 3379 больных с систолической дисфункцией ЛЖ (ФИ ЛЖ<35%) в течение 2,5 лет получали эналаприл или плацебо. Ухудшение функции почек (повышение уровня креатинина плазмы более чем на 0,5 мг/дл) произошло у 16% больных в группе эналаприла и у 12% пациентов группы плацебо, то есть, больные, получавшие эналаприл, имели на 4% большую вероятность развития нарушения функции почек. При мультивариационном анализе более пожилой возраст, терапия диуретиками и сахарный диабет оказались факторами, способствующими снижению функции почек на фоне лечения ИАПФ, в то время как терапия β-блокаторами и более высокая ФИ ЛЖ выступали как ренопротективные факторы [24].
Мета-анализ трех крупных рандомизированных клинических исследований эффективности ИАПФ при систолической дисфункции ЛЖ и/или сердечной недостаточности вследствие инфаркта миокарда SAVE (Survival and Ventricular Enlargement), AIRE (Acute Infarction Ramipril Efficacy) и TRACE (Trandolapril Cardiac Evaluation) выявил, что среди 5387 пациентов, получавших ИАПФ, частота нарушения функции почек составила 5,2%, а на фоне плацебо – 3,6% (p<0,0001) [25].
При наличии почечной недостаточности терапию каптоприлом следует начинать с уменьшенных доз (от 1 до 6,25 мг в день) и проводить титрование дозы очень медленно, увеличивая ее на 1 мг в день каждую неделю или две. При исходном уровне креатинина в плазме выше 142 мкмоль/л терапию эналаприлом рекомендуют начинать с дозы 2,5 мг в день, увеличивая ее на 2,5 мг каждые 4 или более дней до целевой или максимально переносимой дозы.
В обзоре Mason N.A. [26], посвященном влиянию терапии ИАПФ на функцию почек, приводятся две работы, в которых сравнивается каптоприл и длительно действующие препараты. По данным этих исследований, терапия коротко действующим ИАПФ сопровождалась меньшей частотой ухудшения функции почек. Этот факт объясняют более выраженной или более стойкой блокадой АПФ на фоне терапии длительно действующими препаратами ИАПФ. Однако при использовании в начале терапии низких доз эналаприла удавалось избежать значимого ухудшения функции почек.
Двойной путь выведения фозиноприла делает его препаратом выбора при использовании у пациентов с нарушением функции почек [27]. Доказано, что у больных со снижением СКФ <30 мл/мин индекс кумуляции фозиноприла достоверно ниже, чем лизиноприла и эналаприла. По сравнению с фозиноприлом, лизиноприл увеличивает риск лекарственой кумуляции в 2,23 раза, а эналаприл – в 1,44 раза [28].
Попытки уменьшить степень ухудшения функции почек за счет замены ИАПФ блокаторами рецепторов ангиотензина II не оправдались. В исследовании Evaluation of Losartan in the Elderly Study (ELITE) не было выявлено различий между группами лечения каптоприлом и лозартаном в количестве больных, у которых возникло стойкое повышение уровня креатинина плазмы на 26 мкмоль/л и более – в обеих группах доля таких пациентов составила 10,5%.
Сопутствующая ИАПФ терапия диуретиками или НПВП также является фактором, предрасполагающим к развитию нарушения функции почек. При одновременном приеме аспирина и ИАПФ дилатация афферентных артериол за счет действия вазодилатирующих простагландинов может подавляться, что может приводить к отсутствию увеличения почечного кровотока и быстрому снижению СКФ. Хотя некоторые НПВП, в частности сулиндак, могут оказывать менее выраженные почечные эффекты, все препараты этой группы должны использоваться с большой осторожностью при назначении одновременно с ИАПФ. Препараты из группы селективных блокаторов циклооксигеназы- 2 так же, как и неселективные НПВП, могут вызывать нарушение функции почек [29]. У больных с ХСН следует избегать одновременной терапии ИАПФ и НПВП, а в случае необходимости такой комбинации должен проводиться тщательный мониторинг функции почек.
В недавно проведенном ретроспективном исследовании [30], включавшем 576 больных с ХСН, было показано, что одновременный прием ИАПФ и аспирина сопровождается увеличением риска повторной госпитализации в течение 30 дней после выписки из стационара больных со снижением систолической функции ЛЖ, а также больных без ИБС. Для выработки более определенных рекомендаций в отношении безопасности дновременного приема ИАПФ и аспирина необходимо подтверждение этих данных в проспективном исследовании. В то же время, систематический анализ исследований применения ИАПФ и аспирина в ранние сроки после острого инфаркте миокарда, который включал данные 96 712 пациентов, показал высокую эффективность ИАПФ независимо от того, назначались они вместе с аспирином или нет [31].
У больных с застойной сердечной недостаточностью и развитием нарушения функции почек до принятия окончательного решения об отмене ИАПФ необходимо использовать несколько подходов. В тех случаях, когда снятие жестких ограничений в употреблении поваренной соли или уменьшение диуретической терапии не приводит к улучшению функции почек, можно попробовать уменьшить дозу ИАПФ.
Если терапию ИАПФ все-таки приходится прекратить, то после стабилизации функции почек можно с осторожностью возобновить ее на фоне тщательного мониторинга функции почек.
Для снижения риска ОПН, обусловленной терапией ИАПФ, необходимо с помощью тщательного обследования, включая лабораторное, выявлять больных с высоким риском ее развития. В принципе, тактика, применяемая у больных с высоким риском развития почечной недостаточности, сходна с таковой у больных с высоким риском развития гипотонии после приема первой дозы.
Хотя ИАПФ, как уже указывалось, применяют с целью уменьшения протеинурии у больных с заболеваниями почек различной этиологии, терапия ИАПФ может приводить к развитию протеинурии. В ранних исследованиях каптоприла применение высоких доз (>450 мг/сут) у больных с исходным заболеванием почек сопровождалось появлением протеинурии в 3,5% случаев, в то время как использование более низких доз ИАПФ сопровождалось развитием протеинурии в 0,6% случаев при лечении каптоприлом, 1,4% при лечении эналаприлом и 0,72% при лечении лизиноприлом [32]. Протеинурия, вызванная ИАПФ, обычно проходит самостоятельно, несмотря на продолжение терапии, поэтому при тщательном мониторинге больные могут продолжать прием ИАПФ, за исключением случаев развития нефротического синдрома. Если одновременно с протеинурией развивается азотемия, и особенно, если протеинурия достигает большой выраженности (>3 г/сут), ИАПФ необходимо отменить.
Описано 3 случая развития почечной глюкозурии, обусловленной терапией ИАПФ. В одном случае глюкозурия развилась у больного 42 лет с артериальной гипертонией на фоне приема эналаприла, в другом у мальчика 7 лет с аортитом и артериальной гипертонией на фоне каптоприла и в третьем случае – у больного 29 лет с артериальной гипертонией после трансплантации почек на фоне лизиноприла. Глюкозурия развивалась в сроки от 2 до 16 нед. от начала терапии. Механизм развития глюкозурии на фоне терапии ИАПФ точно не установлен, но предполагается влияние ИАПФ на транспортные системы в проксимальных канальцах.
Гиперкалиемия
В результате снижения секреции альдостерона все ингибиторы ИАПФ предсказуемо повышают экскрецию натрия и воды с мочой и уменьшают потери калия. Развитие гиперкалиемии на фоне терапии ИАПФ может быть связано со снижением функциипочек. Концентрация калия в плазме имеет обратную корреляцию со СКФ. У больных, имеющих клиренскреатинина ниже 40 мл/мин, уровень калия в плазме обычно превышает 5,5 ммоль/л.
Хотя все ингибиторы ИАПФ могут вызывать небольшое (клинически незначимое) повышение концентрации калия в плазме за счет снижения уровня альдостерона, серьезная гиперкалиемия встречается редко. Выраженная гиперкалиемия может возникать в тех случаях, когда повышено поступление калия или уменьшена его экскреция. Наибольший риск развития гиперкалиемии имеется у больных с исходно нарушенной функцией почек. Гипоальдостеронизм также является фактором риска развития гиперкалиемии, связанной с терапией ИАПФ. Одновременная терапия препаратами калия, калий-сберегающими диуретиками или комбинациями диуретиков, в состав которых входят калий-сберегающие препараты, также в некоторых случаях может способствовать развитию гиперкалиемии.
Для уменьшения риска развития гиперкалиемии целесообразно до начала терапии ИАПФ исследовать функцию почек и уровень электролитов в плазме.
При необходимости должна быть устранена гиповолемия. По возможности, в начале терапии ИАПФ препараты калия и калийFсберегающие диуретики лучше временно отменить. Во время лечения ИАПФ рекомендуются повторные исследования уровня электролитов в плазме, более частые при повышении дозы ИАПФ и применении лекарств, которые способствуют развитию гиперкалиемии, а также в случае нарушения функции почек.
Кашель
Отрывистый сухой кашель является наиболее частым побочным эффектом ИАПФ, требующем их отмены. Впервые развитие кашля на фоне ИАПФ было описано в 1985 г. при лечении каптоприлом. Частота развития кашля, обусловленного терапией ИАПФ, по данным литературы, колеблется от 0,7% до 44%.
В первых клинических исследованиях кашель вообще не расценивался как побочное действие ИАПФ, а в ранних работах частота выявления кашля на фоне терапии ИАПФ составляла всего 1-2%.
Кашель может развиваться на фоне лечения любым препаратом из группы ИАПФ. Данные о том, что некоторые препараты реже вызывают кашель, противоречивы. Существующее в настоящее время мнение о более высокой частоте кашля на фоне терапии каптоприлом и эналаприлом может быть обусловлено только тем, что эти препараты первыми появились на рынке и назначаются наиболее часто. Одни авторы выявили одинаковую частоту кашля при лечении каптоприлом или эналаприлом, в то время как другие установили, что частота кашля на фоне эналаприла была почти в 2 раза выше по сравнению с каптоприлом.
Вероятность появления кашля на фоне ИАПФ не зависит от возраста, курения и гиперреактивности бронхов, но почти в 2 раза чаще встречается у женщин, чем у мужчин. Данные ретроспективного анализа указывают на достоверные половые различия в частоте развития кашля на фоне ИАПФ, который возникает, в среднем, у 14,6% женщин и 6,0% мужчин. Считается, что такие различия можно объяснить более низким кашлевым порогом у женщин по сравнению с мужчинами.
Принадлежность к определенным расам (негроидной и желтой) является фактором риска развития кашля на фоне терапии ИАПФ. Так, исследование, проведенное в Гонконге у больных китайцев с сердечной недостаточностью, установило, что стойкий кашель развивается у 44% получавших ИАПФ (у 46% больных, получавших каптоприл, и у 41,8% больных, получавших эналаприл). При этом не установлено взаимосвязи между дозой ИАПФ и развитием кашля.
Причина расовых различий в частоте появления кашля на фоне терапии ИАПФ точно не установлена. Обсуждаются расовые различия в фармакокинетике и фармакодинамике ИАПФ, а также чувствительности кашлевого рефлекса.
У больных с ХСН кашель развивается достоверно чаще, чем у пациентов с артериальной гипертонией, в 26% и 15% случаев, соответственно. Кашель, обусловленный ИАПФ, при ХСН обычно появляется раньше, чем при гипертонии.
Считается, что ни одна из гипотез о причинах развития кашля на фоне терапии ИАПФ не может адекватно объяснить природу этого побочного эффекта.
Наиболее частым механизмом считают повышение на фоне ингибирования АПФ уровня брадикинина.
Ингибирование АПФ в легких может приводить к накоплению брадикинина в верхних дыхательных путях, способствуя развитию кашля. Брадикинин стимулирует немиелинизированные афферентные чувствительные С волокна за счет воздействия на рецепторы J типа, участвующие в кашлевом рефлексе.
Деградация субстанции P – нейротрансмиттера для афферентных чувствительных нервов, и особенно С волокон – также осуществляется за счет АПФ. Следовательно ингибирование АПФ может сопровождаться усилением влияния этой субстанции. Синтез простагландина Е, вызываемый брадикинином и субстанцией Р, может оказывать бронхо-констрикторное действие.
Предполагается наличие генетической предрасположенности к развитию кашля на фоне терапии ИАПФ. Изучение полиморфизма гена АПФ выявило, что примерно 16% людей являются гомозиготными по длинному аллелю этого гена. Так что частота возникновения кашля среди пациентов, получающих ИАПФ, примерно совпадает с частотой выявления гомозиготности по длинному аллелю гена АПФ. Пациенты, являющиеся гомозиготами по этому аллелю имеют более низкие концентрации АПФ. Меньшая концентрация АПФ может обуславливать более высокие уровни брадикинина, субстанции Р и простагландинов, что и приводит к развитию кашля.
Кашель, вызываемый ИАПФ, обычно характеризуется ощущением щекотания в задней стенке глотки.
Кашель обычно сухой, отрывистый, длительный и пароксизмальный. Он может усиливаться в горизонтальном положении и быть настолько сильным, что вызывает охриплость, рвоту и недержание мочи в момент кашля. Кашель не сопровождается значимым изменением функции легких, признаками бронхиальной обструкции или гиперчувствительности. Появление кашля, вероятно, не зависит от дозы ИАПФ, и он может возникать при низких дозах. Тем не менее, в одном исследовании было отмечено, что снижение дозы ИАПФ приводит к уменьшению выраженности кашля. Кашель бывает настолько выраженным, что влияет на согласие больного продолжать лечение ИАПФ.
Время от начала лечения ИАПФ до развития кашля может составлять от 24 ч. до 1 года. Ретроспективный анализ случаев развития кашля на фоне ИАПФ выявил, что от начала терапии до первого сообщения о появлении кашля проходит в среднем 14,5 нед., а до установления взаимосвязи кашля с приемом ИАПФ – 24 нед.
Несмотря на то, что кашель признается побочным эффектом ИАПФ, которое скорее доставляет пациенту беспокойство, чем представляет какую-либо опасность, до 50% больных самостоятельно прекращают лечение при возникновении кашля. Доказано, что среди больных, у которых на фоне ИАПФ развился кашель, качество жизни хуже, а уровень депрессивности выше по сравнению с пациентами, у которых кашель не возникал.
Доказательство взаимосвязи между приемом препарата и развитием кашля остается сложной проблемой. Обычно в медицинской документации кашель, обусловленный ИАПФ, рассматривается вначале как проявление другой патологии (инфекции, аллергии, обструктивных заболеваний легких, гастроэзофагального рефлюкса). Кроме того, в ряде случаев кашель действительно может быть обусловлен причинами, не связанными с действием ИАПФ (бронхиальная астма, пневмония, хронический бронхит, ларингит, инфекции верхних дыхательных путей, туберкулез легких, левожелудочковая недостаточность, рак легких, митральный стеноз, тромбоэмболия легочной артерии, курение).
Диагностическая трудность в идентификации кашля, обусловленного ИАПФ, связана также с тем, что он чаще появляется ночью и иногда усиливается в горизонтальном положении. У больных с застойной сердечной недостаточностью эти явления иногда трудно отличить от проявлений пароксизмальной ночной одышки.
Так как кашель может возникать при приеме всех ИАПФ, замена одного ИАПФ на другой вряд ли окажет какое-либо действие. Однако есть несколько сообщений, в которых отмечается факт исчезновения кашля после замены одного ИАПФ на другой: квинаприла на фозиноприл, а также каптоприла на эналаприл.
Для того, чтобы определить, вызван ли кашель приемом ИАПФ, рекомендуется отмена препарата на 4 дня. Хотя обычно кашель полностью проходит в течение 1-7 дней, иногда этот срок увеличивается до 2 нед. После возобновления терапии тем же или другим ИАПФ кашель может появиться вновь.
Нет однозначного ответа на вопрос о том, в каких случаях при развитии кашля следует отменять ИАПФ. Больные, получающие ИАПФ по поводу артериальной гипертонии, могут быть переведены на прием препаратов другого класса. У пациентов с сердечной недостаточностью и больных, перенесших инфаркт миокарда, ИАПФ остаются препаратами выбора. Блокаторы рецепторов ангиотензина II, хотя и являются возможной альтернативой ИАПФ в этой ситуации, их преимущества перед ИАПФ у этой категории больных не доказаны. Таким образом, остается актуальным поиск путей к уменьшению кашля, обусловленного ИАПФ.
В нескольких небольших исследованиях изучали фармакологические подходы к уменьшению кашля, возникающего за счет терапии ИАПФ. Некоторые из исследуемых препаратов действуют на общие механизмы развития кашля, в то время как другие влияют на те патофизиологические механизмы, которые считаются специфическими для развития кашля, вызванного ИАПФ.
Противокашлевые препараты, назначаемые на срок 1-4 нед. давали лишь временный эффект. В принципе эти препараты считаются неэффективными для подавления кашля, обусловленного ИАПФ.
Хромогликат натрия наиболее изученный препарат для предупреждения кашля, обусловленного ИАПФ. Он является стабилизатором тучных клеток, обладает способностью подавлять высвобождение таких медиаторов воспаления, как гистамин, брадикинин и простагландины. Считается, что хромогликат снижает стимуляцию бронхиальных С нервных волокон и за счет этого уменьшает кашель, вызываемый ИАПФ.
В 2-х недельном плацебо-контролируемом перекрестном исследовании у 10 больных с ХСН и кашлем, развившемся на фоне ИАПФ, изучали эффективность хромогликата в дозе 2 вдоха 4 раза в день. С целью провокации кашля и установления исходной кашлевой чувствительности использовали ингаляции капсаицина. У 9 из 10 пациентов применение хромогликата по сравнению с плацебо сопровождалось достоверным уменьшением кашля (p<0,01), однако ни у одного пациента кашель не исчез полностью.
Баклофен – агонист γ-аминомасляной кислоты, назначается при мышечной спастичности. Баклофен подавляет высвобождение субстанции Р в легких. К дополнительным предполагаемым свойствам баклофена относят способность подавления центрального кашлевого рефлекса, что может определять его эффективность при кашле различного происхождения.
Эффективность баклофена при лечении кашля, возникшего на фоне терапии каптоприлом, эналаприлом или фозиноприлом изучалась в 4-х недельном проспективном открытом исследовании. Семь пациентов получали баклофен в дозе 5 мг 3 раза в день с 1-го по 7-й день исследования и в дозе 10 мг 3 раза в день – с 8-го по 28-й день. Уменьшение кашля отмечалось на 4-й день, а максимальный эффект – в среднем, на 11-й день. У 6 больных отмечалось полное исчезновение ночного кашля. У всех пациентов достигнутое уменьшение кашля сохранялось через 28-74 дня после отмены баклофена, а у одного пациента кашель полностью прекратился. Необходимо подтверждение этих результатов в плацебо-контролируемом исследовании.
Теофиллин, по имеющимся данным, помимо бронходилатирующего действия, обладает противовоспалительными свойствами, которые могут обуславливать уменьшение кашля, вызванного ИАПФ. Возможный механизм действия теофиллина связывают с подавлением субстанции Р в чувствительных нервных волокнах дыхательных путей.
В двойном слепом рандомизированном плацебо-контролируемом перекрестном исследовании у 10 пациентов изучали влияние теофиллина в дозе 8,5 мг/кг один раз в день в течение 2-х нед. на кашлевую чувствительность к капсаицину. В период лечения теофиллином полное подавление кашля отмечено у 8 пациентов. Описано также, что терапия теофиллином в дозе 200 мг 2 раза в день при приеме внутрь сопровождалась полным прекращением кашля у 4 женщин, получавших каптоприл по поводу артериальной гипертонии.
Сулиндак – ингибитор циклооксигеназы, который может играть потенциальную роль в предотвращении кашля, обусловленного ИАПФ, за счет подавления синтеза простагландинов и снижения уровня брадикинина. Способность сулиндака подавлять кашель, обусловленный ИАПФ, была обнаружена при наблюдении за пятью пациентами, у которых кашель изменился на фоне приема сулиндака в дозе 100 мг 2 раза в день. У четырех больных кашель прошел полностью, а у пятого кашель возобновлялся только за 2 ч. до приема очередной дозы сулиндака.
Эффективность сулиндака была подтверждена в небольшом двойном слепом рандомизированном плацебо-контролируемом перекрестном исследовании, включавшем 6 больных с артериальной гипертонией и кашлем, развившемся на фоне терапии эналаприлом или каптоприлом. Терапия сулиндаком в дозе 200 мг/сут проводилась в течение 1 нед. Прием сулиндака сопровождался статистически значимым уменьшением чувствительности кашлевого рефлекса к капсаицину и уменьшением кашля (p<0,05 для обоих показателей).
Учитывая нецелесообразность назначения НПВП у пациентов с ХСН или диабетической нефропатией из-за негативного влияния на функцию почек, данный подход к уменьшению кашля, по-видимому, нельзя считать приемлемым.
Препараты железа. Недавно было проведено рандомизированное плацебо-контролируемое исследование, показавшее, что у больных с кашлем, индуцированным ИАПФ, прием 256 мг сульфата железа в течение 4-х нед. позволяет достоверно уменьшить выраженность кашля [34]. Среднее значение шкалы кашля достоверно снижалось в группе приема железа (с 3,07±0,70 до 1,69±1,10; p<0,05) и не изменялось в группе плацебо (с 2,57±0,80 до 2,35±1,22; p>0,05). У трех больных в группе железа отмечено полное прекращение кашля. В обеих группах не выявлено достоверного изменения лабораторных показателей, включая показатели периферической крови, уровень железа и ферритина плазмы. Возможным механизмом действия железа считают уменьшение синтеза NO за счет подавления активности фермента NO-синтазы в эпителиальных клетках бронхов.
Таким образом, все исследования эффективности медикаментозной терапии, направленной на уменьшение кашля, обусловленного ИАПФ, слишком малы для того, чтобы представить убедительные доказательства способности медикаментозных препаратов предотвращать развитие этого распространенного побочного эффекта ИАПФ.
Ангионевротический отек
Ангионевротический отек при приеме ИАПФ встречается с частотой 0,1-0,3 % и является потенциально угрожающим жизни побочным эффектом.
Данное осложнение обычно проявляется локальным отеком губ, языка, слизистой ротовой полости, гортани, носа и других частей лица.
Механизм развития этого побочного эффекта ИАПФ связывают с действием брадикинина или одного из его метаболитов. Ангионевротический отек может быть обусловлен продукцией простагландинов, которые вызывают высвобождение гистамина.
Таким образом, данное побочное действие является проявлением фармакологического действия ИАПФ, которое, возможно, становится избыточным у лиц с генетически повышенной чувствительностью.
Все ИАПФ могут вызывать это осложнение. Чаще оно развивается в начале терапии ИАПФ, но может появляться и при длительном лечении. При анализе 163 сообщений о развитии ангионевротического отека на фоне терапии ИАПФ у 21% больных он развивался в течение 24 ч. от начала лечения, а у 20% – через 6 мес. и более. В среднем же, развитие ангионевротического отека отмечалось через 3 нед. от начала терапии.
Ангионевротический отек был отмечен также и на фоне лечения ИАПФ с наиболее безопасным профилем – периндоприлом. Хотя частота его выявления при анализе данных 47 351 больного с артериальной гипертонией, участвовавших в постмаркетинговом исследовании, была невысокой и составляла всего 0,006%, при лечении 320 пациентов с ХСН она достигала 0,3%. Существуют данные о большей предрасположенности лиц негроидной расы к развитию ангионевротического отека [35], что согласуется с данными о существовании расовых различий и в частоте возникновения других побочных эффектов ИАПФ [36].
Обычно данное осложнение проявляется умеренной симптоматикой, которая проходит в течение нескольких дней после прекращения терапии ИАПФ.
Однако в редких случаях ангионевротический отек может проявляться такими выраженными симптомами, как респираторный дистресс, вызванный ларингоспазмом, отеком гортани и обструкцией воздухоносных путей и приводить к летальному исходу. Причем, даже при развитии выраженного ангионевротического отека, обусловленного терапией ИАПФ, требующего лечения в условиях отделения интенсивной терапии, в большинстве случаев взаимосвязь отека с терапией ИАПФ не распознается, особенно, когда ангионевротический отек развивается в отдаленный период от начала терапии ИАПФ. Некоторые авторы указывают на то, что истинная частота ангионевротического отека, обусловленного терапией ИАПФ, выше, чем это принято считать. Так, при анализе 4970 случаев обращения к аллергологу ангионевротический отек был диагностирован в 122 случаях и в 10 из них он был обусловлен терапией ИАПФ, то есть, в 8,2% случаев ангионевротического отека его причиной оказалась терапия ИАПФ.
К редкой локализации ангионевротического отека относят тонкий кишечник. Ангионевротический отек кишечника может развиваться как в сочетании с отеком лица и ротовой полости, так и в виде изолированного висцерального ангионевротического отека [37].
Chase M.P. et al. [38] описывают два эпизода этого осложнения у 72-летней женщины, которые проявлялись жалобами на боли в животе, рвоту и диарею.
Компьютерная томография во время обоих эпизодов выявляла отек стенки тонкого кишечника. Анализ анамнестических данных показал, что за 1 мес. До первого эпизода больная начала лечение лизиноприлом, доза которого увеличивалась за 24 ч. до каждого эпизода ангионевротического отека. После отмены ИАПФ эпизоды ангионевротического отека не повторялись в течение 1 года наблюдения.
Больные, у которых на фоне терапии ИАПФ отмечались проявления ангионевротического отека любой выраженности (включая и легкие симптомы), не должны в дальнейшем получать терапию ИАПФ.
Больные с указанием на идиопатический ангионевротический отек в анамнезе могут иметь повышенный риск развития этого осложнения при приеме ИАПФ.
Кожные сыпи
Высокая частота развития кожной сыпи была выявлена в начальных исследованиях каптоприла. При этом считалось, что она связана с наличием сульфгидрильной группы в составе молекулы каптоприла. Однако оказалось, что высокая частота сыпи в этих исследованиях была, скорее всего, обусловлена большой дозой каптоприла (600-1200 мг/сут). Последующие исследования, в которых применялись меньшие дозы (<150 мг/сут), выявляли меньшую частоту сыпи.
Сыпь появляется у 1-5% больных, получающих ИАПФ по поводу артериальной гипертонии. Кожная сыпь, обусловленная терапией ИАПФ, в большинстве случаев представляет собой зудящую макулопапуллезную сыпь, локализующуюся на руках и верхней части туловища. Сыпь обычно развивается в течение первых 4-х нед. от начала терапии (наиболее часто – в течение первых нескольких дней). Сыпь чаще бывает преходящей, сохраняющейся только несколько часов или дней, поэтому ее появление не всегда требует отмены ИАПФ.
Развитие сыпи связывают с ингибирующим влиянием ИАПФ на кининазу II (фермент, идентичный АПФ). Ингибирование активности кининазы II приводит к потенцированию активности кининов в коже и развитию опосредуемых гистамином воспалительных реакций. Развитие сыпей, в основе которых лежит этот механизм, можно ожидать при лечении всеми ИАПФ. Однако сообщения об отсутствии перекрестной реактивности между каптоприлом и эналаприлом в отношении кожной сыпи могут указывать на существование нескольких механизмов этого побочного действия. Таким образом, если сыпь появляется на фоне приема какого-либо ИАПФ, то, вероятно, целесообразно попытаться использовать другой препарат этой группы.
Дисгевзия и “синдром обожженного языка”
Ингибиторы АПФ иногда вызывают нарушения вкусовой чувствительности (дисгевзию). Этот эффект по-разному описывается больными как потеря вкуса, появление металлического привкуса, появление сладкого привкуса или извращение вкуса. Частота развития нарушений вкусовой чувствительности при приеме каптоприла в дозах меньше 150 мг/сут составляет от 0,1% до 3%, а при дозах больше 150 мг/сут увеличивается до 7,3%. Ранее дисгевзия чаще описывалась при лечении каптоприлом по сравнению с другими ИАПФ. Хотя нарушения вкусовой чувствительности связывают с наличием сульфгидрильной группы, содержащейся в молекуле каптоприла, эти нарушения встречаются на фоне терапии эналаприлом и лизиноприлом, которые не содержат этой группы.
Это позволяет предположить, что данное побочное действие может быть общим для всех ИАПФ.
Нарушения вкуса часто являются обратимыми и проходят самостоятельно (во многих случаях они существуют только в течение 2-3 мес., несмотря на продолжение терапии). Тем не менее, дисгевзия негативно влияет на качество жизни больных, уменьшает приверженность к лечению и даже может сопровождаться снижением массы тела.
Предрасполагающим к нарушению вкусовой чувствительности фактором является дефицит цинка, возникающий при циррозе и других хронических заболеваниях печени, но терапия цинком может не оказывать влияния на нарушения вкусовой чувствительности, вызванной ИАПФ. Описан случай устранения неприятного сладковатого привкуса во рту, обусловленного терапией каптоприлом, после назначения внутрь селенция метионина.
“Синдром обожженного языка” проявляется ощущениями жжения в языке, горле, губах и/или небе, которые сходны с таковыми при ожоге горячими напитками или острыми блюдами. “Синдром обожженного языка” является редким осложнением терапии ИАПФ и отличается от афтозного стоматита и язв языка, которые также описывают как осложнения терапии ИАПФ. Развитие “синдрома обожженного языка” отмечено при лечении каптоприлом, эналаприлом и лизиноприлом, но, вероятно, он может появляться на фоне терапии всеми ИАПФ. Данное осложнение не связанос нарушениями вкусовой чувствительности, обусловленными ИАПФ, а механизм его развития не установлен.
Гематологические эффекты
Ингибиторы АПФ обычно вызывают небольшое снижение уровня гемоглобина и гематокрита, которое для большинства больных не имеет клинического значения. Описаны случаи развития апластической анемии на фоне терапии каптоприлом. Сообщалось также о развитии апластической анемии у двух больных при лечении лизиноприлом в дозе 5 мг в сутки; причем в обоих случаях больные были пожилого и старческого возраста (64 и 79 лет). Развитие апластической анемии в одном случае отмечено через 6 мес. от начала лечения лизиноприлом, а в другом – через 15 дней. После трансплантации почек анемия, обусловленная приемом ИАПФ, вероятнее всего, развивается вследствие снижения уровня эритропоэтина.
Нейтропения и агранулоцитоз являются относительно редкими побочными эффектами терапии ИАПФ. При использовании высоких доз каптоприла (150 мг в день или более) и у тяжелых больных частота развития нейтропении возрастает. Так, у больных с нормальным уровнем креатинина плазмы и отсутствием диффузных заболеваний соединительной ткани частота развития нейтропении на фоне терапии каптоприлом составляла 0,02%, а у больных с системной красной волчанкой или склеродермией при повышении уровня креатинина >177 мкмоль/л она увеличивалась до 7,2%. Другие аутоиммунные заболевания также повышают риск развития нейтропении, обусловленной ИАПФ. Вероятно, это связано с возможностью ИАПФ индуцировать образование антинуклеарных антител. Нейтропения, имеющая вероятный аутоиммунный генез, развивается примерно у 7% больных аутоиммунными заболеваниями, получающих каптоприл. Кроме того, риск нейтропении возрастает при одновременном назначении цитостатиков и каптоприла. Отмечено также, что значительное увеличение риска развития гранулоцитопении возникает при одновременном назначении интерферона и ИАПФ [39].
Гепатотоксичность
Гепатотоксичность – редкое, но серьезное побочное действие терапии ИАПФ. Гепатотоксичность отмечена при лечении каптоприлом, эналаприлом и лизиноприлом. Перекрестное действие препаратов ИАПФ в отношении гепатотоксичности означает возможность ее развития на фоне терапии всеми препаратами ИАПФ.
Из 17 больных, у которых описано развитие гепатотоксичности, 14 получали ИАПФ по поводу артериальной гипертонии и 3 – по поводу застойной сердечной недостаточности. Почечная недостаточность отмечалась у 5 из этих больных, 4 из них нуждались в проведении гемодиализа. Желтуха была наиболее частым клиническим проявлением гепатотоксичности, обусловленной терапией ИАПФ. В некоторых случаях желтуха развивалась через некоторое время после выявления бессимптомного повышения уровня щелочной фосфатазы или трансаминаз. При анализе лабораторных показателей, в 13 случаях отмечались признаки холестатического поражения и ни в одном не отмечено чисто гепатоцеллюлярного поражения. У всех пациентов было произведено морфологическое исследование печени.
При этом в 8 случаях отмечены признаки холестатического поражения, в 2 – смешанного поражения, в 2 – признаки некроза гепатоцитов и в 1 случае – признаки гепатоцеллюлярного повреждения. В большинстве случаев после отмены ИАПФ происходила нормализация уровня печеночных ферментов в сроки от 2 нед. до 9 мес. после прекращения терапии.
Механизм развития гепатотоксичности на фоне терапии ИАПФ не ясен. Предполагаемые механизмы гепатотоксичности: воздействие сульфгидрильной группы каптоприла и реакции гиперчувствительности. Помимо этого, подавление за счет ИАПФ активности кининазы II приводит к увеличению содержания брадикинина. Увеличение содержания брадикинина может увеличивать трансформацию арахидоновой кислоты в простагландины. Простагландины и лейкотриены, являющиеся продуктами метаболизма арахидоновой кислоты, играют важную роль в функционировании гепатобилиарной системы. И, хотя простагландины обычно оказывают защитное действие на гепатобилиарную систему, избирательное повышение синтеза отдельных простагландинов может вызывать опосредуемый через ИАПФ холестаз. В частности, установлено, что простагландин А1 снижает скорость потока желчи у собак, а 16,16-диметил-простагландин Е2 – у людей. Лейкотриены обладают более определенным гепатотоксическим действием. О гиперчувствительности как механизме развития гепатотоксичности на фоне терапии ИАПФ говорят данные биопсии печени, выявляющей в большинстве случаев холестатическое поражение, характерное для реакций такого типа.
Негативное влияние на плод
Негативное влияние на плод определяет противопоказание к назначению ИАПФ во время беременности. Каптоприл и эналаприл легко проникают через плаценту и приводят к возникновению осложнений у плода и новорожденного. Побочные эффекты на плод возникают при приеме всех ИАПФ. Возможным механизмом отрицательного влияния на плод является снижение плацентарного кровотока за счет вазоконстрикторного действия брадикинина на сосуды плаценты.
Исследования на животных показали, что ИАПФ не обладают тератогенным эффектом на ранних стадиях беременности во время фазы органообразования, но опасны на поздних стадиях беременности (во время периода развития плода). Эти эффекты могут быть обусловлены выраженной артериальной гипотонией у плода во время второго и третьего триместра беременности. Терапия ИАПФ во время беременности приводила к недостатку объема амниотической жидкости (олигогидрамниону), почечной недостаточности плода и новорожденного, смерти плода и новорожденного, к неонатальной анемии, гипоплазии легких. С терапией ИАПФ во время беременности связывали пороки развития затылочной части черепа, но на этот счет нет однозначного мнения.
Женщины репродуктивного возраста, получающие терапию ИАПФ, должны использовать эффективные контрацептивные средства. Если женщины детородного возраста с артериальной гипертонией принимают ИАПФ, то следует помнить о необходимости в случае беременности перевода больной на прием антигипертензивного препарата из другой группы.
При наступлении незапланированной беременности у женщин, получающих ИАПФ, тактика зависит от срока беременности. Так, существуют данные о том, что экспозиция ИАПФ в ранние сроки беременности сопровождается небольшим риском негативного воздействия на плод, и в этих случаях прерывание беременности необязательно. Однако полная безопасность в отношении плода даже при приеме ИАПФ в первый триместр беременности не гарантируется. Во всех случаях необходимо тщательное медицинское наблюдение.
Заключение
Таким образом, спектр побочных действий ИАПФ достаточно широк. Учитывая, что во многих клинических ситуациях альтернативы ИАПФ в настоящее время нет, необходимо более тщательно подходить к анализу побочных эффектов этих препаратов, чтобы обеспечить безопасность терапии и своевременно принимать меры для устранения или уменьшения выраженности побочных эффектов [40]. Более тщательный мониторинг терапии ИАПФ, вероятно, позволит улучшить клиническую эффективность лечения больных сердечно-сосудистыми заболеваниями в условиях практического здравоохранения.
Литература
1.Brown NJ, Vaughan DE. Angiotensin-Converting Enzyme Inhibitors// Circulation. 1998;97:1411-1420.
2. Zusman RM. Effects of converting-enzyme inhibitors on the reninangiotensinFaldosterone, bradykinin, and arachidonic acidprostaglandin systems: correlation of chemical structure and biologic activity// Am. J. Kidney. Dis. 1987;10(Suppl 1):13-23.
3. Mira ML, Silva MM, Manso CF. The scavenging of oxygen free radicals by angiotensin converting enzyme inhibitors: the importance of the sulfhydryl group in the chemical structure of the compounds//Ann. N. Y. Acad. Sci. 1994;723:439-441.
4. Ferner RE. Adverse effects of angiotensin-converting-enzyme inhibitors//Adv. Drug. React. Bull. 1990;141:528-531.
5. Warner NJ, Rush JE. Safety profiles of the angiotensin-converting enzyme inhibitors//Drugs. 1988;35 (Suppl.5):89-97.
6. Oster J.R., Materson B.J. Renal and electrolyte complications of congestive heart failure and effects of therapy with angiotensin-converting enzyme inhibitors//Arch. Intern. Med. 1992:152:704-710.
7. Reid JL, MacFadyen RJ, Squire IB, Lees KR. Angiotensin-converting enzyme inhibitors in heart failure: blood pressure changes after the first dose// Am. Heart. J. 1993;126:794-797.
8. Webster J. Angiotensin converting enzyme inhibitors in the clinic: first dose hypotension//J. Hypertens. 1994;5:S27-S30.
9. Yajnik VH, Vatsraj DJ, Acharya HK. et. al. Ramipril vs captopril in mild to moderate hypertension// J. Assoc. Physicians. India 1994;42(2):120-123.
10. Parish R.C., Miller L.J. Adverse effects of angiotensin converting enzyme (ACE) inhibitors. An update. Drug Saf. 1992;7:14-31
11. DiBianco R. ACE inhibitors in the treatment of heart failure//Clin. Cardiol. 1990;13:VII-32-VII-38.
12. ACE inhibitor first dose effect (editorial) // Med. J. Aust 1993;158:208.
13. Navookarasu NT, Rahman AR, Abdullah I. First-dose response to angiotensin-converting enzyme inhibition in congestive cardiac failure: a Malaysian experience//Int. J. Clin. Pract. 1999;53:25-30.
14. ISIS-4 (Fourth International Study of Infarct Survival) Collaborative Group. ISIS-4: A randomised factorial trial assessing early oral captopril, oral mononitrate, and intravenous magnesium sulphate in 58 050 patients with suspected acute myocardial infarction//Lancet. 1995;345;669-685.
15. Desachy A, Normand S, Francois B. et. al. Refractory shock after converting enzyme inhibitor administration. Usefulness of angiotensin II//Presse. Med. 2000;29(13):696-698.
16. Routledge HC, Townend JN. ACE inhibition in aortic stenosis: dangerous medicine or golden opportunity? //Hum. Hypertens .2001;15(10):659-667.
17. Martinez Sanchez C, Henne O, Arceo A. et. al. Hemodynamic effects of oral captopril in patients with critical aortic stenosis//Arch. Inst. Cardiol. Mex. 1996;66(4):322-330.
18. Weinberg EO, Schoen FJ, George D. et. al. Angiotensin-converting enzyme inhibition prolongs survival and modifies the transition to heart failure in rats with pressure overload hypertrophy due to ascending aortic stenosis//Circulation. 1994;90(3):1410-1422.
19. Friedrich SP, Lorell BH, Rousseau MF. et. al. Intracardiac angiotensin-converting-enzyme inhibition improves diastolic function in patients with left ventricular hypertrophy due to aortic stenosis//Circulation. 1994;90(6):2761-2771.
20. Wynckel A, Ebikili B, Melin JFP. et. al. Long-term follow-up of acute renal failure caused by angiotensin converting enzyme inhibitors// Am. J. Hypertens. 1998:11(9):1080-1086.
21. Dzau VJ. Renal effects of angiotensinFconverting enzyme inhibition in cardiac failure// Am. J. KidFney. Dis. 1987;10:74–80.
22. Apperloo AJ, de Zeeuw D, de Jong PE. A shortFterm antihypertensive treatmentFinduced fall in glomerular filtration rate predicts longterm stability of renal function//Kidney. Int. 1997;51:793-797.
23. Dietz R, Nagel F, Osterziel KJ. Angiotensin-converting-enzyme inhibitors and renal function in heart failure// Am. J. Cardiol. 1992;70:119C-125C.
24. Knight EL, Glynn RJ, McIntyre KM. et. al. Predictors of decreased renal function in patients with heart failure during angiotensinconverting-enzyme inhibitor therapy: results from the studies of left ventricular dysfunction (SOLVD)//Am. Heart. J. 1999;138(5 Pt 1):849-855.
25. Flather MD, Yusuf S, Kшber L. et. al. Long-term ACE-inhibitor therapy in patients with heart failure or leftventricular dysfunction: a systematic overview of data from individual patients// Lancet. 2000; 355(9215):1575-1581.
26. Mason NA. AngiotensinFconvertingFenzyme inhibitors and renal function// Ann. Pharmacother. 1990;24(5):496-505.
27. Hui KK, Duchin KL, Kripalani KJ. et. al. Pharmacokinetics of fosinopril in patients with various degrees of renal function//Clin. Pharmacol. Ther. 1991;49(4):457-467.
28. Greenbaum R, Zucchelli P, Caspi A, Nouriel H, Paz R, Sclarovsky S, O’Grady P, Yee KF, Liao WC, Mangold B. Comparison of the pharmacokinetics of fosinoprilat with enalaprilat and lisinopril in patients with congestive heart failure and chronic renal insufficiency//Br. J. Clin. Pharmacol. 2000;49(1):23-31.
29. Breyer MD, Hao C, Qi Z. Cyclooxygenase-2 selective inhibitors and the kidney// Curr. Opin. Crit. Care. 2001;7(6):393-400.
30. Harjai KJ, Nunez E, Turgut T, Newman J. Effect of combined aspirin and angiotensin-converting enzyme inhibitor therapy versus angiotensinFconverting enzyme inhibitor therapy alone on readmission rates in heart failure//Am. J. Cardiol. 2001;87(4):483-487.
31. Latini R, Tognoni G, Maggioni AP. et. al. Clinical effects of early angiotensin-converting-enzyme inhibitor treatment for acute myocardial infarction are similar in the presence and absence of aspirin: systematic overview of individual data from 96,712 randomized patients. AngiotensinFconverting Enzyme Inhibitor Myocardial Infarction Collaborative Group//J. Am. Coll. Cardiol. 2000;35(7):1801-1807.
32. Armayer G.M., Lopez L.M. Lisinopril: a new angiotensin-converting-enzyme inhibitor// Drug. InFtell. Clin. Pharm. 1988;22:365-372
33. Persson CGA, Draco AB. Xanthines as airway antiinflammatory drugs// J. Allergy. Clin. Immunol. 1988;81:615-616.
34. Lee SC, Park SW, Kim DK. et. al. Iron supplementation inhibits cough associated with ACE inhibitors // Hypertension. 2001;38(2):166-170.
35. Brown NJ, Nadeau JH. Does race predispose to angiotensinassociated angioneurotic edema? (letter)//Ann. Intern. Med. 1993;119:1224.
36. Chan WK, Chan TY, Luk WK. et. al. A high incidence of cough in Chinese subjects treated with angiotensinconverting-enzyme inhibitors//Eur. J. Clin. Pharmacol. 1993;44:299-300.
37. Smoger SH, Sayed MA. Simultaneous mucosal and small bowel angioedema due to captopril// South. Med. J. 1998;91(11):1060-1063.
38. Chase MP, Fiarman GS, Scholz FJ. et. al. Angioedema of the small bowel due to an angiotensin-converting-enzyme inhibitor// J. Clin. Gastroenterol 2000;31(3):254-257.
39. Casato M, Pucillo LP, Leoni M. et. al. Granulocytopenia after combined therapy with interferon and angiotensin-converting-enzyme inhibitors: evidence for a synergistic hematologic toxicity//Am. J. Med. 1995;99(4):386-391.
40. Bart BA, Ertl G, Held P. et. al. Contemporary management of patients with left ventricular systolic dysfunction. Results from the Study of Patients Intolerant of Converting Enzyme Inhibitors (SPICE) Registry// Eur. Heart. J. 1999;20(16):1182-1190.
Поступила 4/04/2005
Комментарии
ПРАКТИКА ПЕДИАТРА
