Перспективные направления клинического применения N-ацетилцистеина
СтатьиОпубликовано в журнале:
«Фарматека», 2008, № 4, с. 48-52
В.В. Деньгин
Москва
В клинической практике N-ацетилцистеин (N-АЦ) традиционно применяют в качестве отхаркивающего и противовоспалительного препарата. В последние годы выявлены новые механизмы антиоксидантного, глутатион-заместительного, детоксицирующего действия N-АЦ. Это позволило использовать его для лечения интоксикаций (ацетаминофеном, свинцом и т. д.), профилактики и терапии артериальной гипертензии, атеросклероза, токсических реакций на введение рентгеноконтрастных веществ и химиотерапию. В созданном ВОЗ реестре клинических испытаний эффективность N-АЦ изучают преимущественно при контраст-индуцированной нефропатии, кардиохирургических вмешательствах, лечении хронической обструктивной болезни легких, интоксикаций, онкологических заболеваний, сахарного диабета.
N-ацетилцистеин (N-АЦ) используют в клинической практике уже несколько десятков лет, причем в последние годы спектр показаний к его примененению расширяется и помимо традиционных – в качестве отхаркивающего и противовоспалительного препарата – включает новые направления, связанные с антиоксидантным и детоксицирующим действиями.
Среди клинических испытаний N-АЦ, зарегистрированных в реестре ВОЗ [1], почти треть посвящена применению препарата для профилактики контраст-индуцированной нефропатии – КИН (см. таблицу), в основном при различных кардиохирургических вмешательствах и манипуляциях на периферических артериях, проводимых в т. ч. и на фоне почечной недостаточности. Препарат применяют также при лечении собственно почечной недостаточности (10 % исследований), причем как на додиализной стадии, так и при диализе. В целом нефрологические аспекты выявлены почти в половине всех исследований. Использованию N-АЦ в пульмонологии посвящена только восьмая часть зарегистрированных в реестре исследований, в основном – его традиционному применению при бронхитах; препарат испытывают также при фиброзирующем альвеолите и для лечения ночного апноэ. Кроме того, активно изучают возможность использования N-АЦ при широком спектре интоксикаций (суммарно 16 % исследований), в онкологии, эндокринологии, психиатрии, акушерстве, при инфекциях.
Таблица Направления клинических испытаний N-АЦ
| Тема исследований | N (%) |
| Контраст-индуцированная нефропатия, в т. ч.: | 19 (32) |
| - аортокоронарное шунтирование | 4 |
| - профилактика острой почечной недостаточности | 1 |
| - профилактика хронической почечной недостаточности | 1 |
| - кардиохирургические вмешательства без уточнения | 5 |
| - катетеризация сердца | 2 |
| - периферическая ангиография | 3 |
| Пульмонология, в т. ч.: | 7 (12) |
| - фиброзирующий альвеолит | 1 |
| - хроническая обструктивная болезнь легких | 3 |
| - ночное апноэ | 1 |
| - бронхит | 2 |
| Хроническая почечная недостаточность | 6 (10) |
| Интоксикация лекарствами, в т. ч.: | 5 (8) |
| - ацетаминофен | 1 |
| - антагонисты N-метил-D-аспартат (NMDA) рецепторов | 1 |
| - аминогликозиды | 1 |
| - противотуберкулезные препараты | 1 |
| Интоксикация другими веществами, в т.ч.: | 5 (8) |
| - алкоголем | 1 |
| - частицами дизельного выхлопа | 1 |
| - кокаином | 1 |
| Онкология | 4 (7) |
| Сахарный диабет | 4 (7) |
| Наследственные заболевания | 2 (3) |
| Острая печеночная недостаточность | 2 (3) |
| Психиатрия | 2 (3) |
| Акушерство | 2 (3) |
| Гипербарическая оксигенация | 1 (2) |
| Малярия | 1 (2) |
| Итого | 59 (100) |
Столь широкий диапазон применения N-АЦ обоснован новыми патофизиологическими данными о механизмах действия этого препарата.
Новые механизмы действия N-АЦ
N-АЦ – производное незаменимой серосодержащей аминокислоты метионина, входящей в состав ряда пищевых продуктов (например, животного белка и бобовых). Главная функция метионина в организме – служить основным источником сульфгидрильных групп, входящих в состав цистеина. Эти группы разрушают активные формы кислорода (АФК), вызывающие большое количество повреждений. Цистеин поступает в клетки с помощью нескольких высокоактивных АТФ-зависимых переносчиков; особенно много их в клетках печени, кишечника, канальцев почек (поэтому при снижении содержания цистеина эти органы страдают в первую очередь).
Потребность организма здорового взрослого человека в метионине составляет 1,1 г/сут [2], она повышена у детей и, как предполагают, у пожилых. Однако одно из производных метио-нина – гомоцистеин – способствует развитию атеросклероза, поэтому увеличение суточного потребления метионина у пожилых может оказаться нежелательным [3].
В то же время N-АЦ хорошо всасывается и легко проникает в клетки (после приема внутрь в клетках оказывается практически 90 % вещества [4]). Терапевтический диапазон N-АЦ достаточно широк: в эксперименте на крысах токсического действия не вызывало назначение даже 1000 мг/кг препарата (что соответствует дозе 70 г/сут для человека весом 70 кг) [5]. Внутривенное введение N-АЦ здоровым добровольцам в дозе 160 мг/кг (11 г/сут для человека весом 70 кг) несколько снижало содержание витамин К-зависимых факторов свертывания, однако свертывание крови при этом не нарушалось [6]. Тем не менее при кровотечениях N-АЦ назначать не рекомендуют. В клинических условиях прием высоких доз препарата приводил в основном к желудочно-кишечным расстройствам, в редких случаях — к появлению высыпаний; внутривенное введение (в дозах до 150 мг/кг в течение 15 минут) сопровождалось появлением отеков и тахикардии [7]. В одном наблюдении при ошибочном введении препарата в дозе 2450 мг/кг развился эпилептический припадок и пациент погиб [8].
В цитоплазме клеток из цистеина (или N-АЦ), глутамата и глицина син-теризуется трипептид глутатион, причем скорость этого процесса зависит именно от поступления цистеина. Содержание глутатиона в клетке в сотни раз выше, чем цистеина; наиболее высоко оно в клетках печени и кишечника. Глутатион синтезируется в цитоплазме, и для его переноса в органеллы с наиболее активным уровнем окислительных процессов (а значит, и образования АФК) – митохондрии – также требуется переносчик и расходуется АТФ (рис. 1). N-АЦ проникает в митохондрии легче, поэтому его преимущества наиболее ярко проявляются в клетках, где транспортные системы работают с высокой нагрузкой и в первую очередь страдают при патологических процессах, например в клетках канальцев почек.
Рис. 1. Роль N-ацетилцистеина в синтезе глутатиона (GSH)
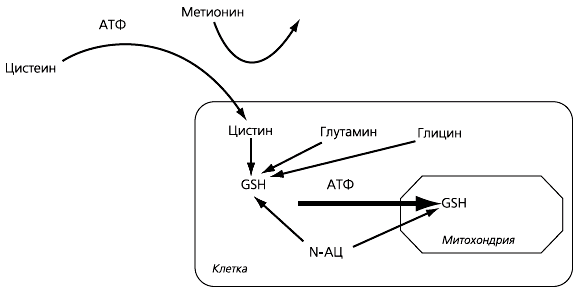
Основная функция глутатиона – инактивировать АФК в реакции восстановления, и при ее нарушении развивается повреждающий клетку оксидантный стресс. Процессы восстановления/окисления глутатиона являются ферментативными, причем на них оказывают влияние АФК, многие токсические вещества, дефицит селена (необходимого для функционирования фермента глутатионпероксидазы). N-АЦ также содержит SH-группу и способен инактивировать АФК, поэтому его применение обеспечивает помимо восполнения дефицита глутатиона и непосредственное антиоксидантное действие (рис. 2).
Рис. 2. Механизмы оксидантного стресса и протективные эффекты N-ацетилцистеина
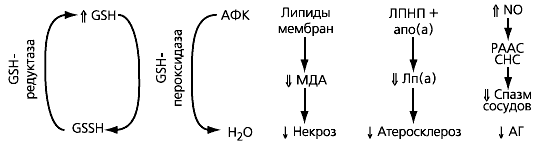
Примечание. GSH/GSSH - восстановленный/окисленный глутатион; АФК - активные формы кислорода (Н202, О۫, 02-); МДА - малоновый диальдегид (продукт перекисного окисления липидов); ЛПНП - липопротеины низкой плотности; Апо(а) - аполипопротеин а; Лп(а) - липопротеин а; N0 - нитроксид; РААС - ренин-ангиотензин-альдостероновая система; СНС - симпатическая нервная система; АГ - артериальная гипертония; ↑↓ - подавление/активация под влиянием N-АЦ.
Нарушение инактивации АФК приводит к разнообразным последствиям.
В частности, оно вызывает перекисное окисление липидов мембран, в результате чего эти мембраны разрушаются (при этом образуется малоновый диальдегид, содержание которого можно определить в плазме и моче) и клетки погибают. Наиболее значимы эти процессы для тканей с высоким содержанием липидов, например тканей головного мозга и печени; в то же время показано, что введение N-АЦ снижает образование малонового диальдегида и клетки живут дольше [9].
Неблагоприятное действие АФК усиливается, если они действуют сочетанно с другими повреждающими факторами, как происходит при многих интоксикациях, например тяжелыми металлами (свинцом, кадмием, мышьяком) [10, 12]. Все эти металлы вызывают оксидантный стресс, а их длительное воздействие приводит к образованию опухолей кожи, легких, почек. Показано, что терапия N-АЦ способствует их более активному выведению, причем при острой интоксикации кадмием N-АЦ в сочетании со специфическим антидотом действовал статистически значимо активнее, чем цистеин [11].
Под влиянием АФК липопротеины низкой плотности (ЛПНП) окисляются и связываются с гликопротеином апо (а), образуя липопротеин (а); макрофаги сосудистой стенки поглощают окисленные ЛПНП и липопротеин (а), в результате чего формируются атеросклеротические бляшки. Показано, что N-АЦ предотвращает окисление ЛПНП, разрывает дисульфидные связи в молекуле липопротеина (а) и тем самым расщепляет и инактивирует его. Более того, из всех пищевых веществ именно N-АЦ наиболее активно способствует снижению уровня липопротеина (а), уменьшая его почти на 70 % [13]. Следует отметить, что введение N-АЦ способствует повышению уровня NO. Все эти факты стали одной из причин активного изучения N-АЦ в кардиологии в последние годы.
Клинические испытания и применение N-АЦ
КИН считается третьей по частоте причиной острой почечной недостаточности у госпитализированных пациентов, причем механизм ее развития включает как непосредственное токсическое повреждение клеток канальцев почек, так и преходящую вазоконстрикцию. Особенно часто это поражение развивается при чрескожных коронарных вмешательствах при остром инфаркте миокарда. Это делает вполне обоснованным проведение в данной ситуации клинических испытаний N-АЦ. В проспективном исследовании препарата у 354 больных в первые 12 часов развития инфаркта миокарда с подъемом сегмента ST (средний возраст – 62 ± 12 лет; 80 % мужчины) N-АЦ назначали в стандартной (600 мг внутривенно струйно перед вмешательством и по 600 мг внутрь 2 раза в сутки в течение 48 часов, общая доза – 3000 мг; n = 115) или высокой дозе (1200 мг внутривенно струйно, затем внутрь по 1200 мг 2 раза в сутки в те же сроки, общая доза – 6000 мг; n = 118). Пациентам контрольной группы (n = 119) рандомизированно назначали плацебо [14].
Частота развития КИН составила в целом 19 %; независимыми факторами ее риска были исходные скорость клубочковой фильтрации почек ≤ 60 мл/мин и фракция выброса сердца ≤ 40 %. Отношение шансов развития КИН в контрольной группе по сравнению с группами N-АЦ составило: 2,60 – для стандартной (р = 0,007) и 5,78 – для высокой доз препарата (р Среди традиционных областей клинического применения N-АЦ остается хроническая обструктивная болезнь легких (ХОБЛ). В 1997–2005 гг. в Европе было проведено крупное исследование BRONCUS с участием 523 пациентов с ХОБЛ, связанным с курением [15]. Больным рандомизированно назначали N-АЦ по 600 мг/сут (n = 256) или плацебо (n = 267). Определяли динамику снижения объема форсированного выдоха за 1 секунду (ОФВ1) и частоту обострений заболевания, дополнительно оценивали качество жизни. Большинство больных выбыли из исследования преждевременно, причинами отказа от терапии были несоблюдение режима приема препарата и развитие побочных эффектов (чаще – в группе плацебо). В целом длительный прием N-АЦ в дозе по 600 мг/сут не изменял динамики снижения ОФВ1 и жизненной емкости легких, не влиял на частоту обострения ХОБЛ и качество жизни больных. Отмечены тенденции к терапевтическому эффекту терапии препаратом у пациентов, не принимавших ингаляционные стероиды, а также к уменьшению выраженности эмфиземы легких. В более ранних работах не было продемонстрировано положительного влияния N-АЦ при лечении обострений ХОБЛ (добавление к терапии стероидами и бронходилаторами) [16]. Следует, однако, отметить, что препарат применяли в невысоких дозах, а в недавно вышедшей Стратегии диагностики, лечения и профилактики ХОБЛ (GOLD, 2006) данные об эффективности N-АЦ отнесены к группе доказательности В и подчеркивается его эффективность у пациентов, не получавших ингаляционные стероиды.
При идиопатическом фиброзирующем альвеолите, сопровождавшемся активным воспалением в интерстиции легких с активацией выработки АФК, приводящим к фиброзу, применение N-АЦ изучали в крупном рандомизированном многоцентровом исследовании IFIGENIA (Idiopathic Pulmonary Fibrosis International Group Exploring N-Acetylcysteine I Annual) [17]. В исследовании участвовали 182 больных, получавших стандартную терапию преднизолоном и азатиоприном, которым рандомизированно назначали N-АЦ по 600 мг 3 раза в сутки (n = 92) или плацебо (n = 90). Через 12 месяцев лечения N-АЦ отмечено достоверное повышение жизненной емкости легких на 0,18 л (при 95 % доверительном интервале от 0,03 до 0,32), или на 9 % (p = 0,02), а также диффузионной способности легких на 0,75 ммоль/мин/кПа (при 95 % доверительном интервале от 0,27 до 1,23; p = 0,0003) по сравнению с плацебо. За время наблюдения исследователи не отметили различий между группами по смертности.
В отношении развития нежелательных эффектов значимых различий также не отмечено, за исключением миелотоксического действия высоких доз N-АЦ (p = 0,03). При этом авторы подчеркивают, что статистическая мощность исследования для оценки влияния N-АЦ на клинические конечные точки была недостаточной, а обнаруженное влияние на показатели прогрессирования заболевания позволяет рекомендовать его применение в составе комбинированной терапии идиопатического фиброзирующего альвеолита. Клинически сходно с идиопатическим фиброзирующим альвеолитом протекает редкий наследственный синдром Хермански–Пудлака (Hermansky–Pudlak); для его лечения N-АЦ предложено применять не в качестве монотерапии (оказавшейся малоэффективной), а в составе комбинированного лечения. В настоящее время начато исследование сочетания терапии N-АЦ с правастатином, лозартаном, зилеутоном, эритромицином [18]. Авторы исследования предлагают проводить терапию фиброзирующего альвеолита с применением многокомпонентных лекарственных схем, аналогично тому, как это делается при лечении онкологических заболеваний.
N-АЦ применяют также при интоксикации различными веществами: парацетамолом, паракватом, четырех-хлористым углеродом, хлороформом, моноксидом углерода, этиловым спиртом; а также для уменьшения побочных эффектов ряда лекарственных препаратов (доксорубицина, вальпро-евой кислоты, ифосфамида, цисплатина). Наиболее убедительные данные об эффективности N-АЦ, подтвержденные в клинических испытаниях, получены в отношении терапии отравления парацетамолом. При интоксикации парацетамол на 90 % метаболизируется в печени системой цитохрома Р450, функционирование которой сопровождается образованием большого количества АФК. Активация этой системы приводит к быстрому истощению в печени запасов глутатиона, что вызывает цитолиз гепатоцитов. N-АЦ инактивирует АФК, стимулирует образование глутатиона, а возможно, и непосредственно метаболизирует парацетамол. Этим может объясняться наибольшая эффективность препарата при введении в первые 8 часов после отравления. Препарат рекомендуют вводить в дозе 140 мг/кг внутрь однократно, затем по 70 мг/кг внутрь каждые 4 часа до 17 раз либо внутривенно до 2400 мг/сут. В США N-АЦ внутривенно вводить не принято, хотя это безопасно и эффективно [19].
В целом при мета-анализе 46 плацебо-контролируемых клинических испытаний N-АЦ при приеме внутрь выявлено, что он оказывал положительное действие в отношении конечных критериев оценки и/или качества жизни пациента в двух третях исследований [20]. Это позволяет надеяться, что в ближайшие годы спектр областей клинического применения N-ацетилцистеина значительно расширится.
ЛИТЕРАТУРА
1. http://www.who.int/trialsearch
2. Rose WC. Amino acid requirements of man. Nutr Rev 1976;34:307–09.
3. van de Poll MCG, Dejong CHC, Soeters PB. Adequate Range for Sulfur-Containing Amino Acids and Biomarkers for Their Excess: Lessons from Enteral and Parenteral Nutrition. J Nutr 2006;136:1694S–1700S.
4. Passwater RA. N-Acetylcysteine (NAC): An Old Nutrient Attracts New Research. healthy.net/scr/Article.asp
5. Bonanomi L, Gazzaniga A. Toxicological, phar-macokinetics and metabolic studies onacetylcy-steine. Eur J Respir Dis 1980;61(Suppl.):45–51.
6. Knudsen TT, Thorsen S, Jensen SA, et al. Effect of intravenous N-acetylcysteine infusion on haemostatic parameters in healthy subjects. Gut 2005;54:515–21.
7. Cooper M. AIDS – Drug therapy; Acetylcysteine research. CDC AIDS Weekly p4 (Oct. 2, 1989).
8. Bailey B, Blais R, Letarte A. Status epilepticus after a massive intravenous N-acetylcysteine overdose leading to intracranial hypertension and death. Ann Emerg Med 2004;44:401–06.
9. Neal R, Yang P, Fiechtl J, et al. Pro-oxidant effects of delta-aminolevulinic acid (delta-ALA) on Chinese hamster ovary (CHO) cells. Toxicol Lett 1997;91:169–78.
10. Lyn P. Toxic Metals and Antioxidants: Part II. The Role of Antioxidants in Arsenic and Cadmium To-xicity. Altern Med Rev 2003;8(2):106–28.
11. Tandon SK, Prasad S, Singh S. Chelation in metal intoxication: influence of cysteine or Nacetyl cy-steine on the efficacy of 2,3-dimercaptopro-pane-1-sulphonate in the treatment of cadmium toxicity. J Appl Toxicol 2002;22:67–71.
12. Мухин Н.А., Балкаров И.М., Шоничев Д.Г. и др. Формирование артериальной гипертонии при уратном тубулоинтерстициальном поражении почек. Терапевтический архив. 1999. № 6. С. 23–27.
13. Stalenhoef AFH, et al. N-acetylcysteine and lipo-protein. Lancet 1991;337:491.
14. Marenzi G, Assanelli E, Marana I, et al. N-Acetylcy-steine and Contrast-Induced Nephropathy in Primary Angioplasty. N Engl J Med 2006;354: 2773–82.
15. Decramer M, Rutten-van Muelken M, Dekhuij-zen PNR, et al. Effects of N-acetylcysteine on outcomes in chronic obstructive pulmonary disease (Bronchitis Randomized on NAC Cost-Utility Study, BRONCUS): a randomised placebocon-trolled Trial. Lancet 2005;365:1552–60.
16. Black PN, Morgan-Day A, McMillan TE, et al. Randomised, controlled trial of N-acetylcysteine for treatment of acute exacerbations of chronic obstructive pulmonary disease [ISRCTN21676344]. BMC Pulm Med 2004;4:13.
17. Demedts M, et al. High-Dose Acetylcysteine in Idiopathic Pulmonary Fibrosis. N Engl J Med 2005;353:2229–42.
18. Pilot Study of a Multi-Drug Regimen for Severe Pulmonary Fibrosis in Hermansky-Pudlak Syndrome. ClinicalTrials.gov identifier: NCT00467831.
19. Polin RA, Ditmar MF. Pediatric Secrets, 3rd Edition. Hanley & Belfus. 2001;5:119.
20. Atkuria KR, Mantovania JJ, Herzenberga LA, Herzenberg LA. N-Acetylcysteine – a safe antidote for cysteine/glutathione deficiency. Curr Opin Pharmacol 2007;7(4):355–59.
Комментарии
ПРАКТИКА ПЕДИАТРА
